Термодинамические характеристики химических процессов.
Для термодинамического анализа в химической технологии решаются следующие задачи:
1. Проверяются возможности самопроизвольного протекания проектируемого химического процесса.
2. Определение энергетических эффектов химико – технологических процессов, необходимых для составления энергетических балансов и расчета затрат энергии на проведение ХТП.
3. Расчет максимально возможных степеней превращения и выходов продуктов целевых, побочных, нецелевых при проведении обратимых процессов.
4. Определение диапазона теиператур и давлений, при которых наиболее рационально осуществлять ХТП.
Как известно из курса физической химии условием протекания химической реакции в прямом направлении без затраты работы является уменьшение свободной энтальпии системы. (Энтальпия равна сумме внутренней энергии системы и призведения давлении на ее объем, Изменение энтальпии в изобарном процессе равно его тепловому эффекту. Энтальпия – теплосодержание).
Энергетические эффекты при протекании ХТП оценивают на основе теплот образования и сгорания веществ. Для многих веществ теплоты образования и сгорания известны и сведены в таблицы. Их называют стандартными тепловыми эффектьами и обозначают Δ Н. При оценке максимально возможных степеней превращения Хмакс необходимо учесть, что для необратимых процессов Хмакс= 1.
Константы равновесия и расчет равновесных степеней превращения.
|
|
|
Глубину протекания обратимых ХТП и диапазон рабочих температур давлений можно определить на основе данных о равновесии химической реакции. Все ХТП стремятся к равновесию, при котором скорости прямого и обратного процессов уравниваются и соотношение концентраций, определяющее равновесную степень превращения Х*= , остается неизменным, пока не изменятся внешние условия.
Для количественной оценки состояния равновесия используют значения констант равновесия, равновесных концентрации реагентов С*, равновесных степеней превращения Х* и выходов продуктов Ф*.
В общем случае для реакции аА + bB + …. ↔ dD + eE + ….. константы равновесия можно выразить через равновесные концентрации реагентов(С* i ): К с = (С* D ) d · ( С* E ) e …./[(С* А ) а ·(С*В) b ]…
Для газов константа равновесия выражается через равновесные парциальные давления реагентов (Р* i):
К с = ( P * D ) d · ( P * E ) e …./[( P * А ) а ·( P *В) b ]…
При технологических расчетах константы равновесия иногда выражают через мольные доли реагентов в состоянии равновесия (N*i):
К N = ( N * D ) d · ( N * E ) e …./[( N * А ) а ·( N *В) b ]…
Для реакций, протекающих с изменением числа молей, численные значения констант равновесия зависят от формы записи стехиометрического уравнения реакции. Например, реакцию окисления оксида серы (IV0можно записать в виде:
|
|
|
SO2 + 0,5 O2 ↔ SO3 или 2 SO2 + O2 ↔ 2 SO3
Для первого случая:
К с1 = (С* SO 3 ) /[(С* SO 2 ) ·(С* O 2 )0,5]
Для второго случая:
К с2 = (С* SO 3 ) 2 /[(С* SO 2 ) 2 ·(С* O 2 )]
__
К с1 и К с2 имеют разные размерности и К с1= 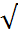 К с2
К с2 
Аналогично для указанных реакций Кр1 ≠ Кр2 и КN1≠ KN2
В общем случае Кс ≠ Кр ≠ КN.
Связь между этими величинами устанавливается на основе уравнения Менделеева – Клайперона и закона Дальтона. Уравнение Менделеева – Клайперона устанавливает связь между парциальным давлением i –того компонента газовой смеси (Р i ) и его молярной концентрацией (С i ):
Р i · 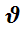 = ni · RT
= ni · RT
С* i = ni /  = Р i / ( RT ), где:
= Р i / ( RT ), где:
ni –число молей вещества , 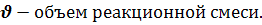
Связь между парциальным давлением i-того компонента (Рi), общим давлением смеси (Робщ) и мольными долями (Ni) представлена в формулах:
n
Робщ = Σ Р i ; Р i = Ni ·Робщ
i =1
Таким образом, константы равновесия Кс, Кр, и К N связаны между собой соотношениями:
Кр= Кс 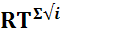
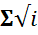 - алгебраическая сумма стехиометрических коэффициентов при реагентах и при продуктах реакции, коэффициенты при реагентах и продуктах реакции. Коэффициенты при продуктах реакции –положительные, а при исходных реагентах – сознаком минус. Значения констант равновесия для различных реакций приведены в справочных таблицах.
- алгебраическая сумма стехиометрических коэффициентов при реагентах и при продуктах реакции, коэффициенты при реагентах и продуктах реакции. Коэффициенты при продуктах реакции –положительные, а при исходных реагентах – сознаком минус. Значения констант равновесия для различных реакций приведены в справочных таблицах.
|
|
|
Значения Кс, Кр не зависят от конценорации реагентов и их соотношений, наличия примесей и разбавителей, ни от авления (если газы идеальные, а давление не очень велико). Константы химического равновесия зависят лишь от природы реагентов и температуры. Связь между константой равновесия и температурой описывается уравнением изобары Ван-Гоффа:
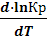 =
= 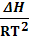 После интегрирования этого уравнения в пределах изменения температуры отТ1 до Т2 при условии, что Δ Н ( стандартный тепловой эффект Δ Н) не зависит от величины Т (тепловой эффект не изменяется) получаем
После интегрирования этого уравнения в пределах изменения температуры отТ1 до Т2 при условии, что Δ Н ( стандартный тепловой эффект Δ Н) не зависит от величины Т (тепловой эффект не изменяется) получаем
lg ( Kp 1/ Kp 2=[ 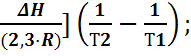
Значения констант равновесия используют для расчета составов равновесных смесей и определения максимально возможных степеней превращения
Хмакс =Х* или выходов продукта Ф*.
Если значения констант равновесия зависят только от природы реагентов и температуры, то на равновесные составы , степени превращения и выходы продуктов влияет помимо температуры давление, концентрация исходных веществ, наличие примесей и разбавителей. Влияние этих параметров определяет принцип Ле Шателье, согласно которому в системе выведенной внешним воздействием из состояния равновесия происходят изменения, направленные к ослаблению воздействий, выводящих систему из равновесия. Например, для экзотермических процессов повышение температуры должно привести к изменениям в системе, которые обеспечили бы уменьшение тепловыделения. Этому соответствует сдвиг равновесия влево, в сторону образования исходных веществ. Эндотермическим процессам соответствует обратная картина.
|
|
|
Рис. Влияние температуры на равновесную степень превращения при протекании обратимых экзотермических (1) и эндотермических (2)процессов.
Для газофазных процессов, протекающих с повышением объема, увеличения давления будет приводить к уменьшению равновесной степени превращения или сдвигу равновесия влево. Если в процессе превращения число молей реагирующей смеси уменьшается, то увеличение давления вызывает такое изменение в равновесной смеси, которое компенсирует внешнее воздействие, т.е. должна увеличиться степень превращения, что приведет к уменьшению числа молей смеси и падению давления.
Рис. Влияние давления на равновесную степень превращения при протекании реакций с уменьшением (1) и увеличением (2) объема.
Вывод по графикам. В рассмотренных случаях степень смещения равновесия зависит от абсолютного значения теплового эффекта реакции и от относительного изменения объема реакционной смеси. Чем больше ΔН, тем значительнее влияние температуры. Чем больше относительное изменение объема реакционной смеси εА (относительное изменение объема реакционной смеси при полном превращении реагента А), тем сильнее увеличение давления на сдвиг равновесия.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительного количества какого – либо компонента сдвигает равновесие в направлении уменьшения его концентрации. Поэтому избыток одного или нескольких исходных веществ способствует увеличению степени превращения других веществ, смещая равновесие вправо. Дополнительное введение продуктов реакции вызывает смещение равновесия влево. Удаление продуктов реакции из смеси позволяет более глубоко проводить химическое превращение. Этим обстоятельством широко пользуются в химической промышленности.
Например. При окислении оксида серы (4) SO2 в производстве серной кислоты реакцию проводят с избытком кислорода для более полного окисления SO2 в SO3, помимо этого выводят путем абсорбции из реакционной смеси образующийся оксид серы (6), что позволяет еще более повысить степень превращения оксида серы (4) в оксид серы (6).
Рис. Влияние избытка кислорода на равновесную степень окисления оксида серы (4) в оксид серы (6).
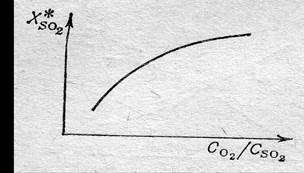
Введение в равновесную смесь инертного газа при постоянном давлении приводит к уменьшению парциальных давлений реагентов и, таким образом, эффект разбавления подобен эффекту уменьшения общего давления в системе.
Для количественной оценки влияния температуры, давления, концентраций, коэффициента избытка одного из реагентов и концентрации разбавителя используют соотношения между константами равновесия, равновесным составом и равновесной степенью превращения. Эти соотношения для каждого конкретного случая получают путем решения системы уравнений , задаваемых константами равновесия, и уравнений стехиометрического баланса. Вид формул, связывающих константы равновесия, равновесный состав и равновесную степень превращения, зависит от типа реакции.
Чаще всего при расчетах исходят из 1 моль основного реагента и определяют число молей других веществ. Например, при реакции, протекающей в газовой фазе: А + 2В ↔ D константу равновесия, выраженную через равновесные парциальные давления Р*i , можно записать в виде:
К р = Р* D / [ Р*А (Р*В )2]; (1)
Парциальное давление любого компонента по закону Дальтона равно:
Р i = ( n* i / 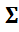 n* i ) · Р общ = N i · Р общ ; (2)
n* i ) · Р общ = N i · Р общ ; (2)
тогда для каждого конкретно:
Р*А = N *А ·Р общ ; Р*В = N * В ·Р общ ; Р*D = N * D ·Р общ ; (3)
n i – число молей i -того компонента в равновесной смеси;
n * i – общее число молей всех компонентов, составляющих равновесную смесь;
N * i – мольная доля i -того компонента в равновесной смеси;
После подстановки парциальных давлений, выраженных в соотношениях (3), в уравнение (1) получим:
К р = N * D / [ N *А ( N * В )2·Р2 общ ]; (4)
Пример.В основе технологического процесса лежит реакция, при которой число молей в исходной смеси n А,0 = 1, n В,0 = 2, n D, 0 =0. В равновесной смеси n *А= 1- у, n *В= 2(1-у), n *D= у. (у-число молей исходного вещества, прореагировавшего к моменту равновесия).
Суммарное число в равновесной смеси 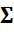 n * i = 3 – 2у. Состав равновесной смеси, определяемой мольными долями компонентов в ней:
n * i = 3 – 2у. Состав равновесной смеси, определяемой мольными долями компонентов в ней:
N *А =(1 – у)/(3-2у), N * В =2(1-у)/(3-2у), N * D =у/(3 – 2у) (5)
Тогда уравнение, связывающее известное значение константы равновесия К р с искомым значением у , для данной реакции принимает вид:
К р = у (3 – 2у)2 / [4(1 – у)3 ·Р2 общ]; (6)
Определив из уравнения (6) значение У и подставив его в уравнения (5), можно рассчитать состав равновесной смеси.
Т. К. при расчете на 1 моль основного компонента А количество превратившегося вещества А численно равно степени его превращения,
Т. е. у = Х*А, то соотношение (6) связывает К р и Х*А :
К р = Х*А· (3-2· Х*А )2 /[4·(1 - Х* А )3· Р общ];
Таким же образом можно получить уравнения, связывающие константы равновесия и равновесные степени превращения для различных мольных соотношений реагентов.
Дата добавления: 2019-11-25; просмотров: 479; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
