Применение катализаторов в гомогенных процессах (гомогенный катализ).
Химико - технологический процесс с химической реакцией, протекающей в присутствии катализатора называют каталитическим. Использование катализаторов облегчает практическое осуществление многих химических реакций. Их применяют как для получения неорганических продуктов (водорода, аммиака, серной и азотной кислот и др.) так и в технологии органических веществ. Каталитическими являются многие процессы в нефтепереработке: каталитический крекинг, риформинг, изомеризация, алкилирование, гидрогенолиз.
Катализом называют изменение скорости химических реакций в результате воздействия веществ – катализаторов, которые участвуют в реакции, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав по окончании реакции.
Катализаторы могут находиться в газообразном, жидком и твердом состояниях. По фазовому состоянию реагентов и катализатора каталитические процессы разделяют на гомогенные и гетерогенные.
Особенностью многих катализаторов является способность ускорять преимущественно какую- либо одну или группу сходных реакций. Поэтому подбирая соответствующие катализаторы, можно из большого числа термодинамически возможных реакций выбрать те, которые приводят к образованию требуемых продуктов. Таким образом, катализатор может изменять селективность химико – технологического процесса. Действие катализаторов не влияет на равновесие, а лишь ускоряет достижение равновесия при данной температуре. В этом смысле сущность катализа одинакова как гомогенного, так и гетерогенного. Все каталитические реакции по типу взаимодействия между реагентами и катализатором делят на окислительно-восстановительные и кислотно – основные.
Окислительно – восстановительный механизм катализа связан с переносом электронов между реагентами и катализатором, который облегчает электронные переходы в реагирующих молекулах. По этому принципу происходят процессы окисления, дегидрирования, конверсии углеводородов, синтез аммиака, метанола и др.
Механизм кислотно – основного катализа заключается в переносе положительно заряженного иона, например, протона, или отрицательного иона, например гидроксила, между катализаторами и реагентами, в результате чего происходят внутримолекулярные превращения, облегчающие взаимодействия исходных веществ. По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах и др.
Значительное число каталитических процессов в жидкостях и газах протекает по цепному механизму, в котором катализатор служит инициатором. Ускорение достигается в результате появления в процессе самой реакции богатых энергией частиц – свободных радикалов. По радикально – цепному механизму протекают реакции окисления алканов (например, метана в формальдегид), реакции хлорирования, полимеризации и др.
Общие закономерности каталитических реакций.
В основу катализа положена теория промежуточных соединений. Согласно этой теории , медленную реакцию между исходными веществами можно заменить двумя или несколькими более быстрыми реакциями с участием катализатора, который образует с исходными веществами промежуточные непрочные соединения. Ускоряющее действие катализатора состоит в понижении энергии активации реакций образующихся промежуточных соединений, что оказывает очень сильное влияние на скорость реакции, т.к. в уравнение Аррениуса
k = k 0·exp- E1 / RT k 0- предэкспотенциальный множитель(29)
Энергия активации Е входит в показатель степени.
В мономолекулярной каталитической реакции (К – катализатор):
К
А---------→В каталитический процесс протекает в 2 стадии:
k1 k3
А + К ⇄ АК---→ В + К;
k2
Чаще всего промежуточное соединение возникает в результате быстрой обратимой реакции. При этом устанавливается равновесие, которое можно описать уравнением:
k1 ·СА ·( Ск,о - СА к) = k2· СА к , где: (30)
Ск,о - начальная концентрация катализатора
СА к – концентрация промежуточного соединения
(Ск,о - СА к) – концентрация не связанного катализатора.
Поскольку 2-я стадия более длительна, то она определяет скорость процесса:
U = 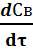 = k3 · САК; (31)
= k3 · САК; (31)
Из уравнения (30) можно определить концентрацию промежуточного соединения:
СА к = k1 ·СА · Ск,о /( k2 + k1· СА ) ; (32)
Подставив значение СА к из уравнения (32) в уравнение скорости (31) получим скорость гомогенно – каталитического процесса, которая пропорциональна начальной концентрации катализатора:
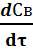 = k3 · k1 ·СА · Ск,о /( k2 + k1· СА ) ;
= k3 · k1 ·СА · Ск,о /( k2 + k1· СА ) ;
Основной недостаток гомогенного катализа – сложность полного отделения катализатора от продуктов реакции. Из– за этого возможны потери катализатора и загрязнение им продуктов реакции.
Дата добавления: 2019-11-25; просмотров: 367; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
