Влияние концентрации на избирательность.
На практике чаще всего приходится управлять сложными реакциями, к которым относятся обратимые, параллельные и последовательные. В таких реакциях протекает не одна – единственная, а две и более реакций с участием одних и тех же реагирующих веществ.
Влияние концентрации исходных веществ на протекание гомогенных процессов наиболее существенно для параллельных и последовательных реакций с разными порядками основной и побочной реакций.
Рассмотрим параллельные реакции, при которых одно вещество А участвует в двух реакциях, давая различные продукты В и D, причем основная реакция с получением целевого продукта описывается уравнением 2-го порядка, а побочная – уравнением 1 –го порядка:
k 1 k 1
2А----→ В А----→ D
В этом случае скорость образования целевого продукта В описывается уравнением: UВ = 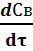 = k1 · С2А= k1 · [СА,О· (1 – ХА ) ]2 (11)
= k1 · С2А= k1 · [СА,О· (1 – ХА ) ]2 (11)
Скорость образования побочного продукта D:
U D = dC D/ 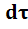 = k2 · С2= k2· СА,О· (1 – ХА ) (12)
= k2 · С2= k2· СА,О· (1 – ХА ) (12)
Избирательность, выраженная через соотношение скоростей U В и UD
равна: 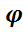 мгн В = U В / U D =( k1 / k2) · СА,0(1 – ХА ) ; (13)
мгн В = U В / U D =( k1 / k2) · СА,0(1 – ХА ) ; (13)
Из соотношения (10) видно, что увеличение начальной концентрации вещества А прямо пропорционально повышает избирательность и увеличивает выход продукта В согласно формуле (из предыдущего материала): ХА· 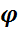 сум В = Ф B ( A ) ; (14)
сум В = Ф B ( A ) ; (14)
|
|
|
К аналогичному выводу можно прийти, если проанализировать кинетику последовательных реакций. Например, в случае двух последовательных необратимых реакций, в которых кинетика получения основного продукта В
Описывается уравнением 2 – го порядка , а побочного продукта D описывается уравнением 1 –го порядка, соотношение количеств
В и D растет пропорционально начальной концентрации исходного реагента А. Соответственно увеличивается и избирательность.
Методы увеличения концентрации.
Для повышения исходных концентраций реагентов в гомогенных системах применяют следующие методы:
Для газов: сорбция реагентов из смесей с последующей десорбцией в более концентрированном виде, сжатие, сжижение, растворение газов для проведения реакции в растворе.
Для жидкостей: выпаривание, вымораживание, сорбция и последующая десорбция необходимых компонентов в более концентрированном виде, дополнительный ввод реагентов в раствор с последующим растворением твердых или смешением жидких концентратов.
Влияние температуры на скорость процесса, выход продукта и избирательность.
В химической технологии одним из самых распространенных приемов увеличения скорости реакций является нагревание.
|
|
|
Для необратимых гомогенных процессов увеличение скорости реакций с ростом температуры обусловлено только повышением константы скорости реакции. В обратимых процессах изменение температуры влияет на значение движущей силы процесса через изменение константы равновесия и равновесных концентраций реагентов, входящих в состав выражения Δ С.
Для процессов с параллельными и последовательными реакциями увеличение температуры может значительно влиять на избирательность при одновременном ускорении основной и побочных реакций.
Дата добавления: 2019-11-25; просмотров: 241; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
