Закономерности гомогенных процессов
Гомогенным называется процесс, в котором реагирующие вещества находятся в момент реакции в одной фазе. Гомогенные процессы в промышленности в основном осуществляются в газообразной или жидкой фазе. В технологии неорганических веществ к таковым можно отнести сжигание сероводорода или паров серы для производства оксида серы (4), окисление оксида азота (4) в производстве азотной кислоты. Также широко гомогенные процессы в газовой фазе используются в технологии органических веществ. Например, при высокотемпературном процессе хлорирования парафинов получают хлорорганические растворители.
В качестве гомогенных процессов в системе Ж – Ж в технологии неорганических веществ можно привести производство сульфата аммония путем взаимодействия аммиачной воды и серной кислоты:
2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O.
По такому же принципу протекают многие обменные реакции в растворах солей. В технологии органических веществ гомогенно в системе
Ж – Ж проводят процессы полимеризации винилацетата, получают этиленгликоль, простые и смешанные эфиры из спиртов и др.
При проведении гомогенных процессов химические реакции протекают во всем объеме реакционной смеси, и если реагенты в исходной смеси достаточно хорошо перемешаны, то диффузионные процессы не лимитируют общей скорости процесса, которая определяется, как правило, кинетикой химического превращения.
Закономерности гомогенных процессов применимы и для анализа гетерогенных процессов, протекающих в кинетической области.
|
|
|
Влияние концентрации на скорость реакции и степень превращения в гомогенных процессах
Математическую формулу, связывающую скорость с концентрациями, называют кинетическим уравнением реакции. Вид кинетического уравнения определяет порядок реакции, который равен сумме показателей степеней при концентрациях реагентов в уравнении. Влияние концентраций реагирующих веществ на скорость определяется законом действия масс. являющимся основным законом химической кинетики.
Для реакции: аА + bB + ……= продукты реакции
Кинетическое уравнение имеет вид:
U = 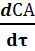 = k · Са'А·Сb'B· ….. (7)
= k · Са'А·Сb'B· ….. (7)
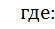 К – коэффициент скорости процесса;
К – коэффициент скорости процесса;
U - скорость процесса
С – концентрация
Порядок реакции m равен: m = а ' + b ' + …..
Порядок реакций в большинстве случаев не совпадает с молекулярностью реакций m ' = a + b + ….что объясняется сложным механизмом таких реакций. Показатель степени при концентрации какого – либо компонента в кинетическом уравнении (7) называют порядком реакции относительно этого компонента.
|
|
|
Простые необратимые и обратимые реакции.
Наиболее простые случаи гомогенных реакций описываются кинетическими уравнениями 2 – го и 2 –го порядков:
m = 1 - 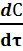 = k · C 1 – порядок (8)
= k · C 1 – порядок (8)
m = 2 - 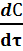 = k · C 2 2 – порядок (8)
= k · C 2 2 – порядок (8)
Как следует из уравнений, зависимость скорости реакции от концентрации значительно меняется при возрастании порядка реакции. Так, например, при увеличении текущей концентрации реагентов в 2 раза скорость реакции
1 – го порядка увеличивается в 2 раза, а для реакции 2 – го порядка увеличивается в 4 раза.
После интегрирования и последующих алгебраических преобразований кинетических уравнений получают формулы, описывающие взаимосвязь начальной и конечной концентраций исходных реагентов, времени, необходимого для достижения заданной степени превращения или выхода продукта. Для простых необратимых реакций 1 –го порядка эти формулы имеют вид: τ =(1/k) ·ln (СА,О / СА) = (1/k) · ln [1/(1 – 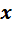 ) ] (9)
) ] (9)
 СА = СА,О · exp (- k τ)
СА = СА,О · exp (- k τ)
ХА = 1 - exp (- k τ)
Для технологии важно знание влияния начальной концентрации реагентов на среднюю скорость процесса, так как эта зависимость определяет конечную производительность установки. На основании формулы (8) можно утверждать, что для реакции 1- го порядка:
|
|
|
Ū = (СА,О - СА)/ τ = k· СА,О· ХА / ln[1/(1 – 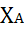 ) ] (10)
) ] (10)
На основании(9)можно утверждать, средняя скорость Ū линейно увеличивается с ростом СА,О при заданном постоянном значении степени окисления ХА.
Влияние концентрации на скорость обратимых реакций аналогично, хотя выражение движущей силы процесса Δ С, в которую входит начальная концентрация, имеет более сложный вид.
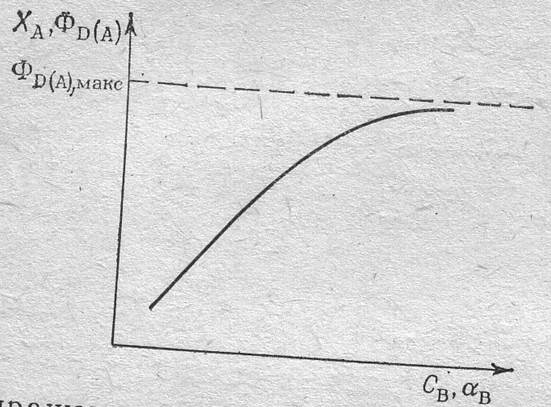
Как известно, для простых необратимых и обратимых реакций выход целевого продукта по какому – либо веществу численно равен степени превращения этого вещества. Если в реакции участвуют два вещества А и В, то увеличение концентрации одного из них, (например, В) приводит к повышению выхода продукта (например, D) по другому веществу Ф D ( A ).
Этот прием распространен в практике, когда необходимо более полно использовать дорогостоящее или вредное для окружающей среды
вещество А. Увеличивая избыток другого (более дешевого или безвредного) вещества В путем увеличения его концентрации Св, повышают степень превращения дорогого вещества Х А и выход продукта по этому веществу ФD(A). При этом верхний предел выхода ФD(A) макс. Для необратимых реакций равен 1, а для обратимых реакций –равновесному выходу.
|
|
|
Рис. Влияние повышения концентрации Св и коэффициента избытка
Α в вещества В на степень превращения вещества А и выход продукта D по веществу А в реакции А + В ↔ D .
Дата добавления: 2019-11-25; просмотров: 303; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
