Метод флуоресцирующих антител (МФА), иммуноферментный анализ (ИФА) и радиоиммунный анализ (РИА)
Метод флуоресцирующих антител
Реакция иммунофлуоресценции (РИФ) основана на соединении АГ бактерий, риккетсий и вирусов со специфическими АТ, меченными флуоресцирующими красителями (флуоресцеинизотиоцианат, родамин, В-изотиоцианат, лиссамин-родамин В-200, сульфохлорид и др.), имеющими реакционно-способные группы (сульфохлорид, изотиоцианат и др.). Эти группы соединяются со свободными аминогруппами молекул АТ, которые не теряют при обработке флуорохромом специфического сродства к соответствующему АГ. Образовавшиеся комплексы АГ-АТ становятся хорошо видимыми, ярко светящимися структурами под люминесцентным микроскопом.
Преимущество РИФ – простота, высокая чувствительность, скорость получения результата. РИФ применяется как метод ранней экспресс-диагностики гриппа, дизентерии, малярии, чумы, туляремии, сифилиса и др. РИФ используется для выявления аутоАТ к гладкой мускулатуре, митохондриям, антиядерных, антинуклеарных и других АТ.Для их обнаружения в сыворотке крови больного обычно используют срезы желудка и почки крыс.
При некоторых заболеваниях внутренних органов, в развитии которых имеет значение процесс иммунного воспаления или иммунной агрессии, в сыворотке крови можно обнаружить аутоАТ к гладкой мускулатуре, эритроцитам, иммуноглобулинам, митохондриям, антиядерные (антинуклеарные) АТ, АТ к ДНК, противоопухолевые АТ и другие. Самым распространенным тестом обнаружения аутоАТ в исследуемой сыворотке является метод иммунофлуоресценции, имеющий несколько модификаций. При прямой иммунофлуоресценции (ПИФ) (рис. 60) к исследуемому препарату (например, срезам тканей), содержащему искомый АГ, добавляют антисыворотку с АТ к этому АГ. Предварительно АТ метят флуорохромом. В результате взаимодействия АГ и АТ образуется иммунный комплекс, который фиксируется только в тех участках ткани, где имеется данный АГ. Эти участки легко обнаруживаются при микроскопии в ультрафиолетовом свете по характерному свечению – флуоресценции.
|
|
|
При использовании метода ПИФ относительно часто получают также ложноположительные результаты, поэтому его предлагается использовать только как ориентировочный (скрининговый) метод выявления патогена. Получение ложноположительных результатов может быть обусловлено, прежде всего, низким качеством диагностических наборов и субъективным характером трактовки получаемых данных.
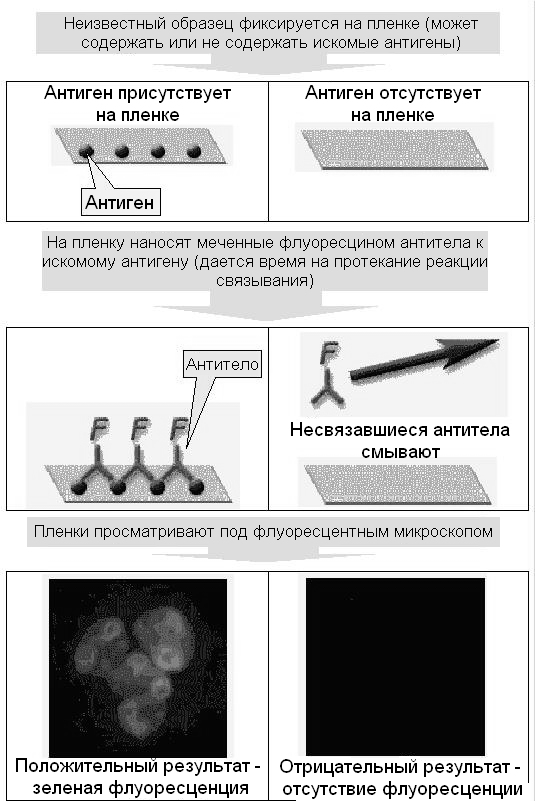
Рис. 60. Метод ПИФ
В клинической практике чаще используют метод непрямой иммунофлуоресценции (НИФ). На срезы тканей различных органов животных, содержащих известные АГ, наносится исследуемая сыворотка (рис. 61а). Если в ней содержатся АТ (иммуноглобулины) к данному тканевому АГ, происходит реакция связывания этих АТ с АГ (рис. 61б). Несвязавшиеся белки тщательно отмывают и на срезы тканей наносят противочеловеческую IgG-антисыворотку, меченную флуорохромом (рис. 61в). В результате АТ с флуорохромной меткой против человеческих иммуноглобулинов (например, против IgG), содержащиеся в антисыворотке (АТ к АТ-иммуноглобулинам класса G), связываются только с иммуноглобулинами (АТ), которые присутствовали в исследуемой сыворотке больного и остались фиксированными на соответствующих (известных) АГ ткани (рис. 61г). Люминесценция этих фиксированных АТ хорошо выявляется при микроскопии ткани в ультрафиолетовом свете.
|
|
|

Рис. 61. Схема НИФ:а – нанесение исследуемой сыворотки на срезы тканей с известным АГ, б – реакция связывания АТ с АГ, в – внесение стандартной антисыворотки, содержащей АТ к иммуноглобулинам человека, меченные флуорохромом, г – фиксация этих АТ на АТ к искомому АГ
Таким образом, на первом этапе НИФ происходит как бы «закрепление» АТ больного в тех местах ткани, где локализованы соответствующие АГ, а на втором этапе – их обнаружение с помощью АТ сыворотки к этим иммуноглобулинам, меченных флуорохромом.
|
|
|
ИФА
ИФА или ELISA (от англ. enzyme-linked immuno sorbent assay) – лабораторный иммунологический метод качественного определения и количественного измерения АГ.
ИФА также основан на учете реакции АГ-АТ, причем в качестве метки, позволяющей обнаружить иммунный комплекс, используют ферменты, например, пероксидазу. В основе ИФА лежит принцип взаимодействия иммуносорбента (АГ возбудителя инфекции) с выявляемыми АТ и в соединении этого комплекса АГ-АТ с иммуноглобулинами, содержащими ферментную метку.
Иммуноглобулины, применяемые в таких тест-системах, так называемый конъюгат, могут быть получены на основе антивидовых АТ (например, кроличьи АТ против иммуноглобулинов человека) или на основе АТ, направленных против человеческих иммуноглобулинов определенного класса (M, G, А).
В зависимости от того, какие АТ использованы, тест-система будет выявлять в исследуемом образце или специфические АТ независимо от их класса, или АТ лишь определенного класса (например, только иммуноглобулин G или только иммуноглобулин M).
Существует несколько методов постановки реакции, однако в настоящее время используется в основном следующая схема (рис. 62).

Рис. 62. Схема проведения ИФА: а – АТ против АГ сорбированы на стенках пробирки, б – добавление исследуемой сыворотки к искомым АГ, которые взаимодействуют с АТ и фиксируются на стенках пробирки, в – введение АТ к данному АГ, меченных ферментом (пероксидазой), которые также фиксируются на стенках пробирки, г – добавление перекиси водорода и хромогена, который под действием кислорода, выделяющегося при разложении Н2О2 пероксидазой, изменяет свой цвет на желтый
|
|
|
Вначале на стенках полистироловых пробирок сорбируют АТ против определенного АГ. В эту же пробирку вносят исследуемую сыворотку (или другой биологический субстрат). Если там содержатся искомые АГ, они взаимодействуют с АТ и вместе с ними фиксируются на стенках пробирки. После этого в пробирку вводят АТ к данному АГ, меченные ферментом, которые также присоединяются к образовавшемуся иммунному комплексу и остаются на стенках пробирки. Для обнаружения и количественной оценки этих комплексов в пробирку добавляют перекись водорода (Н2О2) и хромогены. Фиксированный к стенке пробирки фермент (пероксидаза) разлагает Н2О2 с выделением кислорода. Последний окисляет хромоген, который приобретает желтый цвет. Интенсивность окрашивания и, соответственно, количество искомого АГ оценивают спектрофотометрически или визуально.
Наиболее распространен твердофазный ИФА (рис. 63), при котором один из компонентов иммунной реакции (АГ или АТ) сорбирован на твердом носителе. В качестве твердого носителя используются микропанели из полистирола. При определении АТ в лунки с сорбированным АГ последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом, и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только АГ, но и АТ. Тогда в лунки с сорбированными АТ вносят искомый АГ, добавляют иммунную сыворотку против АГ, меченную ферментом, а затем – смесь растворов субстрата для фермента и хромогена. ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями.
По такому принципу построена основная масса тест-систем для иммуноферментной диагностики различных инфекций: ВИЧ-инфекция, вирусные гепатиты, цитомегаловирусная, герпесная, токсоплазменная и другие инфекции. Однако следует отметить, что иммуноферментный анализ может давать и ложные результаты. Ложноположительные могут возникнуть за счет ревматоидного фактора, представляющего собой иммуноглобулин M против собственных иммуноглобулинов G человека; за счет АТ, образующихся при различных системных заболеваниях, нарушениях обмена или приеме лекарственных препаратов; у новорожденных такие ложноположительные реакции могут возникать за счет образования в организме ребенка M-АТ к иммуноглобулину G матери. Ложноотрицательные результаты реакции обусловлены конкуренцией между иммуноглобулинами М и G, а также техническими ошибками при постановке реакции.

Рис. 63. ИФА, выявление АГ прямым и непрямым методами твердофазного ИФА
В зависимости от того, какие АГ используются, все иммуноферментные тест-системы для выявления АТ подразделяются на: 1) лизатные – в которых используется нативный АГ (лизированный или обработанный ультразвуком возбудитель инфекции, полученный в культуре); 2) рекомбинантные – в которых используются полученные генно-инженерным способом белки-аналоги определенных белковых АГ возбудителя; 3) пептидные – использующие химически синтезированные фрагменты белков.
Общее направление развития ИФА-диагностикумов – это направление от лизатных тест-систем, которые принято называть тест-системами первого поколения, к рекомбинантным и пептидным. Технология наработки рекомбинантных белков позволяет получить в достаточно чистом виде аналог любого отдельного АГ.
Для создания высококачественной рекомбинантной тест-системы необходимо из всего антигенного многообразия возбудителя выбрать АГ, которые были бы высокоиммуногенными (т. е. в организме инфицированного человека должны вырабатываться АТ к этим АГ в достаточно большом количестве) и высокоспецифичными (т. е. характерными лишь для данного возбудителя и не дающими перекрестных реакций с АТ другой природы).
Кроме того, большое значение имеет качество очистки рекомбинантных белков. В идеальном случае возможно получение рекомбинантной тест-системы практически со 100 %-ной специфичностью при высокой чувствительности. На практике этого не всегда удается достичь, однако специфичность лучших рекомбинантных тест-систем приближается к 100 %.
Таким образом, за счет несомненных преимуществ – удобства в работе, быстроты, объективности за счет автоматизации учета результатов, возможности исследования иммуноглобулинов различных классов (что важно для ранней диагностики заболеваний и их прогноза) – иммуноферментный анализ в настоящее время является одним из основных методов лабораторной диагностики.
Постановка иммуноферментного метода включает следующие основные этапы. Используются специальные планшеты из полистирола, с круглыми плоскодонными лунками, вместимостью около 300 мкл. Число лунок на планшете – 96 (8 рядов по 12 лунок).
Перед анализом планшет сенсибилизируют, нанося раствор АГ. Обычно это не целая структура возбудителя, а часть (наиболее характерная) белков его оболочки. Очень часто АГ для ИФА получают генно-инженерными технологиями, выращивая на трансгенных E.coli.
Растворимые АГ закрепляются на поверхности планшета рядом специфических взаимодействий непосредственно из раствора. Для снижения помех участки незанятой АГ поверхности «укрывают» нанесением раствора бычьего сывороточного альбумина. Несвязанный материал удаляют и планшет сушат. Сенсибилизированные планшеты можно хранить при минус 18 °С не более 2-х недель.
При выполнении анализа лунки заполняют исследуемым материалом (сыворотка крови), нанося его в разные лунки с дробным разбавлением (1/2, 1/4, 1/8, 1/16, 1/32 и т. д.), после чего выдерживают около 30 минут для связывания. Если в образцах имеются АТ, комплементарные нанесенному АГ, они образуют с ним прочные комплексы. Образцы из лунок удаляются, и несвязавшийся материал удаляется трехкратной промывкой буфером. Далее лунки заполняются раствором конъюгата, представляющего собой связанные глутаровым альдегидом молекулы белка-фермента (чаще всего – пероксидаза хрена или щелочная фосфатаза) и молекулы АТ против АТ к возбудителю, полученные из сыворотки кролика (или другого организма) при введении в его кровь АТ человека к искомому возбудителю. Дают время на прохождение реакции комплементарного связывания, после чего избыток раствора конъюгата удаляется и лунки промываются буфером. Молекулы конъюгата осаждаются на молекулах осадившихся на АГ АТ из испытуемого образца. В довершение всего лунки заполняют раствором субстрата, превращение которого в окрашенный продукт осуществляется конъюгированным ферментом. Такое ферментативное превращение осуществляется примерно в течение 60 минут, после чего реакция останавливается добавлением кислоты. Количество превращенного субстрата пропорционально концентрации конъюгата и, следовательно, концентрации АТ против возбудителя в исследуемом образце. По плотности окраски в УФ-свете можно судить о концентрации АТ в исследуемой сыворотке. В «холостых» контрольных лунках параллельно проводят реакцию для установления порога «шумов». Имеются также лунки, заполненные АТ из контрольного раствора для проверки специфичности реакции.
В качестве субстратов для конъюгатов с пероксидазой хрена применяется о-фенилендиамин в смеси с перекисью водорода, дающий после остановки реакции оранжево-коричневые растворы, измеряемые при λ = 492 нм. Субстратом для щелочной фосфатазы является п-нитрофенилфосфат, превращающийся в п-нитрофенол, индицируемый при λ = 405 нм.
ИФА повышает чувствительность анализа благодаря «усилению сигнала» на конъюгированном ферменте. На каждую молекулу исследуемого в сыворотке АТ «садится» по одной молекуле фермента, которая способна катализировать превращение десятков и сотен тысяч молекул субстрата. Однако и чувствительность ИФА имеет ограничения. В некоторых случаях (например, при приеме донорской крови) требуется проводить процедуру ПЦР для подтверждения отсутствия АТ к ВИЧ и некоторых других заболеваний. Дело в том, что в первые дни после заболевания число АТ в крови может оказаться настолько малым, что ИФА часто дает так называемую «серонегативную реакцию».
Современные методы иммунологии позволяют обнаруживать в биологических средах ничтожно малые количества некоторых органических и неорганических веществ (гормонов, ферментов, витаминов, биологически активных веществ, АТ к определенным тканям и органам, лекарств и т. п.), которые не выявляются классическими биохимическими и иммунологическими методами. Наиболее чувствительными являются радиоиммунный и иммуноферментный методы исследования.
РИА
РИА основан на исследовании характера взаимодействия АТ с АГ с образованием иммунного комплекса, в один из компонентов которого (АГ или АТ) введена радиоактивная метка. Наибольшее распространение получил метод конкуренции за специфические АТ меченного радиоактивным изотопом АГ и такого же АГ, но свободного от радиоактивной метки, количество которого необходимо определить в исследуемой биологической среде. С этой целью в исследуемую жидкость, в которой предполагается наличие АГ, добавляют известное количество такого же меченого АГ и стандартное количество антисыворотки с соответствующими АТ (рис. 64а). Если в исследуемой жидкости отсутствует искомый специфический АГ, то около 70–80 % меченого АГ связывается с АТ, обусловливая высокую радиоактивность образующегося преципитата (рис. 64б). Если же в биологической среде присутствует искомый АГ, он конкурирует с меченым АГ и связывает часть АТ. В результате радиоактивность преципитата падает по сравнению с контролем (рис. 64в). На этом принципе основано количественное определение АГ или АТ.

Рис. 64. Принцип РИА. Образование радиоактивных преципитатов при отсутствии в исследуемой жидкости искомого АГ (б) и при его наличии (в); а – добавление в исследуемую жидкость стандартной антисыворотки с АТ и АТ, меченного радиоактивным изотопом
РИА – один из самых чувствительных методов иммунодиагностики. Его применяют для выявления АГ вируса гепатита В у больных вирусным гепатитом. Для этого к исследуемой сыворотке добавляют референс-сыворотку (сыворотку, содержащую АТ к вирусу гепатита В). Смесь инкубируют 1–2 суток при температуре плюс 40 °С, затем добавляют референс-АГ (АГ, меченный изотопом 125 J) и продолжают инкубацию еще 24 часа. К образовавшемуся комплексу АГ-АТ добавляют преципитирующие антииммуноглобулины против белков референс-сыворотки, что приводит к образованию преципитата (рис. 65). Результат учитывают по наличию и числу импульсов в преципитате, зарегистрированных счетчиком. При наличии в исследуемой сыворотке АГ, связавшегося со специфическими АТ, последние не вступают в связь с меченым АГ, и поэтому он не обнаруживается в преципитате. Таким образом, в основу РИА положен принцип конкурентного взаимодействия определяемого АГ и известного количества меченого АГ с активными центрами АТ.

|
| Рис. 65. РИА: 1 – АГ, 2 – АТ, 3 – радиоактивная метка |
Следует добавить, что в последние годы для количественного радиоиммунного и иммуноферментного определения различных АГ и АТ в биологических средах все чаще используют так называемые моноклональные АТ (МКА).Последние получают не путем иммунизации животных, а искусственно, путем синтеза так называемым моноклоном, т. е. культурой клеток, происходящих из одного сенсибилизированного лимфоцита. МКА отличаются от обычных АТ, полученных с помощью классической иммунизации животных, очень высокой специфичностью и реагируют только на определенный АГ.
10.3. Генодиагностика: полимеразная цепная реакция (ПЦР)
в идентификации патогенных бактерий
Определение ПЦР
К числу наиболее чувствительных и высокоспецифичных иммунологических методов обнаружения АГ относится метод ПЦР, который позволяет обнаруживать в исследуемом материале присутствие нескольких молекул искомого АГ или единичных возбудителей.
ПЦР – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определенных фрагментов ДНК в биологическом материале (пробе).
Помимо простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК) и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, выделения новых генов.
История ПЦР
В начале 1970-х годов норвежскому ученому Кьеллу Клеппе (Kjell Kleppe) из лаборатории нобелевского лауреата Хара Гобинды Хораны (Har Gobind Khorana) пришла в голову мысль, что можно амплифицировать ДНК с помощью пары коротких одноцепочечных молекул ДНК – синтетических праймеров. Однако в то время эта идея осталась невостребованной. ПЦР была вновь открыта в 1983 году Кери Маллисом (Kary Mullis). Его целью было создание метода, который бы позволил амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента ДНК-полимеразы. Через 7 лет после опубликования этой идеи, в 1993-м году, Маллис получил за нее Нобелевскую премию.
В начале использования метода после каждого цикла «нагревания-охлаждения» приходилось добавлять в реакционную смесь ДНК-полимеразу, поскольку она быстро инактивировалась при высокой температуре, необходимой для разделения цепей спирали ДНК. Процедура была неэффективной, требовала много времени и фермента. В 1986-м году она была существенно улучшена. Было предложено использовать ДНК-полимеразы из термофильных бактерий. Эти ферменты оказались термостабильными и были способны выдерживать множество циклов реакции. Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-полимеразой. Недостаток этой полимеразы заключается в том, что вероятность внесения ошибочного нуклеотида у нее достаточно высока, т. к. у этого фермента отсутствуют механизмы исправления ошибок (3’→5’ экзонуклеазная активность). Полимеразы Pfu и Pwo, выделенные из архей, обладают таким механизмом, их использование значительно уменьшает число мутаций в ДНК, но скорость их работы (процессивность) ниже, чем у Taq. Сейчас применяют смеси Taq и Pfu, чтобы добиться одновременно высокой скорости полимеризации и высокой точности копирования. В момент изобретения метода Маллис работал в компании Цетус (Cetus), которая и запатентовала метод ПЦР. В 1992-м году Цетус продала права на метод и патент на использование Taq-полимеразы компании Хофман-Ла Рош (Hoffmann-La Roche) за 300 млн. долларов. Однако оказалось, что Taq-полимераза была характеризована русским биохимиком А. Калединым в 1980-м году, в связи с чем компания Промега (Promega) пыталась в судебном порядке заставить компанию Хофман-Ла Рош отказаться от исключительных прав на этот фермент. Американский патент на метод ПЦР истек в марте 2005-го года.
Проведение ПЦР
Метод ПЦР основан на многократном избирательном копировании определенного участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка ДНК, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований. С помощью смеси различных полимераз, с использованием добавок и при определенных условиях длина ПЦР-фрагмента может достигать 20–40 тысяч пар нуклеотидов (п. н.). Это все равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд. пар оснований.
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты: ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. Два праймера, комплементарные концам требуемого фрагмента. Термостабильная ДНК-полимераза – фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов – Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие.
Буферный раствор, обеспечивающий необходимые условия реакции – рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦР-реакции. Этот фермент катализирует гидролиз пирофосфата, побочного продукта присоединения нуклеотидтрифосфатов к растущей цепи ДНК, до ортофосфата. Пирофосфат может ингибировать ПЦР-реакцию.
Праймеры
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18–30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка. После гибридизации матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см. ниже). Важнейшая характеристика праймеров – температура плавления (Tm) комплекса праймер – матрица. Она определяется как температура, при которой праймер присоединился к половине возможных сайтов связывания. Tm можно приблизительно определить по формуле, где nX – количество нуклеотидов Х в праймере. Если праймер короткий и Tm мала, то праймер может оказаться частично комплементарен другим участкам матричной ДНК, что может привести к появлению неспецифических продуктов. Верхний предел температуры плавления ограничен оптимумом температуры действия полимеразы, активность которой падает при температурах выше плюс 80 °С.
При выборе праймеров желательно придерживаться следующих критериев: GC-состав ~ 40–60 %; близкие Tm праймеров (отличия не более чем на 5 °С); отсутствие неспецифических вторичных структур – шпилек и димеров; желательно, чтобы на 3’-конце был гуанин или цитозин, поскольку они образуют три водородные связи с молекулой матрицы, делая гибридизацию более стабильной.
Амплификатор
ПЦР проводят в амплификаторе – приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °С. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при плюс 4 °С. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшета, что позволяет встраивать их в автоматизированные системы.
Ход реакции
Обычно при проведении ПЦР выполняется 20–35 циклов, каждый из которых состоит из трех стадий.
Денатурация. Двухцепочечную ДНК-матрицу нагревают до плюс 94–96 °С (или до плюс 98 °С, если используется особенно термостабильная полимераза) на 0,5–2 минуты, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение приблизительно 2–5 минут для полной денатурации матрицы и праймеров. Такой прием называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции.
Отжиг. Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 4–5 °С ниже их температуры плавления. Время стадии – 0,5–2 минуты. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
Элонгация. ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это – стадия элонгации. Полимераза начинает синтез второй цепи от 3’-конца праймера, который связался с матрицей, и движется вдоль матрицы. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при плюс 72 °С. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7–10 минут.
Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.
Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2n, где n – число циклов реакции. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E) n, где P – количество продукта, Е – средняя эффективность цикла.
Число «длинных» копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент. Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато».
Разновидности ПЦР
«Вложенная» ПЦР (англ. n ested PCR) – применяется для уменьшения числа побочных продуктов реакции. Используют две пары праймеров и проводят две последовательные реакции. Вторая пара праймеров амплифицирует участок ДНК внутри продукта первой реакции.
«Инвертированная» ПЦР (англ. i nverse PCR) – используется в том случае, если известен лишь небольшой участок внутри нужной последовательности. Этот метод особенно полезен, когда нужно определить соседние последовательности после вставки ДНК в геном. Для осуществления инвертированной ПЦР проводят ряд разрезаний ДНК рестриктазами с последующим соединением фрагментов (лигирование). В результате известные фрагменты оказываются на обоих концах неизвестного участка, после чего можно проводить ПЦР как обычно.
ПЦР с обратной транскрипцией (англ. r everse t ranscription PCR, RT-PCR) – используется для амплификации, выделения или идентификации известной последовательности из библиотеки РНК. Перед обычной ПЦР проводят на матрице мРНК синтез одноцепочечной молекулы ДНК с помощью ревертазы и получают одноцепочечную кДНК, которая используется в качестве матрицы для ПЦР. Этим методом часто определяют, где и когда экспрессируются данные гены.
Асимметричная ПЦР (англ. a symmetric PCR) – проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК. Используется в некоторых методиках секвенирования и гибридизационного анализа. ПЦР проводится как обычно, за исключением того, что один из праймеров берется в большом избытке.
Количественная ПЦР (англ. q uantitative PCR, Q-PCR) – используется для быстрого измерения количества определенной ДНК, кДНК или РНК в пробе. Количественная ПЦР в реальном времени (англ. quantitative real-time PCR) – в этом методе используют флуоресцентно меченые реагенты для точного измерения количества продукта реакции по мере его накопления.
Touchdown (Stepdown) ПЦР (англ. t ouchdown PCR) – с помощью этого метода уменьшают влияние неспецифического связывания праймеров на образование продукта. Первые циклы проводят при температуре выше температуры отжига, затем каждые несколько циклов температуру снижают. При определенной температуре система пройдет через полосу оптимальной специфичности праймеров к ДНК.
Метод молекулярных колоний (ПЦР в геле) (англ. C olony – PCR Colony) – акриламидный гель полимеризуют со всеми компонентами ПЦР на поверхности и проводят ПЦР. В точках, содержащих анализируемую ДНК, происходит амплификация с образованием молекулярных колоний.
ПЦР с быстрой амплификацией концов кДНК (англ. rapid amplification of cDNA ends, RACE-PCR).
ПЦР длинных фрагментов (англ. l ong-range PCR) – модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч оснований и больше). Используют две полимеразы, одна из которых – Taq-полимераза с высокой процессивностью (т. е. способная за один проход синтезировать длинную цепь ДНК), а вторая – ДНК-полимераза с 3’-5’ эндонуклеазной активностью. Вторая полимераза необходима для того, чтобы корректировать ошибки, внесенные первой.
ПЦР со случайной амплификацией полиморфной ДНК (англ. random amplification of polymorphic DNA PCR, RAPD PCR) – используется тогда, когда нужно различить близкие по генетической последовательности организмы, например, разные сорта культурных растений, породы собак или близкородственные микроорганизмы. В этом методе обычно используют один праймер небольшого размера (20–25 п.н.). Этот праймер будет частично комплементарен случайным участкам ДНК исследуемых организмов. Подбирая условия (длину праймера, его состав, температуру и пр.), удается добиться удовлетворительного отличия картины ПЦР для двух организмов. Если нуклеотидная последовательность матрицы известна частично или неизвестна вовсе, можно использовать вырожденные праймеры, последовательность которых содержит вырожденные позиции, в которых могут располагаться любые основания. Например, последовательность праймера может быть такой: …ATH…, где Н – А, Т или С.
Применение ПЦР
ПЦР используется во многих областях для проведения анализов и в научных экспериментах.
Криминология. ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления – кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически – одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью гель-электрофореза. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (англ. genetic fingerprint).
Установление отцовства. Хотя «генетические отпечатки пальцев» уникальны (за исключением случая однояйцевых близнецов), родственные связи все же можно установить, сделав несколько таких отпечатков. Тот же метод можно применить, слегка модифицировав его, для установления эволюционного родства среди организмов.
Медицинская диагностика. ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных, бактериальных и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы до того, как проявятся симптомы заболевания.
Высокие показатели чувствительности и специфичности ПЦР делают ее революционной в лабораторной диагностике. Показания к применению ПЦР такие же, как и у культурального метода. Следует учитывать, что при исследовании биопроб методом ПЦР сразу после курса антибактериального лечения в некоторых случаях можно получить «ложноположительные с клинической точки зрения» результаты, поскольку невозможно однозначно оценить жизнеспособность микробной клетки на основании выявления фрагмента ее генома, используя только молекулярно-биологические методы, т. к. амплифицируется ДНК как живого, так и погибшего микроорганизма.
Метод ПЦР особенно эффективен при выявлении трудно культивируемых, некультивируемых, требующих сложной питательной среды и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях.
Диагностические возможности ПЦР не ограничены способностью микроорганизма расти на искусственных средах или в культуре клеток. Поэтому основное преимущество ПЦР перед культуральными методами состоит не в высокой чувствительности ПЦР-метода (поскольку их чувствительность сопоставима), а в способности идентифицировать, определять свойства и работать с большим разнообразием микроорганизмов, которые не удается по тем или иным причинам размножать в лабораторных условиях.
Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов.
Преимущества ПЦР как метода диагностики
Одним из важнейших критериев диагностической эффективности любого лабораторного анализа является показатель «чувствительности». При этом следует различать аналитическую и диагностическую чувствительность. Аналитическая чувствительность, применительно к ПЦР, представляет собой то минимальное количество копий (геномных эквивалентов – г/э) ДНК или РНК в одном миллилитре раствора образца, которое может быть определено данной тест-системой. Большинство коммерческих амплификационных тест-систем позволяет обнаружить в биологической пробе искомую НК, если ее концентрация составляет не менее нескольких сот г/э копий в 1 мл образца. Например, аналитическая чувствительность большинства тест-систем для ВИЧ-1 составляет 300–500 копий ДНК в 1 мл образца. Диагностическая чувствительность определяется количеством пациентов с данным заболеванием, дающих истинно положительные результаты при использовании конкретного набора, и оценивается в процентах. В этом аспекте имеется общее положение, определяющее клиническую пригодность любых лабораторных способов диагностики или тест-систем – диагностическая чувствительность метода не должна быть ниже 95–98 %.
Второй универсальный критерий лабораторной эффективности – «специфичность», определяется процентом здоровых людей, имеющих истинно отрицательные результаты анализа. Метод ПЦР обладает высочайшей специфичностью, которая достигает 99–100 %.
Диагностическая чувствительность и специфичность ПЦР сопоставимы, а зачастую и превосходят таковые, обеспечиваемые культуральным методом, которые являются «золотым стандартом» в диагностике инфекционных заболеваний. Если учесть продолжительность процедуры выращивания культуры клеток (от нескольких недель до нескольких месяцев), то преимущество метода ПЦР становится несомненным. Результаты ПЦР-анализа можно получить в течение одного рабочего дня, при этом отобранные для анализа пробы могут храниться (накапливаться) в течение даже нескольких недель при соблюдении соответствующих температурных норм.
Проведенная в нескольких зарубежных исследовательских центрах суммированная оценка чувствительности различных методов диагностики показала, что «быстрые» тесты (экспресс-тесты) имеют чувствительность 40–60 %, ИФА – 50–70 %, РИФ – 55–75 %, культуральное исследование – 60–80 %, а ПЦР – от 90 до 100 %. Поэтому ПЦР, по сравнению с другими способами, обладает двумя важными преимуществами: высокой чувствительностью и непродолжительностью по времени анализа, т. е. «актуальностью» получения результата исследования врачом и пациентом.
Таким образом, приведенные выше факты позволили отметить следующие преимущества ПЦР перед другими методами клинической лабораторной диагностики:
1. Универсальность. Метод принципиально позволяет обнаруживать любые ДНК и РНК даже в тех случаях, когда другими способами это сделать невозможно. Вне зависимости от объекта и области применения ПЦР (клиническая медицина, криминалистика, ветеринария, генетика, молекулярная биология) используется стандартный комплект приборов. Это обуславливает универсальность процедуры постановки ПЦР при исследовании любых биологических объектов.
2. Специфичность. Высокая специфичность (100 %) метода обусловлена тем, что в исследуемом материале определяется уникальный фрагмент НК (нуклеотидная последовательность), характерный только для данного возбудителя или гена. Таким образом, ПЦР-диагностикумы дают возможность избежать проблем, связанных с перекрестно-реагирующими АГ.
3. Чувствительность. Возможность проведения не только качественной (наличие), но и количественной (концентрация) оценки содержания НК. В настоящее время реальный порог чувствительности коммерческих амплификационных тест-систем позволяет определять единичные копии в исследуемом образце.
4. Актуальность ответа (быстрота получения результата). Высокая технологичность и автоматизация метода позволяет врачу и пациенту получить результаты исследования в день проведения анализа.
5. Возможность доклинической и ретроспективной диагностики. ПЦР позволяет осуществить определение патогена или дефектного гена в организме еще до развития заболевания. Например, при инфекциях в инкубационном периоде, т. е. серонегативной фазе, или при латентном характере заболевания. Кроме того, возможно проведение ПЦР в архивном (фиксированном) материале или биологических остатках, что важно для идентификации личности или установления отцовства.
6. Проведение анализа возможно в минимальном объеме пробы (до нескольких микролитров), что крайне важно в неонатологии, судебной медицине, клинической генетике и т. п.
7. Возможность одновременной диагностики нескольких возбудителей заболеваний или аномальных генов в одной пробе без ущерба для чувствительности или специфичности результата.
8. Возможность экспертизы. Полученные результаты ПЦР возможно вносить в компьютерные информационные носители или фотографии для оценки независимыми экспертами.
Несмотря на вышеуказанные достоинства метод ПЦР все же не лишен некоторых недостатков, которые следует учитывать при оценке результатов исследований.
Ошибки при использовании метода ПЦР
С точки зрения получения ложноотрицательного или ложноположительного результата особенно опасны ошибки, контроль которых невозможно осуществить во время проведения ПЦР-анализа. Это, прежде всего, ошибки, связанные с нарушением правил взятия, хранения и транспортировки проб. Поскольку эти процедуры могут осуществляться вне ПЦР-лаборатории, большое внимание следует уделять обучению медицинского персонала, выполняющего забор проб, т. к. именно от него во многом зависит качество ПЦР-анализов. Случаи тотальной контаминации выявляются без труда по появлению линии «положительной» ДНК во всех пробах, включая отрицательный контроль. Реагенты, загрязненные «положительной» ДНК, подлежат ликвидации. Повторная реакция ставится с новыми реагентами.
Вторую группу составляют ошибки, связанные с неверной диагностической стратегией врача, использующего ПЦР-диагностику. Недостатки ПЦР лежат не в сути метода, а в неправильном методическом подходе (алгоритме лабораторной диагностики) при обследовании пациента и неверной клинической интерпретации полученных результатов.
Следует обратить внимание на случаи несовпадения результатов ПЦР-анализа с результатами других исследований, например, с результатами определения АТ к возбудителю ИФА. Возможна и обратная ситуация, когда при положительном результате ПЦР-анализа не выявляются специфические АТ. При хронических инфекциях, которые зачастую сопровождаются иммунодепрессией, такая картина бывает не редко.
Заключение
Рассматривая современные методы идентификации микроорганизмов, можно сказать, что это трудоемкие процессы, требующие достаточного набора знаний, времени, оборудования и специальных условий. Но, не смотря на все трудности, диагностические методы необходимы для идентификации микроорганизмов при установлении диагноза инфекционных заболеваний, при определении физиологических свойств культуры микроорганизмов, например, при выборе химиотерапевтического препарата, или при других клинических ситуациях и исследовательских задачах. В мире постоянно появляются новые неизвестные микроорганизмы и, возможно, от скорости их идентификации будет зависеть жизнь многих людей. Поэтому развитие методов качественной, быстрой и надежной идентификации микроорганизмов является актуальной задачей биологии, решение которой позволит контролировать процессы равновесия между макро- и микроорганизмами, способствуя, в конечном счете, снижению уровня смертности среди населения планеты.
Контрольные вопросы. 1. В каких направлениях применяют серологические реакции? 2. Дайте характеристику реакции агглютинации. 3. Какие варианты реакции агглютинации существуют?4. Как протекает реакция агглютинации при бактериальных инфекциях? 5. В каких вариантах применяют РНГА? 6. В чем особенность РТГА? 7. Для определения каких АТ чаще всего используют реакцию пассивной гемагглютинации? 8. Охарактеризуйте реакцию преципитации. 9. В чем суть метода радиальной иммунодиффузии? 10. Опишите постановку РСК. 11. Каков принцип РИФ? 12. В чем состоит преимущество РИФ? 13. Какие разновидности РИФ существуют и в чем их принципиальные отличия? 14. Опишите принцип ИФА. 15. Какие разновидности ИФА существуют? 16. Какие виды ИФА тест-систем существуют? 17. Дайте определение ПЦР. 18. Перечислите основные даты в развитии метода ПЦР. 19. На чем основан принцип ПЦР? 20. Перечислите компоненты, необходимые для постановки ПЦР. 21. Каковы основные этапы постановки ПЦР? 22. Какие существуют разновидности ПЦР? 23. Каковы области применения ПЦР? 24. Каковы преимущества ПЦР как метода диагностики? 25. Бывают ли ошибки при использовании метода ПЦР?
Дата добавления: 2019-09-13; просмотров: 1445; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
