Понятие об иммунологии и иммунитете
Иммунология – наука о механизмах защиты организма от генетически чужеродных веществ и клеток для сохранения гомеостаза организма (постоянства внутренней среды). Иммунология изучает органы и клетки иммунной системы, антигены, типы иммунных реакций, механизмы иммунного реагирования, регуляцию иммунного ответа с целью практического использования достижений иммунологии в медицине и ветеринарии.
Современное представление об иммунитете исходит из концепции о биологической индивидуальности и изучении индивидуальных структурных различий между населяющими Землю микро- и макроорганизмами на молекулярном уровне. Соматические и молекулярные различия организмов обусловлены уникальным строением нуклеиновой кислоты, что выражается неповторимой структурой молекул поверхностных мембран клеток и их метаболитов (например, экзотоксинов). Эти молекулы являются как бы отметинами особого устройства ДНК или РНК у данной клетки и сохраняются до тех пор, пока нуклеиновая кислота остается неизменной. Поскольку в определенном одно- или многоклеточном организме имеется всего одна нуклеиновая кислота или она всегда однотипна, каждый микро- или макроорганизм должен быть наделен генетически однородным набором подобных структур. Поэтому любое внедрение микробов или их метаболитов в макроорганизм, появление в нем собственных мутированных клеток по существу представляет собой покушение на биологическую индивидуальность последнего и сопровождается специфической защитной реакцией организма.
|
|
|
Иммунная система – совокупность всех лимфоидных органов и скоплений лимфатических клеток тела. Синонимом иммунной системы является лимфатическая система.
Факторы и механизмы неспецифической противоинфекционной защиты
Неспецифический (видовой) иммунитет – невосприимчивость организма к инфекциям, которая обусловлена врожденными биологическими особенностями, присущими данному виду животных или человеку. Неспецифический иммунитет – система иммунной защиты, не связанная с антигенами и антителами, которая включает в себя фагоцитоз и общую неспецифическую резистентность. Примером видового иммунитета может служить невосприимчивость человека к чуме крупного рогатого скота.
Внутренняя среда организма человека ограничена от окружающего мира кожей и слизистыми оболочками. Именно они являются первым препятствием на пути проникновения инфекции. Это механический барьер. В эпителиальной ткани (входит в состав кожи и слизистых) клетки прочно связаны между собой межклеточными контактами. Это препятствие преодолеть непросто. Мерцательный эпителий дыхательных путей удаляет бактерий и частички сажи, благодаря колебанию ресничек. В коже есть сальные и потовые железы. В поте содержится молочная и жирные кислоты. Они понижают рН кожи, закисляют ее. Микробам это не нравится. Тормозят размножение микробов перекись водорода, аммиак, мочевина, желчные пигменты, содержащиеся в поте.
|
|
|
Слезные, слюнные, кишечные, желудочные и прочие железы, чьи секреты выделяются на поверхность слизистых, тоже мешают микроорганизмам. Во-первых, они их просто смывают. Кроме того, некоторые секреты имеют такой рН, который бактерии не любят (тот же желудочный сок). В некоторых секретах (слюна и слезная жидкость) содержится фермент – лизоцим, который непосредственно разрушает бактерии. В секрете носовых желез содержится вирус-инактивирующий агент, механизм действия которого еще не изучен (помогает организму бороться с вирусом гриппа).
Совокупность микроорганизмов, которые заселяют кожу и слизистые оболочки здорового человека, составляют нормальную микрофлору. Эти микробы способны противостоять защитным механизмам самого организма, но не способны проникать в ткани (за исключением тех случаев, когда устойчивость (резистентность) к ним организма снижена). Нормальная микрофлора подавляет развитие патогенной.
|
|
|
Основная функция воспаления – отгородить микробов и их токсины, попавших в ткани организма, а потом и уничтожить их. Значительную роль в возникновении воспаления играют биологически активные вещества (серотонин, гистамин и т. д.). Они повышают проницаемость капилляров, что приводит к развитию отека. В отечной жидкости содержатся макрофаги, нейтрофилы, комплемент, антитела, нейтрализующие микробы и их токсины.
В очаге воспаления скапливаются фагоциты. Они образуют «отграничительный вал», препятствующий дальнейшему распространению микроорганизмов. Там же накапливается фибриноген, который, превращаясь в фибрин, приводит к тромбированию мелких кровеносных и лимфатических сосудов. Создается препятствие для распространения микроорганизмов по этим путям. В очаге воспаления нарушается кровообращение, и скапливаются «кислые» продукты обмена (снижается рН), что неблагоприятно сказывается на размножении и росте бактерий.
Лимфоидные органы – функциональные тканевые образования, в которых образуются иммунные клетки и где они приобретают иммунную специфичность. Лимфатические узлы являются своеобразным фильтром для микроорганизмов, переносящихся лимфой. Микроорганизмы проходят через кожу или слизистые оболочки, проникают в лимфатические сосуды. По ним они попадают в лимфатические узлы. Здесь микроорганизмы задерживаются и уничтожаются. А благодаря выделительной системе организм освобождается от микробов, продуктов их жизнедеятельности и токсинов.
|
|
|
Неспецифический иммунитет обеспечивают макрофаги, нейтрофилы (микрофагоциты), Т-цитотоксические лимфоциты или Т-киллеры, натуральные киллеры или NK-клетки. Роль Т-киллеров заключается в уничтожении опухолевых клеток и клеток, инфицированных вирусами. Натуральные киллеры уничтожают только опухолевые клетки. Работа неспецифического иммунитета обеспечивается комплементом и интерферонами. Комплемент может уничтожать бактерий, «подготавливая» их к «поглощению» макрофагами. Интерфероны обладают противовирусной активностью и антибактериальными свойствами (высокую чувствительность к интерферону проявляют грамположительные бактерии, меньшую – грамотрицательные).
Фагоцитоз – активный захват, поглощение и переваривание живых клеток и неживых частиц особыми клетками организма – фагоцитами. Это самые большие клетки организма человека, они выполняют важную функцию неспецифической защиты. Открыл фагоцитоз в 1882-м году выдающийся русский биолог, лауреат Нобелевской премии, Илья Ильич Мечников. Фагоциты обладают удивительной способностью – положительным хемотаксисом. Как только в организме (в любом его месте) появились «непрошеные гости» в виде микробной клетки или каких-либо плотных частиц, возникает реакция тревоги (как в средние века набатный колокол) и тотчас все фагоциты, расположенные в разных частях организма, устремляются к этой точке. Начинается борьба, направленная на сохранение постоянства внутренней среды, своеобразной стерильности организма. Причем фагоциты не различают, какова природа проникшей в организм микрочастицы, чужая это клетка или клетка собственного организма с измененными свойствами. Фагоциты защищают организм от любых проникновений в его внутреннюю среду. Реакция фагоцитоза протекает в три стадии: движение к цели, обволакивание инородного тела (живого или неживого – неважно), поглощение и переваривание.
Основными клетками-фагоцитами являются нейтрофилы и моноциты/макрофаги. Фагоцитировать могут также эозинофилы (наиболее эффективны при антительминтном иммунитете). Процесс фагоцитоза усиливают опсонины, обволакивающие объект фагоцитоза. Моноциты составляют 5–10 %, а нейтрофилы 60–70 % лейкоцитов крови. Поступая в ткань моноциты формируют популяцию тканевых макрофагов: купферовские клетки (или звездчатые ретикулоэндотелиоциты печени), микроглия ЦНС, остеокласты костной ткани, альвеолярные и интерстициальные макрофаги.
Способность фагоцитов к перевариванию чрезвычайно высока, что отличает их от всех других клеток. Каждая клетка в организме человека имеет свою функцию – проведение возбуждения, сокращение, соединение и т. д. Функция фагоцита – внутриклеточное переваривание. Если количество поглощаемых частиц (любого свойства) относительно небольшое, фагоцит превосходно справляется со своими обязанностями. Но в том случае, когда их поглощается очень много, фагоцит погибает, но ценой своей гибели он спасает организм человека.
Виды иммунитета
Естественный иммунитет – иммунитет, который достался млекопитающимсразу при его рождении. Приобретенный вид иммунитета (приобретаемый в течение жизни) может быть активным и пассивным (рис. 39). Активный иммунитет возникает либо в результате перенесенной болезни, которой организм болел (постинфекционный), либо после вакцинации, проведенной в специальных учреждениях (поствакцинальный). В обоих случаях иммунитет формируется в течение определенного периода (8–14 дней), как результат взаимодействия антигена и организма, который реагирует образованием антител и сенсибилизацией клеток. Поствакцинальный иммунитет может сохраняться в течение 3–4-х месяцев, в некоторых случаях даже год: постинфекционный сохраняется дольше (1–3 года) или даже пожизненно (люди и овцы, переболевшие оспой, остаются иммунными в течение всей жизни). Пассивный иммунитет возникает немедленно, но сохраняется в течение короткого времени, как правило, 2–3 недели. Данный иммунитет может быть трансплацентарным у тех видов, у которых антитела могут проникать через плаценту, и молозивным, когда антитела поступают в организм новорожденного с первой порцией молозива. У птиц существует желточный иммунитет благодаря присутствию антител в желтке яйца, которые обеспечивают известную невосприимчивость эмбриону и птенцу к определенным патогенам.
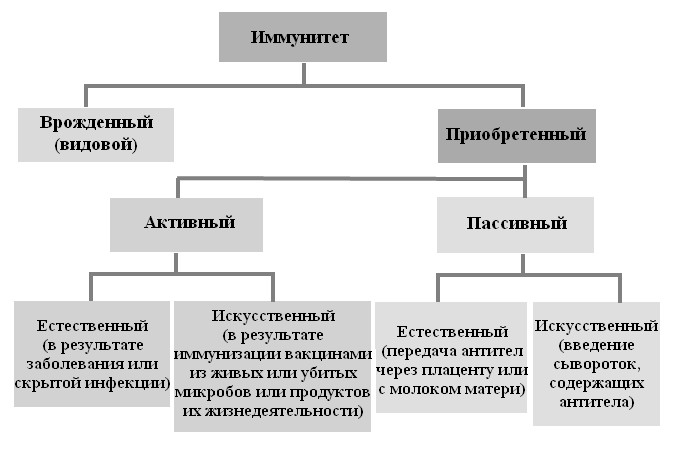
Рис. 39. Виды иммунитета
Противобактериальный иммунитет направлен как против бактерий, так и против их токсинов (антитоксический иммунитет). Бактерии и их токсины нейтрализуются антибактериальными и антитоксическими антителами. Комплексы бактерия (антигены)-антитела активируют комплемент, компоненты которого присоединяются к Fc-фрагменту антитела, а затем образуют мембраноатакующий комплекс, разрушающий наружную мембрану клеточной стенки грамотрицательных бактерий. Пептидогликан клеточных стенок бактерий разрушается лизоцимом. Антитела и комплемент (С3b) обволакивают бактерии и «приклеивают» их к Fc- и С3b-рецепторам фагоцитов, выполняя роль опсонинов вместе с другими белками, усиливающими фагоцитоз (С-реактивным белком, фибриногеном, маннозо-связывающим лектином, сывороточным амилоидом).
Противобактериальный иммунитет основан на сочетанном воздействии на бактерии и ихтоксины факторов неспецифической резистентности (лизоцима, комплемента, фагоцитов и др.) и факторов специфического иммунного ответа. Многие белки крови вместе с антителами откладываются на поверхности бактерий, блокируя их антигены и способствуя иммунному прилипанию к фагоцитам – начальной стадии фагоцитоза, а в последующем и перевариванию бактерий в фагоцитах. Такие белки, активирующие фагоцитоз микроорганизмов, называют опсонинами. Противобактериальные антитела, в частности, антитела к адгезинам бактерий, препятствуют прикреплению бактерий к тканям организма и, следовательно, развитию начальной стадии инфекционного процесса.
Лизоцим, обладая ферментативной активностью, разрушает пептидогликан клеточной стенки бактерий и приводит к их лизису. К лизоциму наиболее чувствительны грамположительные бактерии, клеточные стенки которых в основном состоят из пептидогликана. Литическое действие, главным образом на грамотрицательные бактерии, оказывает и комплемент в результате его активации альтернативным (начиная с СЗ-компонента комплемента), например, липополисахаридом клеточной стенки бактерий, или классическим (начиная с С1-компонента комплемента комплексом антиген-антитело) путем. Лизис бактерий осуществляется терминальными компонентами комплемента – С8 и С9. При активации комплемента образуются С3в-компоненты, которые вместе с Fc-фрагментами антител (IgM, IgG) взаимодействуют с соответствующими рецепторами фагоцитов. В результате обволакивания плазмолеммой фагоцита бактерий, опсонизированных белками крови, бактериальные клетки погружаются в цитоплазму, где бактерии располагаются в фагосомах, окруженных мембраной. Затем сливаются мембраны фагосомы и лизосомы, ферменты которой участвуют в разрушении бактерий. Переваривание бактерий происходит под влиянием гидролитических ферментов (гидролаз), действующих в кислой среде. Перевариванию подвергаются предварительно убитые бактерии. Фагоцитоз может быть завершенным (при разрушении бактерий) и незавершенным, в последнем случае бактерии размножаются в фагоците и происходит его гибель.
Противобактериальный иммунитет можно оценить по наличию противобактериальных антител, относящихся к иммуноглобулинам классов G и М, а также по уровню активности комплемента, лизоцима и других белков крови, совокупность которых определяет бактерицидное действие сыворотки крови.
Мероприятия по повышению защитных противобактериальных реакций организма заключаются в иммунизации вакцинами. При необходимости быстрой защиты вводят антитоксические или антибактериальные сыворотки, создавая пассивный иммунитет. Применяют также общеукрепляющую терапию с назначением иммуномодуляторов.
Основным механизмом антибактериального иммунитета является фагоцитоз. Фагоциты направленно перемещаются к объекту фагоцитоза, реагируя на хемоаттрактанты: вещества микробов, активированные компоненты комплемента (С5а, С3а) и цитокины. Противобактериальная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с бактериями, препятствуют их адгезии на эпителиоцитах.
Местный иммунитет – это комплекс приспособлений, который защищает поверхности, соприкасающиеся с внешней средой, от чужеродных биологических агентов. Тем самым местный иммунитет участвует в поддержании постоянства внутренней среды организма, его целостности и является неразрывной и соподчиненной частью общего иммунитета.
При некоторых инфекционных заболеваниях, когда состояние невосприимчивости связано с присутствием в организме возбудителя (туберкулез, бруцеллез и т. д.), устойчивость к новому заражению продолжается до тех пор, пока в организме животного сохраняется возбудитель данной инфекции. Такой иммунитет называется инфекционным, нестерильным или премуницией. Данное положение используется в практике при вакцинации организма маловирулентными живыми возбудителями против туберкулеза (вакцина БЦЖ), бруцеллеза (штамм 19) и др. Состояние нестерильного иммунитета длиться иногда годами.
Иммунитет, образующийся после переболевания или вакцинации и сохраняющийся при отсутствии в организме возбудителя болезни называют стерильным.
Общая характеристика антигенов
Антигены – генетически чужеродные (для конкретного организма) вещества, способные вызвать иммунный ответ. В роли антигенов выступают высокомолекулярные соединения: белки, полисахариды, нуклеиновые кислоты, липиды и др. с молекулярной массой более 10 000. Носителями таких чужеродных веществ являются бактерии, вирусы, грибки, трансплантаты, опухолевые клетки и пр.
Антигены способны вызывать в организме специфическую иммунную реакцию, а именно: сенсибилизацию, образование антител или иммунологическую толерантность, и взаимодействовать с продуктами этих реакций как in vivo, так и in vitro. Результат иммунной реакции, вызванный введением или внедрением в организм антигена, зависит от введенной дозы антигена.
Каждая молекула антигена имеет набор антигенных детерминант, называемых эпитопами. Эпитопы одного антигена, как правило, отличаются от эпитопов другого. Некоторые антигены имеют повторяющиеся эпитопы. Стереохимическая конфигурация эпитопов распознается антителами и Т-клеточными рецепторами, т. е. факторами адаптивного иммунитета. Каждая молекула антитела распознает не всю молекулу антигена, а один ее эпитоп.
Некоторые вещества, обычно соединения с низкой молекулярной массой или простые химические группировки, называемые гаптенами, не в состоянии обеспечить развитие иммунного ответа, т. е. стимулировать выработку антител, демонстрируя тем самым отсутствие проявления свойства иммуногенности или неспособность запустить синтез антител. Однако они обладают вполне конкретной специфичностью, поскольку реагируют с соответствующими (гомологичными) антителами, связываясь с ними, тогда как высокомолекулярные соединения (белки, полисахариды и др.) обладают как антигенной специфичностью, так и иммуногенностью (рис. 40). Гаптен приобретает иммуногенность (конкретную специфичность) только после соединения с высокомолекулярным белком-носителем.
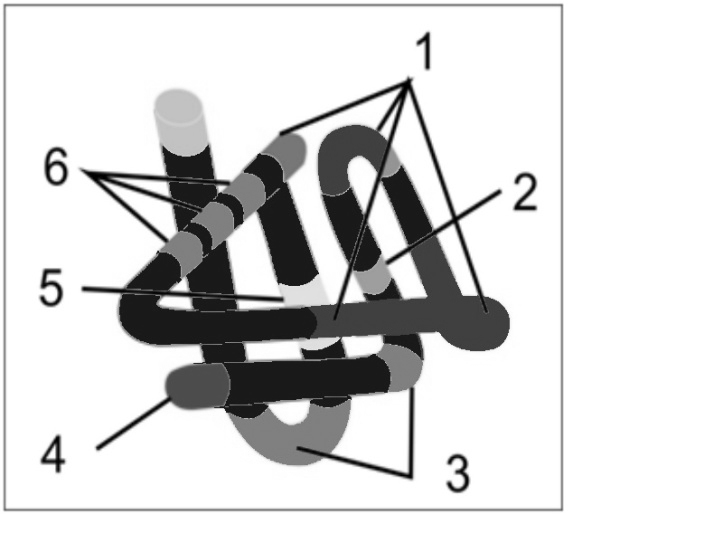
Рис. 40. Схематическое строение антигена: 1 – отличающиеся по специфичности эпитопы, 2 – агретоп, 3 – «несущая часть», 4 – митогенный участок, 5 – скрытый эпитоп, 6 – повторяющиеся однотипные эпитопы
Свойства антигенов
Антигенность – способность антигена связываться с антителом, иммуногенность – способность антигена вызывать иммунный ответ и создавать иммунитет (рис. 41).
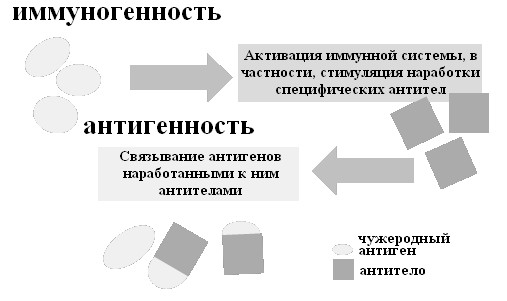
Рис. 41. Понятия «иммуногенности» и «антигенности»
Антигенами могут быть разнообразные вещества белковой природы, а также белки в соединении с липидами (липопротеины, или липопротеиды), полисахаридами (полисахарид-белковые комплексы и гликопротеины, или гликопротеиды) и нуклеиновыми кислотами (нуклеопротеины, или нуклеопротеиды) природного и синтетического происхождения.
Иммуногенность антигена – это также и способность создавать иммунитет. Это понятие относится главным образом к микробным антигенам, обеспечивающим создание иммунитета к инфекционным болезням. Антиген, чтобы быть иммуногенным, должен быть чужеродным в отношении данного реципиента, иметь молекулярную мас су не менее 10 000 и специфический химический состав. С увеличением молекулярной массы иммуногенность нарастает (рис. 42).
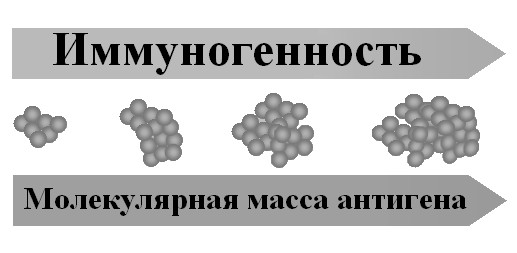
Рис. 42. Взаимосвязь молекулярной массы антигена и его иммуногенности
Корпускулярные антигены (бактерии, грибы, простейшие, эритроциты, искусственные микобактериальные частицы и др.) более иммуногенны, чем растворимые. Среди растворимых антигенов большей иммуногенностью обладают высокомолекулярные, например, агрегированные антигены. Условием иммуногенности также является доступность антигена для ферментативных систем антигенпрезентирующих клеток.
Специфичность – особенность строения веществ, по которой антигены отличаются друг от друга. Специфичность определяет антигенная детерминанта, т. е. небольшой участок молекулы антигена, который и соединяется с выработанным на него антителом. Разные антигены отличаются друг от друга числом таких участков (группировок), которое определяет в свою очередь число молекул антител, с которыми может соединяться антиген (валентность). От числа детерминант зависит валентность антигена: чем больше молекула, тем выше валентность. Специфичность высокомолекулярного антигена представлена отдельными участками (эпитопами) – местами связывания антител или антиген-распознающих рецепторов; при этом чем больше молекулярная масса антигена, тем больше мест связывания.
Эпитоп – часть антигена, взаимодействующего с паратопом – участком, находящимся в структуре антитела (антигенсвязывающий центр антитела) (рис. 43). Эпитопы часто включают аминокислотные остатки, которые находятся далеко друг от друга в первичной структуре белка, но собраны в один эпитоп в результате упаковки полипептидной цепи в нативном белке.
Антигены подразделяют на полноценные и неполноценные. Полноценные антигены вызывают в организме синтез антител или сенсибилизацию лимфоцитов и вступают с ними в реакцию как in vivo, так и in vitro. Для полноценных антигенов характерна строгая специфичность, т. е. они вызывают в организме выработку только специфических антител, вступающих в реакцию лишь с данным антигеном.
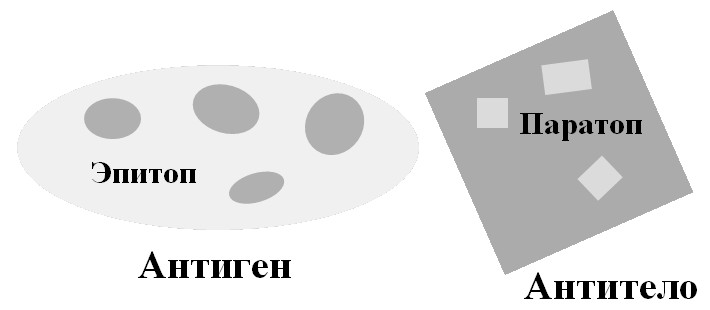
Рис. 43. Эпитопы и паратопы
Неполноценные антигены, или гаптены, не способны вызывать образование антител в организме, но вступают с ними в специфическую реакцию. Добавление к гаптенам небольших количеств белка придает им свойства полноценных антигенов. Белок, который укрупняет молекулу гаптена, получил название «шлеппер» (нем. schlepper – проводник).
Конъюгированные антигены – обобщенное название белков, которые приобрели новую антигенную специфичность благодаря присоединению к ним с помощью химической связи новой химической группировки.
Антигены животного происхождения
Антигены животного происхождения по специфичности подразделяют на видовые, групповые, органные и стадиоспецифические.
Видовая специфичность антигенов лежит в основе иммунных реакций и позволяет дифференцировать представителей различных видов животных. Видоспецифические свойства антигенов используются в судебной экспертизе, при идентификации хозяев крови, ветеринарно-санитарной экспертизе при определении фальсификаций мяса и мясопродуктов путем применения антивидовых сывороток. Максимально видоспецифичными свойствами обладают сывороточные белки. Поэтому лечебные сыворотки и тканевые вакцины стремятся получать на идентичных животных, а при введении животным чужеродных лечебно-профилактических препаратов учитывают возможные последствия антигенного несоответствия вводимых белков.
Групповая специфичность характеризует антигенные различия животных по полисахаридам эритроцитов, белкам сыворотки крови, поверхностным антигенам ядерных соматических клеток. Антигены, обусловливающие внутривидовые различия индивидуумов или групп особей между собой, называют изоантигенами (например, групповые эритроцитарные антигены, трансплантационные антигены). Наличие группоспецифичных антигенов учитывается при переливании крови, пересадках органов и тканей, а также используется в селекционной работе в качестве естественных генетических маркеров.
Органоспецифичность связана с неодинаковой антигенностью обычно изолированных от иммунной системы органов, таких как мозг, хрусталик глаза, спермин. При нарушении гистогематобарьеров антигены этих органов могут иммунизировать собственный организм, поэтому их называют аутоантигенами. В результате аутоиммунизации наступает повреждение органов и нарушение их функций. Часто регистрируют случаи бесплодия скота из-за выработки самками спермоантител к семени определенных производителей. Чем чаще самка осеменяется таким производителем, тем выше в ее организме титр антител к его спермиям и тем меньше шансов на оплодотворение. Чтобы избежать подобных ситуаций, предназначенных для осеменения самок проверяют на наличие антител к конкретной сперме.
При раковых, лучевых, ожоговых, холодовых, медикаментозных поражениях, микробных инфекциях и интоксикациях могут развиваться аутоиммунные процессы, обусловленные появлением в организме антигенов с патологической специфичностью.
В организме всегда присутствуют многочисленные аутоантитела, взаимодействующие с собственными молекулами организма. Такие антитела продуцируются в основном В1-клетками. Эти антитела обладают низким сродством к антигенам, часто полиспецифическим; они не способны активировать некоторые эффекторные механизмы врожденного иммунитета (например, разрушение носителя антигена фагоцитом). В связи с этим такие аутоантитела не повреждают ткани, а напротив, выполняют ряд важных функций (транспорт макромолекул, элиминацию отработавших молекул и другие гомеостатические функции). Функционально важную группу аутоантител образуют антитела к идиотопам иммуноглобулинов (антиантитела). Они копируют конфигурации антигенных эпитопов, служа их «внутренними образами», и играют определенную роль в регуляции иммунного ответа.
Стадиоспецифичные антигены возникают в процессе эмбриогенеза и четко характеризуют определенный этап внутриутробного развития животного, отдельных его паренхиматозных органов. Эти антигены поступают в кровоток матери и вызывают образование на себя антител. По этим антителам можно определить глубину стельности, протекание дифференцировки эмбриональных тканей, а также тератогенные свойства вводимых беременным животным веществ.
В некоторых случаях присутствие в крови взрослых животных стадиоспецифичных антигенов используется в качестве показателя функционального состояния отдельных внутренних органов. Например, при раке печени в сыворотке крови появляются альфа-фетопротеины, обычно синтезируемые фетальной печенью.
Главный комплекс гистосовместимости
Представление о главном комплексе гистосовместимости, сокращенно МНС (от англ. m ajor h istocompatibility c omplex), сформировалось после установления генетических законов совместимости тканей и обоснования наличия группы тесно сцепленных генов. Известно, например, что аллогенные трансплантаты тканей, взятые от животных одной линии и пересаженные животным другой линии, отторгаются. Оказалось, что решающую роль в определении судьбы аллотрансплантата играет один основной локус МНС. Слова главный и гистосовместимость отражают важную роль генетического фактора в отторжении аллотрансплантата. Слово комплекс отражает тот факт, что МНС состоит из множества тесно сцепленных генов, выполняющих различные функции. Было выяснено, что в пределах МНС локализованы не только гены, контролирующие главные трансплантационные антигены, но и гены, регулирующие способность давать иммунный ответ против различных чужеродных антигенов, а также гены, кодирующие полиморфные антигены (Yr-антигены) на поверхности иммунокомпетентных и некоторых других клеток. В настоящее время продукты этих генов МНС подразделяют на антигены классов I и II. Молекулы антигенов класса I представляют собой мембранные гликопротеины, находящиеся на поверхности всех клеток организма. Они определяют специфичность узнавания мишени, распознаются наряду с вирусными, опухолевыми и другими мембранными антигенами цитотоксическими Т-лимфоцитами.
Молекулы антигенов класса II находятся преимущественно на поверхности мембран клеток иммунной системы, главным образом на В-клетках и макрофагах. Продукты генов этого класса у мышей называют Ia-антигенами. Они представляют собой неоднородную группу гликопротеинов. С Ia-антигенами связаны многочисленные функции, проявляющиеся как в аллогенных реакциях иммунного ответа, так и в физиологическом взаимодействии клеток при иммунном ответе. В большинстве случаев антигены должны быть представлены (презентированы) Т-клетками, антигенпредставляющими клетками (макрофагами). При захвате и переработке антигена макрофагом образующиеся фрагменты молекулы антигена объединяются на поверхности макрофага с соответствующими ia-антигенами. Возникшую структуру распознают Т-лимфоциты, их рецепторы связывают не только антигены, но и аутологичный ia-антиген.
Локусы МНС у некоторых видов млекопитающих имеют следующие обозначения: у мышей – Н2-система, локализована в 17-й хромосоме; у собаки – DLA, у кроликов – RLA, у свиньи – SLA, у курицы – В; у человека – HLA-система, локализованная в 6-й хромосоме. У мышей, например, описано свыше двадцати ir-генов, которые контролируют ответ только на тимусзависимые антигены.
Антигены бактериальной клетки
Антигены бактерий по локализации подразделяют на капсульные, соматические, жгутиковые и антигены экзопродуктов (рис. 44).
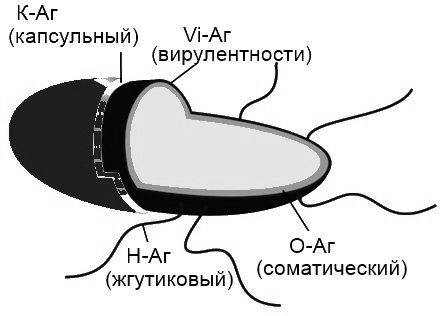
Рис. 44. Схема расположения антигенов у бактерии: К – капсульный, Vi – вирулентности, Н – жгутиковый, О – соматический
Капсульные, или К-антигены, являются самыми внешними постоянными структурами поверхности микробной клетки. По химическому строению их идентифицируют в основном как полисахариды, хотя прежнее подразделение К-антигенов эшерихий на L- и В-термолабильные антигены допускало и белковую природу этих структур. Их основу у пневмококков составляют повторяющиеся сахара: D-глюкоза, D-галактоза и L-рамноза.
В антигенном отношении капсульные полисахариды неоднородны. У пневмонийных стрептококков, например, различают более 80 серологических вариантов (сероваров), что широко используется в диагностической и лечебно-профилактической работе. К более однородным К-антигенам полисахаридной природы относят Vi-антигены энтеробактерий, бруцелл, франциселл; полисахарид-белковой природы V-W-антигены иерсиний; белковой природы М-протеин стрептококков группы А, протеин А стафилококков, антигены К-88 и К-99 эшерихий.
Из других внешних структур, обладающих антигенными свойствами, можно назвать корд-фактор микобактерий, полипептидные капсулы сибиреязвенного микроба, но их из-за непостоянства не относят к капсульным антигенам.
Соматические, или О-антигены, представляют собой боковые олигосахаридные цепи липополисахаридов (эндотоксина), выступающие над поверхностью клеточной стенки грамотрицательных бактерий. Концевые углеводные остатки в боковых олигосахаридных цепях могут различаться как порядком расположения углеводов в олигосахаридной цепи, так и стерически. Фактически они и являются антигенными детерминантами. У сальмонелл насчитывают около 40 таких детерминант, до четырех на поверхности одной клетки. По их общности сальмонелл объединяют в О-группы. Однако специфичность О-антигена сальмонелл связана с дидезоксигексозами, в числе которых выявлены паратоза, колитоза, абеквоза, тивелоза, аскарилоза и др. Уникальные концевые углеводные остатки, которые входят в структуру олигосахарида, являются наиболее удаленными от поверхности клетки и непосредственно связываются с активными центрами антител.
Наружная полисахаридная часть О-антигена (точнее, эндотоксина) ответственна за антигенные связи энтеробактерий, т. е. за неспецифические серологические реакции, с помощью которых может быть выявлен не только вид, но и штамм энтеробактерии.
О-антигены были названы соматическими, когда их точная локализация еще не была известна. Фактически же и К-, и О-антигены являются поверхностными, с разницей в том, что К-антиген экранирует О-антиген. Отсюда следует, что, прежде чем выявить О-антиген, необходимо взвесь исследуемых бактерий подвергнуть температурной обработке.
Жгутиковые, или Н-антигены, имеют все подвижные бактерии. Эти антигены представляют собой термолабильные белковые комплексы жгутиков, которыми обладают многие энтеробактерии. Таким образом, энтеробактерии обладают двумя наборами антигенных детерминант – штаммоспецифической (О-антиген) и группоспецифической (Н-антиген и К-антиген).
Полная антигенная формула грамотрицательных бактерий записывается в последовательности О : Н : К. Антигены при этом являются наиболее стабильными маркерами определенных возбудителей, благодаря чему удается сделать серьезный эпизоотологический или эпидемиологический анализ.
Антигенными свойствами обладают также бактериальные споры. Они содержат антиген, общий – для вегетативной клетки, и собственно споровый антиген.
Таким образом, постоянные, временные структуры и формы бактерий, а также их метаболиты обладают самостоятельными антигенными свойствами, характерными, однако, для определенных видов микроорганизмов. Поскольку все они являются маркерами особого строения ДНК у данного вида бактерий, часто на поверхности микробной клетки и в ее метаболитах содержатся общие антигенные детерминанты.
Последний факт имеет важное значение для совершенствования способов идентификации микроорганизмов. Так, например, вместо трудоемкой, дорогостоящей и не всегда воспроизводимой реакции нейтрализации для определения сероваров ботулинического микроба можно применять экспресс-метод, основанный на выявлении поверхностных детерминант при помощи иммунофлуоресценции.
В отличие от антигенов другого происхождения среди бактериальных антигенов выделяют так называемые протективные, или защитные, антигены. Выработанные на эти антигены антитела защищают организм от данного патогенного микроорганизма. Протективными свойствами обладают капсульные антигены пневмококков, М-протеин стрептококков, А-протеин стафилококков, белок второй фракции экзотоксина сибиреязвенных бацилл, белковые молекулы нижних слоев стенки некоторых грамотрицательных бактерий и др. Очищенные протективные антигены не обладают пирогенными, аллергенными свойствами, хорошо сохраняются и поэтому приближаются к идеальным вакцинным препаратам.
Протективные антигены обусловливают иммуногенность микробных антигенов. Антигены не всех микроорганизмов способны создавать одинаково выраженный иммунитет. Для повышения иммуногенности в ряде случаев антиген смешивают с адъювантами – неспецифическими стимуляторами иммуногенеза минеральной или органической природы. Чаще с этой целью используют гидроокись алюминия, алюминиево-калиевые квасцы, ланолин, вазелиновое масло, липополисахарид бактерий, препараты бордетелл и др. Наиболее популярным у исследователей является адъювант Фрейнда, состоящий из вазелинового масла, ланолина (неполный адъювант) и микобактерий туберкулезной палочки (полный адъювант). Прививка людей инактивированными вакцинами против гриппа и полиомиелита с неполным адъювантом Фрейнда подтвердила их эффективность. Аналогичные адъюванты с успехом использовали для усиления иммуногенности вирусных вакцин против ящура, парагриппа типа 3, болезни Ауески, чумы плотоядных, инфекционного гепатита собак, болезни Гамборо, ньюкаслской болезни, гриппа лошадей, ротавирусной диареи телят и других болезней. Такие вакцины вызывают выраженный и продолжительный иммунный ответ. Благодаря этому значительно повышается эффективность вакцинации и сокращается количество ежегодных прививок. Каждый адъювант вводится в организм согласно прилагаемой к адъюванту инструкции: подкожно, внутримышечно, внутрибрюшинно и т. д.
Сущность адъювантного действия названных препаратов заключается в сдерживании поступления смешанного с ними антигена в организм, что пролонгирует его иммунизирующее действие, снижает реактогенность, а в некоторых случаях вызывает и бласт-трансформацию (рис. 45).
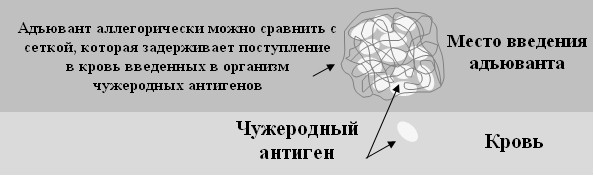
Рис. 45. Сдерживающее воздействие адъюванта на распространение антигена
Большинство адъювантов способны депонировать антиген, т. е. адсорбировать его на своей поверхности и длительное время сохранять в организме, что увеличивает продолжительность его влияния на иммунную систему. Однако при изготовлении антисыворотки для иммунохимического анализа, особенно с целью установления природы антигенов или антигенных связей, избегают использования микробных адъювантов, поскольку они снижают специфичность антисыворотки. Происходит это за счет гетерогенности (или гетерофильности антигенов), т. е. антигенной общности микробов различных таксономических групп, тканей растений, животных и человека.
Антигены как фактор иммунорегуляции
Адаптивный (приобретенный) иммунитет развивается, как правило, в результате первичного контакта иммунной системы с инфекционным агентом. Начинается пролиферация соответствующих антигенспецифических клеток, эффекторные механизмы устраняют антиген, вследствие этого интенсивность ответа данной специфичности падает при сохранении возможности организма реагировать на другие инфекции. Для ограничения образования антител должен существовать механизм обратной связи. Иначе после антигенной стимуляции организм стал бы переполняться клонами антителообразующих клеток и их продуктами одной специфичности, т. е. оказался бы в ситуации, когда утрачивается контроль пролиферации лимфоцитов. Разумеется, главным регулятором образования антител может быть сам антиген: в его присутствии иммунный ответ стимулируется, а при уменьшении концентрации – снижается (рис. 46).
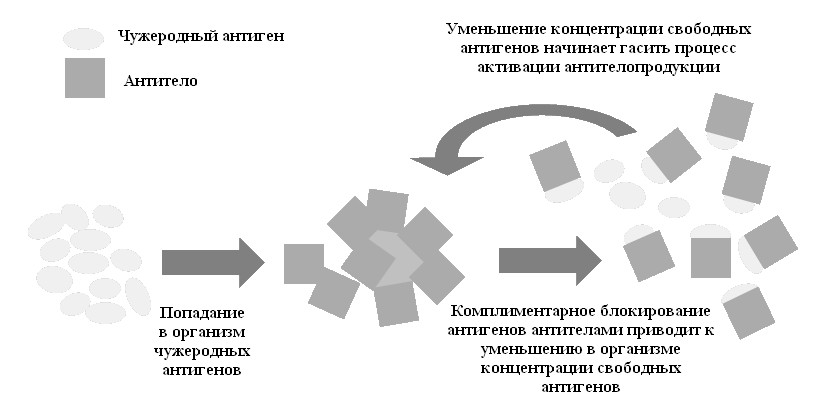
Рис. 46. Механизм обратной связи как регулятор образования антител
Существование такого механизма многократно доказано. Таким образом, концентрация введенного антигена – главный фактор регуляции гуморального иммунного ответа. Снижение эффективной концентрации антигена в результате катаболизма или обратного действия самих антител приводит к угасанию синтеза антител.
Иммунные реакции организма
Центральные и периферические органы иммунной системы
Существует своеобразная иерархия органов иммунной системы. В ней можно выделить первичные – самые главные, это костный мозг и тимус или вилочковая железа и вторичные к которым относятся лимфатические узлы, селезенка, лимфоидная ткань, ассоциированная со слизистыми оболочками) органы. Все они связаны между собой и другими тканями организма с помощью кровеносных и лимфатических сосудов, по которым передвигаются лейкоциты.
Костный мозг
1. В нем из стволовой клетки-предшественника (родоначальница всех клеток крови) возникают клетки иммунной системы.
2. Там же проходят дифференцировку (от лат. differentia – различие) и развитие В-лимфоциты.
3. 3. Есть данные, указывающие на то, что костный мозг является одним из основных мест синтеза антител. Так, у взрослой мыши в костном мозге находится до 80 % клеток, синтезирующих иммуноглобулины. Внутривенное введение клеток костного мозга может восстановить иммунную систему у смертельно облученных животных.
Тимус
1. В тимусе происходит созревание клеток-предшественниц Т-лимфоцитов и превращение их в зрелые формы.
2. Т-лимфоциты, проявляющие враждебность к собственным антигенам организма, подвергаются апоптозу (запрограммированной гибели).
3. Тимус вырабатывает также ряд гормонов (например, тимозин), которые регулируют дифференцировку и функции Т-лимфоцитов.
Лимфоузлы
Это периферические органы иммунной системы, расположенные по ходу лимфатических сосудов. Основная функция – задержание и предотвращение распространения антигенов осуществляется за счет Т- и В-лимфоцитов (Т- и В-зависимые зоны).
Селезенка
1. Селезенка задерживает и уничтожает антигены, циркулирующие в крови.
2. Кроме того, здесь продуцируются иммуноглобулины. После спленэктомии (удалении селезенки) наблюдается снижение уровня антител сыворотки крови.
3. Селезенка – место образования гормоноподобных веществ – цитокинов (тафтсин и спленин), участвующих в регуляции деятельности макрофагов.
4. В селезенке происходит фагоцитоз поврежденных и старых эритроцитов.
Лимфоидная ткань, ассоциированная со слизистыми оболочками
Для обозначения ее в англоязычной литературе используется аббревиатура MALT. Данный вид лимфоидной ткани располагается под эпителием. Сюда относятся аппендикс, лимфатические фолликулы кишечника и лимфоидное кольцо Пирогова (язычная + небная + глоточная миндалины). MALT – является барьером на пути проникновения микроорганизмов через слизистые оболочки.
Клетки иммунной системы
Основными элементами иммунной системы организма являются белые клетки крови – лимфоциты, существующие в двух формах. Обе формы происходят из клеток-предшественников в костном мозге, т.н. стволовых клеток. Незрелые лимфоциты покидают костный мозг и попадают в кровяное русло. Некоторые из них направляются к тимусу (вилочковой железе), расположенному у основания шеи, где происходит их созревание. Прошедшие через тимус лимфоциты известны как Т-лимфоциты, или Т-клетки (Т от «тимус»). В экспериментах на цыплятах было показано, что другая часть незрелых лимфоцитов закрепляется и созревает в сумке Фабрициуса – лимфоидном органе около клоаки. Такие лимфоциты известны как В-лимфоциты, или В-клетки (B от bursa – сумка). У человека и других млекопитающих В-клетки созревают в лимфатических узлах и лимфоидной ткани всего организма, эквивалентных сумке Фабрициуса у птиц.
Оба типа зрелых лимфоцитов имеют на своей поверхности рецепторы, которые могут «узнавать» специфический антиген и связываться с ним. Контакт В-клеточных рецепторов со специфическим антигеном и связывание определенного его количества стимулируют рост этих клеток и последующее многократное деление; в результате образуются многочисленные клетки двух разновидностей: плазматические и «клетки памяти». Плазматические клетки синтезируют антитела, выделяющиеся в кровоток. Клетки памяти являются копиями исходных В-клеток; они отличаются большой продолжительностью жизни, и их накопление обеспечивает возможность быстрого иммунного ответа в случае повторного попадания в организм данного антигена.
Что касается Т-клеток, то при связывании их рецепторами значительного количества определенного антигена они начинают секретировать группу веществ, называемых лимфокинами. Некоторые лимфокины вызывают обычные признаки воспаления: покраснение участков кожи, местное повышение температуры и отек за счет увеличения кровотока и просачивания плазмы крови в ткани. Другие лимфокины привлекают фагоцитирующие макрофаги – клетки, которые могут захватывать и поглощать антиген (вместе со структурой, например бактериальной клеткой, на поверхности которой он находится). В отличие от Т- и В-клеток эти макрофаги не обладают специфичностью и атакуют широкий спектр разных антигенов. Еще одна группа лимфокинов способствует разрушению инфицированных клеток. Наконец, ряд лимфокинов стимулирует добавочное количество Т-клеток к делению, что обеспечивает быстрое возрастание числа клеток, которые отвечают на тот же антиген и выделяют еще больше лимфокинов.
Антитела, вырабатываемые В-клетками и поступающие в кровь и другие жидкости организма, относят к факторам гуморального иммунитета (от лат. humor – жидкость). Защита организма, осуществляемая с помощью Т-клеток, называется клеточным иммунитетом, так как в ее основе лежит взаимодействие отдельных клеток с антигенами. Т-клетки не только активируют другие клетки путем выделения лимфокинов, но и атакуют антигены с помощью содержащих антитела структур на поверхности клетки.
Антиген может индуцировать оба типа иммунного ответа. Более того, в организме происходит определенное взаимодействие между Т- и В-клетками, причем Т-клетки осуществляют контроль над В-клетками. Т-клетки могут подавлять B-клеточный ответ на безвредные для организма чужеродные вещества или, наоборот, побуждать В-клетки вырабатывать антитела в ответ на вредные вещества с антигенными свойствами. Повреждение или недостаточность данной контролирующей системы может проявляться в виде аллергических реакций на вещества, обычно безопасные для организма.
Иммунологическая память
Иммунологическая память основана на наличии Т- и В-клеток памяти, которые образуются при первичном введении антигена (первичном иммунном ответе). За счет клеток памяти происходит ускоренное и более эффективное удаление этих же антигенов при их повторном введении (вторичном иммунном ответе). При вторичном иммунном ответе значительно возрастает скорость образования, количество и аффинность IgG. Иммунологическая память – одна из форм иммунного ответа. Она обозначает способность организма человека или животного реагировать на повторное введение того антигена, которым он был иммунизирован ранее, быстрее и с большей силой. Иммунологическая память проявляется как в отношении выработки антител, так и в отношении других иммунных реакций (гиперчувствительность замедленного типа, трансплантационный иммунитет и прочее), и может сохраняться длительное время. Носителями иммунологической памяти становятся Т- и В-лимфоциты после взаимодействия с соответствующими антигеном, или так называемые антигенстимулированные лимфоциты. Клетки памяти представляют собой ту часть Т- и В- антигенстимулированных лимфоцитов, которые после 2–3-х делений переходят в покоящееся состояние и длительное время рециркулируют в организме. При повторной встрече с соответствующим антигеном быстро превращаются в клетки-эффекторы иммунного ответа. В-лимфоциты в этом случае быстро трансформируются в антителообразующие клетки, и выработка антител происходит по вторичному типу. В свою очередь антигенстимулированные Т-лимфоциты, циркулируя в организме, готовы в любой момент распознавать антиген, который их сенсибилизовал, и немедленно включиться в иммунный ответ.
Иммунологическая толерантность
Иммунологическая толерантность (tolerantia – терпение, терпимость) – специфическая неотвечаемость организма на определенный антиген при одновременном сохранении реактивности на другие антигены. Это явление противоположно иммунитету. Оно может развиться и в постнатальный период при введении больших или очень малых доз неагрегированных белков. У некоторых животных это наследственно обусловленное состояние.
Толерантность можно определить также как неспособность организма отличать собственные, вырабатывающиеся в нем вещества, к которым он должен быть толерантен, от чужеродных веществ, против которых в нем должны вырабатываться антитела. Так, организм перестает вырабатывать антитела против попавших в него инородных веществ, если какой-либо антиген был введен в него до момента полного формирования системы, вырабатывающей антитела; очевидно, присутствие антигена внутри растущих клеток подавляет образование в них антител.
Практическое значение явления толерантности в ветеринарии пока не достаточно изучено, оно широко используется при трансплантации. Феномен иммунологической толерантности установлен при бруцеллезе, лептоспирозе, чуме свиней, столбняке и ряде вирусных инфекций. Известно, что толерантность может возникнуть как в системе клеточного, так и гуморального иммунитета (раздельно и вместе).
Общая характеристика антител
Антитела (иммуноглобулины) – растворимые гликопротеины, присутствующие в сыворотке крови, тканевой жидкости или на клеточной мембране. Иммуноглобулины синтезируются плазматическими клетками в ответ на чужеродные вещества определенной структуры – антигены. Антитела распознают и связывают антигены и поэтому используются иммунной системой для идентификации и нейтрализации чужеродных объектов, например, бактерий и вирусов. Антитела выполняют две функции: антигенсвязывающую и эффекторную (например, запуск классической схемы активации комплемента и связывание с клетками). Они являются важнейшим фактором специфического гуморального иммунитета. У млекопитающих выделяют пять классов (в англоязыч. варианте используется синоним изотипы) иммуноглобулинов – IgG, IgA, IgM, IgD, IgE, в основу разделения на которые положены типы тяжелых цепей, различающиеся между собой по строению и аминокислотному составу. Иммуноглобулины состоят из двух легких и двух тяжелых цепей.
Распознавание антигена – основная функция специфического адаптивного иммунного ответа. В этом процессе участвуют молекулы двух типов: иммуноглобулины (антитела); Т-хелперные рецепторы (TCR).
Иммуноглобулины продуцируются в виде: мембранно-связанных рецепторов на поверхности В-клеток; растворимых молекул, секретируемых плазматическими клетками, присутствующими в сыворотке и тканевой жидкости. Контакт В-клеточного рецептора со специфичным для него антигеном ведет к активации В-клеток и их дифференцировке в плазматические клетки, секретирующие большое количество антител (рис. 47).
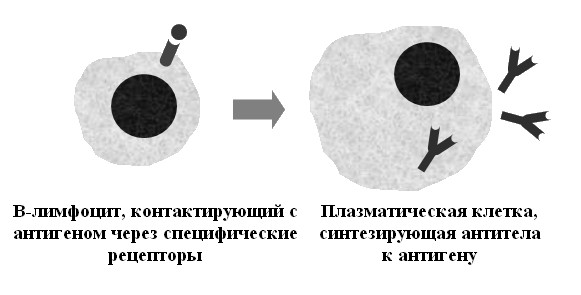
Рис. 47. Активация В-лимфоцитов
Иммуноглобулин любого класса, будучи бифункциональным соединением (за исключением IgD), распознает и связывает антиген, а затем усиливает киллинг и/или удаление иммунного комплекса, сформированного в результате активации эффекторных механизмов. Одна область молекулы антитела Fab (от англ. fragment antigen binding – антигенсвязывающий фрагмент) определяет ее антигенную специфичность, а другая Fc (от англ. fragment crystallizable – фрагмент, способный к кристаллизации) – осуществляет эффекторную функцию: связывание с рецептором, которые экспонирован на клеточной мембране (например, мембране фагоцита), и связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
Иммуноглобулины различаются: размером молекулы; зарядом молекулы; последовательностью аминокислотных остатков; содержанием углеводных звеньев.
Иммуноглобулины составляют около 30 % всех белков сыворотки крови. Их количество значительно возрастает после антигенной стимуляции. Антитела могут принадлежать к любому из пяти классов иммуноглобулинов. Молекулярная масса молекулы легкой цепи (L) иммуноглобулина составляет около 22 кДа, тяжелой (Н) – от 50 до 70 кДа в зависимости от класса иммуноглобулина. Основной структурной единицей иммуноглобулинов всех классов является димер двух идентичных пар легкой и тяжелой цепей (L–Н)2.
Основные функции антител
Антитела через антигенсвязывающие центры взаимодействуют с различными антигенами и тем самым предотвращают инфицирование организма, при этом происходит элиминация возбудителя или блокирование развития патологических реакций вследствие активации всех систем специфической защиты.
Соответствующий Fab-фрагмент антитела связывается с антигеном клеточной стенки микроорганизма, а Fc-фрагмент этого же антитела взаимодействует с соответствующим рецептором, располагающимся на поверхности фагоцита (макрофаги и гранулоциты, например, нейтрофилы). Опсонизируя антигены, антитела стимулируют последующее эффективное поглощение фагоцитом образовавшегося комплекса и его разрушение цитотоксическими клетками. Как следует из описанного выше, оба процесса являются сопряженными и следуют друг за другом.
Антитела могут связывать и тем самым инактивировать бактериальные токсины.
Антитела (IgM и IgG) после связывания с антигеном (микроорганизм, опухолевая клетка и др.) активируют систему комплемента, что приводит к уничтожению этой клетки путем перфорации ее клеточной стенки, усиления хемотаксиса, хемокинеза и иммунного фагоцитоза.
Для того чтобы воспрепятствовать адгезии патогенных микроорганизмов (вирусы, бактерии, простейшие и др. патогены) на поверхности клетки организма-хозяина и тем самым предотвратить в нее проникновение патогена, антитела должны на опережение связаться с рецепторами клетки организма-хозяина, другими словами, блокировать те клеточные рецепторы, с которыми взаимодействуют и патогенные микроорганизмы.
Антитела связывают растворимые антигены, в результате чего образуются циркулирующие комплексы, которые выводятся из организма преимущественно с мочой и желчью.
Динамика образования антител
Синтез молекул иммуноглобулинов осуществляется в плазматических клетках. Тяжелые и легкие цепи молекулы синтезируются на разных хромосомах и кодируются разными наборами генов. Процесс синтеза антител контролируется механизмом отрицательной обратной связи, т. е. продукт реакции одновременно служит ее ингибитором.
Действие антител нельзя объяснить просто нейтрализацией антигена потому, что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab’)2-фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc-рецепторами на поверхности B-клеток. Инъекция IgM усиливает иммунный ответ. Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывают усиливающую роль.
Способность к образованию антител появляется во внутриутробном периоде у 20-недельного эмбриона. После рождения начинается собственная продукция иммуноглобулинов, которая увеличивается до наступления зрелого возраста и незначительно снижается к старости. На скорость образования антител влияет ряд факторов: доза антигена (сила воздействия антигена), частота стимуляции антигеном (антигенной стимуляции) и состояние иммунной системы индивида (т. е. его иммунный статус).
Первичный иммунный ответ. Появлению антител предшествует латентный период. В латентной фазе происходят переработка и представление антигена иммунокомпетентным клеткам, размножение клона клеток, специализированного на выработку антител к данному антигену, начинается синтез антител. В этот период антитела в крови не обнаруживаются. Во время логарифмической фазы синтезированные антитела высвобождаются из плазмоцитов и поступают в лимфу и кровь. Первые образующиеся антитела принадлежат к иммуноглобулину класса M. Продолжительность логарифмической фазы составляет 7–15 суток.
В стационарной фазе количество антител достигает максимума и стабилизируется. Эта фаза протекает в течение 15–30 суток, затем наступает фаза снижения уровня антител, которая имеет наибольшую продолжительность – до 1–6 месяцев и более. Таким образом, особенность первичного иммунного ответа в том, что первоначально синтезируются IgM-антитела, максимум содержания которых в крови приходится на 7–11-е сутки и, постепенно уменьшаясь, осуществляется переход к синтезу IgG-антител. Так как переключение синтеза от IgM-антител к синтезу IgG-антител не меняет специфичности по отношению к конкретному антигену, то этот переход не связан с клональной селекцией. Кроме низкой скорости антителообразования, другая особенность – появление сравнительно невысоких титров антител.
Для вторичного иммунного ответа после проведения антигенной стимуляции (первичного иммунного ответа) часть В- и Т-лимфоцитов циркулирует в виде клеток памяти. Латентная фаза укорачивается до нескольких часов или 1–2 суток, логарифмическая фаза характеризуется более быстрым нарастанием титров антител и достижением больших значений IgG-антител, который в последующих фазах длительно удерживается и медленно, иногда в течение нескольких лет, снижается. В этом и состоит особенность вторичного иммунного ответа. Способность к иммунному ответу при вторичной стимуляции антигеном сохраняется в течение многих лет и представляет собой проявление иммунологической памяти, примерами которой может служить противокоревой и противооспенный иммунитет. При вторичном иммунном ответе в отличие от первичного синтезируются главным образом IgG.
Такое различие динамики антителообразования при первичном и вторичном иммунном ответе объясняется тем, что после первичного введения антигена в иммунной системе формируется клон лимфоцитов, несущих иммунологическую память о данном антигене. После повторной встречи с этим же антигеном клон лимфоцитов с иммунологической памятью быстро размножается и интенсивно включает процесс антителогенеза.
Быстрое и энергичное антителообразование при повторной встрече с антигеном используется в практических целях при необходимости получения высоких титров антител при производстве диагностических и лечебных сывороток от иммунизированных животных, а также для экстренного создания иммунитета при вакцинации.
Аффинность и авидность антител
Клонально-селекционная теория постулирует: каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в виде рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген, похожий на полимеризованный флагеллин, связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном, и они имеют одинаковую специфичность, т. е. одинаковый идиотип.
Антиген связывается только с той клеткой иммунной системы, которая несет рецепторы, комплементарные антигену. В результате клетка активируется, и начинается синтез большого количества антител. И так как клетка синтезирует антитела только одной специфичности, эта специфичность совпадает со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами (рис. 48). Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант. Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами.
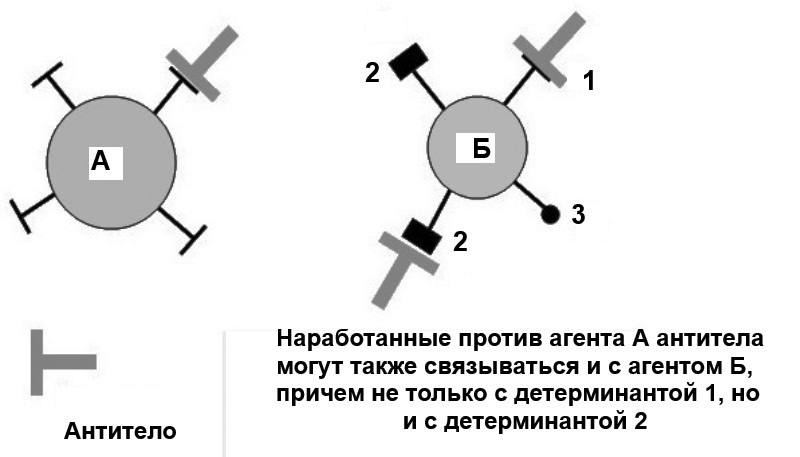
Рис. 48. Неабсолютность специфичности антител
Силу взаимодействия (притяжения) антигена и антитела принято обозначать как аффинность (рис. 49). Она представляет собой сумму сил притяжения и отталкивания, возникающих в результате соединения связывающего участка моновалентного Fab-фрагмента с его эпитопом.
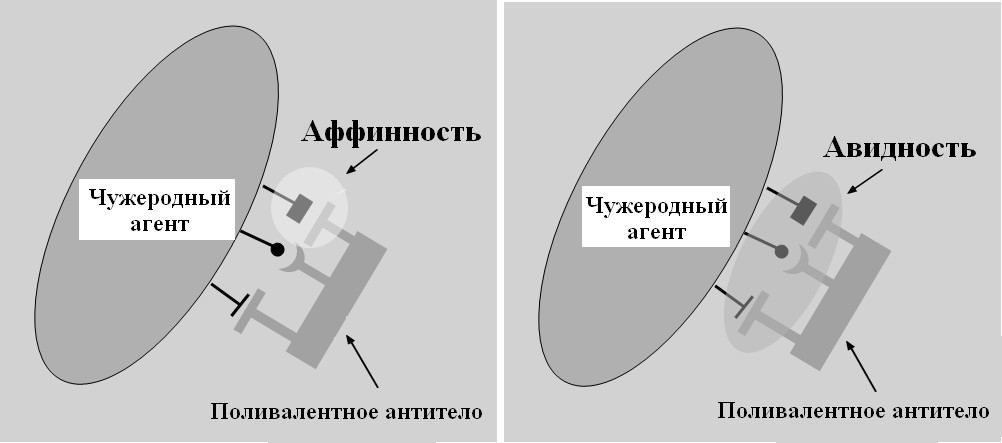
Рис. 49. Аффинность и авидность
Реакция антиген – антитело обратима и поэтому подчиняется закону действующих масс, что позволяет рассчитать аффинность антител как константу равновесия – К (константа ассоциации).
Каждая четырехцепочечная единица антител несет два антигенсвязывающих центра, и поэтому антитела в реакции антиген – антитело потенциально являются поливалентными.
Кроме того, антигены могут быть:
· моновалентными (например, небольшие химические группы, гаптены);
· поливалентными (например, бактерии).
Прочность (силу) связывания поливалентных антител с поливалентным антигеном называют авидностью, в отличие от аффинности, когда речь идет о взаимодействии моновалентного фрагмента антитела с одной антигенной детерминантой.
Авидность антител к антигену зависит от аффинности связывания отдельных пар паратоп – эпитоп. В тех случаях, когда с антигеном связываются оба антигенсвязывающих участка антитела, авидность выше, чем арифметическая сумма аффинностей, поскольку для диссоциации иммунного комплекса необходим разрыв сразу всех связей.
В физиологических условиях авидность, возможно, служит более важным показателем, чем аффинность, т. е. антитела как минимум бивалентны, а большинство природных антигенов – поливалентны.
Иммуноглобулины различных классов
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Иммуноглобулин G (IgG) имеет молекулярную массу около 160 кДа, молекула состоит из одной (L–Н)2-субъединицы и содержит два антигенсвязывающих центра. IgG является основным иммуноглобулином сыворотки крови (составляет 70–75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2–3 % углеводов; два антигенсвязывающих Fab-фрагмента и один Fc-фрагмент. Fab-фрагмент (50–52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединенных между собой дисульфидной связью, тогда как Fc-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по четыре на тяжелых и по два на легких цепях.
Иммуноглобулин М (IgM) имеет молекулярную массу 900 кДа. Молекула состоит из 5 (L-Н)2-субъединиц и одной копии полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывает соседние Fc-фрагменты иммуноглобулина. IgM появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами. Содержат 10–12 % углеводов. Образование IgM происходит еще в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи. Синтез легких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате чего образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, играя роль антиген-распознающего рецептора. С этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
Сывороточный IgA составляет 15–20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например, в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10–12 % углеводов, молекулярная масса – 500 кДа.
Иммуноглобулин D (IgD) составляет менее 1 % фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса – 175 кДа.
Иммуноглобулин E (IgE) в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обусловливает многие аллергические реакции. Механизм действия IgE проявляется через связывание с высоким сродством с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высокоактивных аминов (гистамина и серотонина – медиаторов воспаления). Молекулярная масса – 200 кДа.
Иммунологический статус организма
В связи с тем, что иммунная система играет важнейшую роль в обеспечении структурной и функциональной целостности организма, ее собственное состояние в каждый момент, то есть иммунологический статус организма, представляет исключительный интерес для иммунологии. Потенциальные способности к выздоровлению от многих, особенно инфекционных, болезней являются функцией иммунологического статуса организма. Любые нарушения иммунной системы, несомненно делают организм более восприимчивым к возбудителям инфекционных болезней, в том числе к условно- и слабопатогенным; увеличивают вероятность возникновения опухолей, аутоиммунодефициты могут быть обусловлены расстройствами на самых разных ее уровнях и в различных ее подсистемах. обнаружение уязвимого звена иммунной системы в этом случае становится решающим моментом для поиска путей коррекции иммунодефицитов.
В принципе под иммунологическим статусом организма следует понимать эффективность и согласованность работы каждой из систем иммунитета, то есть систем макрофагов, комплемента, интерферонов, В- и Т-лимфоцитов, киллерных клеток, главной системы гистосовместимости, клеток иммунной памяти, антителопродуцирующих клеток и центральных органов иммунитета. Для оценки общего иммунологического статуса необходимо отобрать наиболее простые, но вместе с тем и наиболее достоверные показатели, которые позволяли бы судить одновременно о суммарной эффективности работы всех систем иммунитета в целом. Для выявления ж уязвимого звена иммунной системы требуются наборы более тонких дифференциальных показателей, специфичных для каждой данной системы. Следовательно, изучение иммунологического статуса организма целесообразно проводить не менее чем в два приема- вначале вывить общее ее состояние, а затем определить, какое звено иммунной системы функционирует слабо или не работает совсем.
Для оценки общего состояния иммунной системы можно использовать определение числа Т- и В-лимфоцитов в крови, уровень иммуноглобулинов IgA, IgM и IgG в крови. В случае отклонений, выявленных на этом уровне исследований, или при наличии других симптомов иммунологической недостаточности эти же авторы рекомендуют производить дополнительные иммунологические исследования целью выявления эффективности функционирования отдельных звеньев системы иммунитета, в частности: определение фенотипа лимфоцитов, количества Т-супрессоров, Т-хелперов, киллерных клеток, реактивности на антиген, содержание компонентов комплемента, IgE, IgD, секреторных IgA и т.п. Определение иммунологического статуса организма и его нарушений имеет настолько важное значение, что соответствующие критерии и методы исследования состояния иммунной системы, несомненно, будут в ближайшие годы усовершенствованы.
Контрольные вопросы. 1. Дайте определение инфекции. 2. Назовите отличительные особенности инфекционных болезней. 3. Что называют патогенностью и вирулентностью? Опишите основные механизмы патогенного действия бактерий на макроорганизм. 4. Перечислите факторы патогенности бактерий. 5. В чем отличие экзо- и эндотоксинов бактерий? 6. Что называют адгезией бактерий? 7. В чем заключается роль условно-патогенных микроорганизмов? 8. Какова роль иммунологии в медицине и санитарной микробиологии? 9. Перечислите основные открытия Л. Пастера в иммунологии. 10. Перечислите основоположников иммунологии и их достижения в этой области. 11. Каковы основные достижения иммунологии, начиная с середины XX-го века? 12. Перечислите и охарактеризуйте центральные органы иммунной системы. 13. Охарактеризуйте роль костного мозга в иммунитете. 14. Охарактеризуйте роль тимуса в иммунитете. 15. Расскажите о периферических органах иммунной системы. 16. Охарактеризуйте роль селезенки в иммунитете. 17. Охарактеризуйте роль лимфатических узлов в иммунитете. 18. Расскажите о лимфоидных образованиях органов пищеварения. 19. Дайте определение антигену. 20. Что называется эпитопом? 21. Опишите специфичность и иммуногенность антигена. 22. Назовите основные отличия полноценных антигенов и неполноценных. 23. На какие группы подразделяют антигены животного происхождения? 24. Назовите и опишите антигены бактерий. 25. Какова биологическая роль антител? 26. Покажите и объясните структуру антитела. 27. Перечислите основные классы иммуноглобулинов и опишите их свойства. 28. Дайте понятия аффинности и авидности антител.
Дата добавления: 2019-09-13; просмотров: 326; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
