Реакция связывания комплемента (РСК)
РСК проводят с участием не только АГ и АТ, но и комплемента. Поскольку она не сопровождается видимыми изменениями, для обнаружения связывания комплемента используют индикаторную гемолитическую систему. Эта система состоит из эритроцитов барана и гемолитической сыворотки кролика. В присутствии комплемента в гемолитической сыворотке происходит хорошо наблюдаемый лизис эритроцитов. Принцип метода состоит в том, что если в опыте комплекс АГ-АТ образовался и комплемент связался с ним (т. е. в растворе свободного комплемента не осталось), то лизис эритроцитов не произойдет, и эритроциты осядут на дно пробирки. Если комплекс не формируется, комплемент остается свободным и реагирует с гемолитической системой, вызывая в результате лизис эритроцитов. Этот механизм лежит в основе реакции Вассермана (диагностика сифилиса).Общую активность системы комплемента определяют в так называемой гемолитической системе по РСК. Гемолитическая система представляет собой смесь эритроцитов барана и стандартной специфической антисыворотки, содержащей АТ к этим эритроцитам, но искусственно лишенной собственного комплемента. В такой системе гемолиз эритроцитов не происходит в связи с отсутствием важного звена процесса связывания АТ с АГ – комплемента, разрушенного предварительным нагреванием. Если в такую систему добавить исследуемую сыворотку больного, содержащую комплемент, образуется иммунный комплекс, и происходит склеивание и гемолиз эритроцитов. Чем больше концентрация комплемента в исследуемой сыворотке, тем более выражен гемолиз эритроцитов.
|
|
|
В норме уровень комплемента сыворотки крови составляет 20–40 гемолитических единиц. При острых инфекционных и воспалительных заболеваниях наблюдается, как правило, увеличение активности комплемента, при хронических – ее снижение. Низкие значения гемолитической активности могут отражать врожденную или приобретенную недостаточность отдельных компонентов системы комплемента. Следует отметить, что дефекты данной системы рассматриваются как самые частые наследственные аномалии белков человека. Они могут играть патогенетическую роль при следующих заболеваниях и синдромах:
1. Рецидивирующие бактериальные пиогенные инфекции органов дыхания, кожи и других органов: пневмонии, бронхоэктазы, рецидивирующий синусит, пиодермия, генерализованные бактериальные инфекции, септицемия.
2. Рецидивирующие менингококковые и гонококковые инфекции (менингококковый менингит, диссеминированные гонококковые инфекции, гонококковые артриты и др.).
3. Аутоиммунные, аллергические заболевания и болезни иммунных комплексов: системная красная волчанка, дерматомиозит, мембранопролиферативный гломерулонефрит, болезнь Шенлейн – Геноха, синдром Шегрена, тромбоцитопеническая пурпура, склеродермия, ювенильный ревматоидный артрит, рецидивирующий ангионевротический отек (особенно часто – ларингоспазм), дерматозы, фоточувствительность и др.
|
|
|
Реакция связывания комплемента используется для лабораторной диагностики риккетсиозов, вирусных инфекций (грипп, корь, клещевой энцефалит и др.) и основывается на способности комплемента связываться с комплексом АГ-АТ. Комплемент адсорбируется на Fc-фрагменте иммуноглобулинов G и М. Реакция протекает в две фазы. Первая фаза – взаимодействие АГ и АТ. В качестве материала, содержащего АТ, используется исследуемая сыворотка, к которой добавляется известный АГ. К этой системе добавляют стандартный комплемент и инкубируют при плюс 37 °С в течение одного часа. Вторая фаза – выявление результатов реакции при помощи индикаторной гемолитической системы (эритроциты барана и гемолитическая сыворотка кролика, содержащая гемолизины к эритроцитам барана). К смеси АГ-АТ-комплемент (1-я фаза) добавляют индикаторную систему и вновь инкубируют при плюс 37 °С в течение 30–60 минут, после чего оценивают результаты реакции. Разрушение эритроцитов происходит в случае присоединения к гемолитической системе комплемента. Если комплемент адсорбировался ранее на комплексе АГ-АТ, то гемолиз эритроцитов не наступает. Гемолиз происходит в том случае, когда в исследуемой сыворотке содержатся специфические АТ к диагностическому АГ. При отсутствии в исследуемой сыворотке специфических АТ комплекс АГ-АТ не образуется, и комплемент остается несвязанным. При добавлении гемолитической системы комплемент присоединяется к ней, и происходит гемолиз эритроцитов. Интенсивность РСК оценивают по четырехкрестной системе в зависимости от степени задержки гемолиза и наличия осадка эритроцитов. Все компоненты РСК, за исключением исследуемой сыворотки, должны быть оттитрованы (рис. 58).
|
|
|
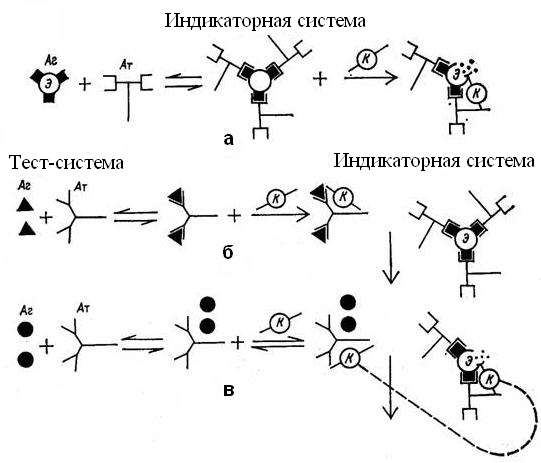
Рис. 58. РСК: а – лизис сенсибилизированных эритроцитов в присутствии комплемента, б – отсутствие гемолиза вследствие фиксации комплемента комплексом АГ–АТ, в – лизис эритроцитов в результате отсутствия комплекса АГ–АТ
Тесты с ингибированием гемагглютинации эритроцитов
Тесты с ингибированием гемагглютинации эритроцитовне отличаются особой чувствительностью определений, но зато относительно просты в исполнении и нетрудозатратны. Для проведения такого исследования смешивают анализируемый объект с раствором АГ (подозреваемой патологии). Если в испытуемом образце имеются АТ к АГ возбудителя, происходит их комплексообразование, которое в дальнейшем предотвращает агглютинацию (слипание и выпадение в осадок) эритроцитов под влиянием молекул АГ. Реакция выполняется на планшетах с лунками с коническим дном, результат (наличие или отсутствие агглютинации) наблюдают непосредственно, т. е. невооруженным глазом. Натренированный человек способен различать даже фазы протекания агглютинации. В реакции применяются эритроциты подходящего организма. К сожалению, многие гликопротеины, являющиеся АГ вообще, способны давать реакцию агглютинации эритроцитов, поэтому метод не отличается особой специфичностью.
|
|
|
Практически приходится часто использовать целый набор серологических методов диагностики для одной какой-либо болезни. Особенно показателен в этом отношении бруцеллез. Для его диагностики применяют две серологические реакции – реакция агглютинации и РСК. С помощью первой выявляют свежие случаи болезни, второй – развитие инфекционного процесса. В качестве арбитражного метода используют и третий тест – реакцию Кумбса, поскольку синтез неполных АТ завершает образование полных АТ, улавливаемых в реакции агглютинации и РСК. Кроме того, экспериментально доказано совпадение результатов исследования животных на бруцеллез реакцией агглютинации, РСК, реакцией Кумбса с показаниями метода флуоресцирующих АТ в непрямом варианте. Таким образом, последняя реакция принципиально информативнее всех предыдущих диагностических тестов (рис. 59). Она может регистрировать АТ классов М, G как полные, так и неполные.
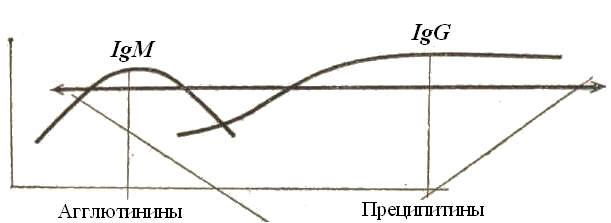
Рис. 59. Серологическое тестирование бруцеллезного процесса у рогатого скота
Диагностические серологические тесты не позволяют строго разграничить вакцинальный и эпизоотический процессы у бруцеллезного скота. Их можно разграничить при исследовании классов иммуноглобулинов в динамике. Если, скажем, через 1,5–2 месяца синтез IgM снизится или заместится синтезом IgG, то это будет характеризовать эпизоотический процесс, связанный с репликацией возбудителя в организме.
Наличие иммуноглобулинов определенного класса важно исследовать и в других случаях. Количество их устанавливают с помощью методов радиальной иммунодиффузии, а при низкой концентрации – радиоиммунного анализа. Метод радиальной иммунодиффузии основан на прямой зависимости диаметра кольца преципитата, который образуют иммуноглобулин пробы с антисывороткой, смешанной с гелем. Радиоиммунный анализ основан на учете радиоактивного АГ, оставшегося над осадком из-за конкурентного связывания нативного АГ. Последний метод более чувствителен (позволяет определять АГ в пикограммах), но требует специального оборудования и меченых реагентов.
При определении титра секреторных АТ к бактериям используют реакцию агглютинации со слизью. Уровень секреторных АТ не совпадает с содержанием сывороточных АТ и в десятки раз превышает последние.
Дата добавления: 2019-09-13; просмотров: 239; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
