Оборудование для производства твердых капсул методом макания.
В зависимости от различных модификаций отдельных механизмов и устройств, а также формы рам-держателей и их количества меняются разные конструкции машин, работающие по принципу погружения.
Их выпускают фирмы «Colton» (США) «IМА» (Италия).
Полуавтомат «Colton» состоит из «макательной ванны» в термостатируемом кожухе, погружающего механизма со штифтами, сушильной установки, автоматического узла для подрезания, снятия и комплектования капсул.
Принцип работы:
Цилиндрические формы – штифты (оливы) на раме-держателе плавно погружаются с помощью автоматического устройства в желатиновую массу. Они вращаются вокруг своей оси, поднимаются и дают стечь избытку массы.
Правильное распределение желатиновой пленки обеспечивается:
· точной регулировкой скорости вращения рамы;
· вязкостью желатина;
· глубиной окунания.
В результате капсулы имеют однородную стенку определенной толщины.
Полученные оболочки подвергаются сушке:
· Сначала при температуре воздуха 26-27 °С и до относительной влажности 45-50 %.
· Затем при температуре 18 °С до относительной влажности 10-15%.
Из сушильной установки рамы подаются в автоматический узел, где оболочки капсулы сначала подрезаются ротационным ножом, затем снимаются механическими лапками и подаются в блок комплектации.
Штифты очищаются, смазываются маслами, после чего технологический цикл повторяется. Продолжительность цикла 45-47 мин. Пустые твердые капсулы наполняются ЛС на специальных наполняющих машинах.
|
|
|
Испытания для капсул: однородность дозированных единиц, однородность содержания, однородность массы, растворение, распадаемость для твердых и мягких капсул. Упаковка, маркировка, хранение капсул.
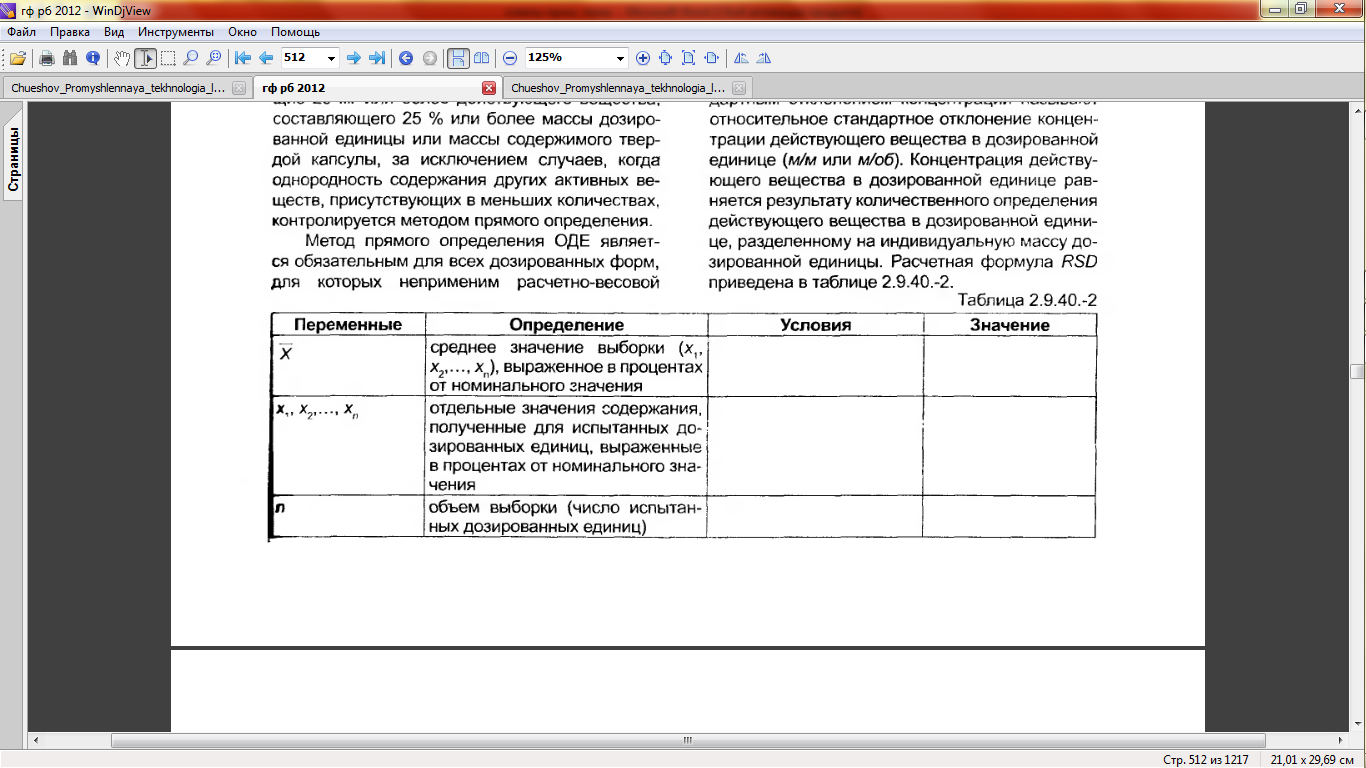
2.9.40. ОДНОРОДНОСТЬ ДОЗИРОВАННЫХ ЕДИНИЦ
Для обеспечения однородности дозированных единиц (ОДЕ) содержание активного вещества в каждой дозированной единице в серии должно находиться в пределах узкого диапазона от номинального содержания, указанного в разделе «Состав». Однородность дозированных единиц определяется как степень однородности распределения активного вещества в дозированных единицах.
Однако, если в Фармакопее нет других указаний, требования данной статьи распространяются на каждое активное вещество, входящее в состав дозированных единиц лекарственного средства, содержащих одно или несколько активных веществ.
Для определения ОДЕ следует применять один из двух методов (таблица 2.9.40.-1):
––метод прямого определения;
––расчетно-весовой метод.
| Дозированная лекарственная форма | Тип | Подтип | Доза и соотношение активного вещества | |||
| ≥ 25 мг и ≥ 25 % | < 25 мг или < 25 % | |||||
| Капсулы
| Твердые | РВМ | МПО | |||
| Мягкие | Суспензии, эмульсии, гели | МПО | МПО | |||
| Растворы | РВМ | РВМ | ||||
Метод прямого определения однородности дозированных единиц основывается на количественном определении индивидуального содержания активного вещества (или активных веществ) в дозированных единицах лекарственного средства с целью выяснения, находится ли это содержание внутри установленных пределов. Метод прямого определения может применяться во всех случаях.
Расчетно-весовой метод определения применим для следующих дозированных лекарственных форм:
растворы в мягких капсулах;
твердые капсулы, таблетки без оболочки или покрытые пленочной оболочкой, содержащие 25 мг или более активного вещества, составляющего 25 % или более массы дозированной единицы или массы содержимого твердой капсулы, за исключением того, что однородность содержания других активных веществ, присутствующих в меньших количествах, контролируется методом прямого определения.
Метод прямого определения ОДЕ является обязательным для всех дозированных форм, для которых неприменим расчетно-весовой метод. И наоборот, для лекарственных средств с пороговым пределом ниже 25 мг / 25 % допускается определение ОДЕ при помощи расчетно-весового метода вместо метода прямого определения в том случае, когда относительное стандартное отклонение (RSD) концентраций (м/м или м/об) активного вещества в конечных дозированных единицах не превышает 2 %. Концентрация активного вещества в единице дозированного лекарственного средства равняется результату количественного определения активного вещества в единице дозированного средства, деленному на массу индивидуальной дозированной единицы. Расчетная формула RSD приведена в таблице 2.9.40.-2.
|
|
|
МЕТОД ПРЯМОГО ОПРЕДЕЛЕНИЯ
Отбирают не менее 30 единиц лекарственного средства и проводят определение, как указано для данной дозированной формы. Если используются разные методики для количественного определения и испытания однородности содержимого, вводят корректирующий коэффициент, который применяют к конечным результатам.
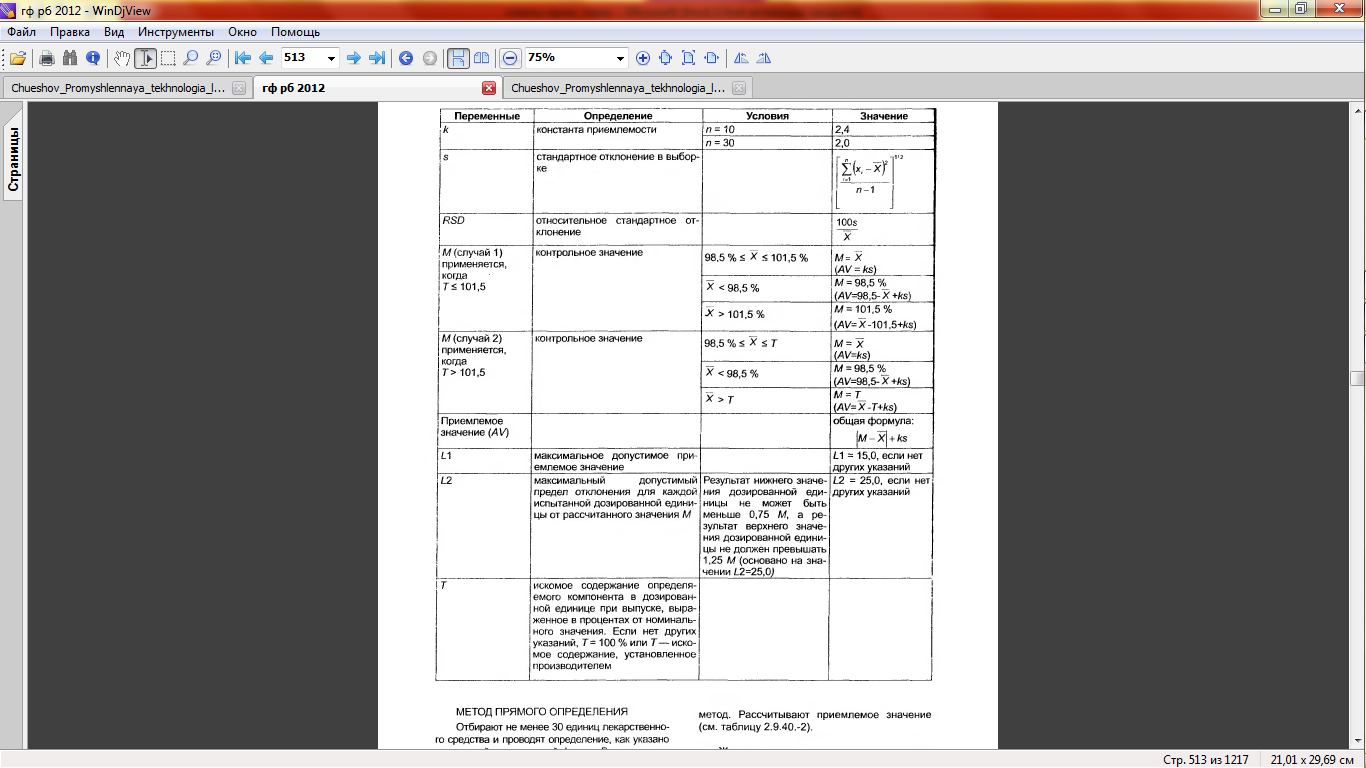
Твердые дозированные формы. В каждой из 10 отобранных единиц определяют количественное содержание активного вещества, используя подходящий аналитический метод. Рассчитывают приемлемое значение (см. таблицу 2.9.40.-2).
Расчет приемлемого значения. Приемлемое значение (AV) рассчитывают по формуле:
|
|
|
|M- 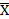 | +ks
| +ks
Расшифровка значений приведена в таблице 2.9.40.-2.
РАСЧЕТНО-ВЕСОВОЙ МЕТОД
Количественное определение активного вещества (или активных веществ) проводят на репрезентативном образце серии, используя подходящий аналитический метод. Получают значение А, выраженное в процентах от номинального содержания (см. «Расчет приемлемого значения»). Допускают, что концентрация (масса активного вещества на массу дозированной единицы) одинаковая для всех дозированных единиц. Отбирают не менее 30 дозированных единиц и проводят определение, как указано для каждой дозированной лекарственной формы.
Твердые капсулы. Точно взвешивают каждую из 10 отобранных капсул, тщательно следя за их целостностью. Извлекают подходящим способом содержимое каждой капсулы. Точно взвешивают каждую пустую капсулу и рассчитывают для каждой капсулы чистую массу содержимого путем вычитания массы оболочки из общей массы соответствующей капсулы. Рассчитывают содержание активного вещества в каждой капсуле, исходя из извлеченной из капсулы индивидуальной массы и результата количественного определения. Рассчитывают приемлемое значение.
Мягкие капсулы. Точно взвешивают каждую из 10 отобранных неповрежденных капсул, тщательно следя за их целостностью. Разрезают капсулы при помощи подходящего сухого и чистого режущего инструмента, например, ножниц или скальпеля, и извлекают содержимое из капсулы. Промывают пустую капсулу подходящим растворителем. Дают возможность растворителю испариться при комнатной температуре с поверхности оболочек в течение приблизительно 30 мин, приняв меры по предотвращению поглощения или потери влаги. По отдельности взвешивают каждую оболочку и рассчитывают массу содержимого в каждой капсуле. Рассчитывают содержание активного вещества в каждой капсуле, исходя из извлеченной из капсулы индивидуальной массы и результата количественного определения. Рассчитывают приемлемое значение.
Расчет приемлемого значения. Рассчитывают приемлемое значение (AV) так, как и для метода прямого определения, заменяя индивидуальное содержание в единицах на рассчитанное содержание, полученное как указано ниже.
 ,
, 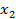 ,…,
,…, 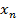 — отдельные значения содержания в испытанных дозированных единицах, где
— отдельные значения содержания в испытанных дозированных единицах, где
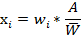
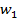 ,
, 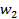 ,…,
,…, 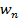 — отдельные массы испытанных дозированных единиц,
— отдельные массы испытанных дозированных единиц,
A — содержание активного вещества (процент от указанного на этикетке), полученное с использованием подходящего аналитического метода,
 — среднее значение отдельных масс (
— среднее значение отдельных масс ( 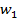 ,
, 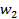 ,…,
,…, 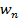 )
)
КРИТЕРИИ
Руководствуются следующими критериями, если нет других указаний в частных статьях. Твердые и жидкие дозированные формы. Требования для однородности дозирования удовлетворяются, если приемлемое значение первых 10 дозированных единиц является меньшим или равным L1. Если приемлемое значение выше, чем L1, то исследуют следующие 20 дозированных единиц и вычисляют приемлемое значение. Требования удовлетворяются, если конечное приемлемое значение 30 дозированных единиц является меньшим или равным L1, причем индивидуальное содержание дозированной единицы должно быть не менее, чем (1-L2×0,01)M и не более, чем (1+L2×0,01)M при расчете приемлемого значения по методу прямого определения или по расчетно-весовому методу. Если нет других указаний в частных статьях, то L1 равно 15,0, а L2 равно 25,0.
2.9.6. ОДНОРОДНОСТЬ СОДЕРЖАНИЯ ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА В ЕДИНИЦЕ ДОЗИРОВАННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
Однородность содержания (2.9.6). Капсулы с содержанием действующего вещества менее 2 мг или менее 2% от общей массы содержимого должны выдерживать испытание на однородность содержания действующего вещества в единице дозированного лекарственного средства (тест В), если нет других указаний в частной статье. Если лекарственное средство содержит более одного действующего вещества, это требование распространяется только на те вещества, содержание которых соответствуют выше указанным условиям.
Испытание на однородность содержания действующего вещества в единице дозированного лекарственного средства основывается на количественном определении содержания в индивидуальных однодозовых единицах лекарственного средства с целью выяснения, находится ли это содержание внутри пределов, установленных по отношению к среднему содержанию в испытуемом образце.
Данное испытание не проводится для поливитаминных лекарственных средств и для лекарственных средств, содержащих микроэлементы, если нет других указаний в частных статьях.
Метод. Используя аналитическую методику, указанную в частной статье, определяют содержание действующего вещества в каждой из 10 дозированных единиц лекарственного средства, отобранных по статистически обоснованной схеме.
Применяют критерии тестов А,В или С как указано в статье для испытуемой дозированной формы.
ТЕСТ В
Капсулы, порошки для приготовления лекарственных средств не для парентерального применения, гранулы, суппозитории, пессарии. Лекарственное средство выдерживает испытание, если содержание не более чем в одной единице выходит за пределы 85 – 115 % и ни в одной единице не выходит за пределы 75 – 125 % от среднего содержания в лекарственном средстве.
Лекарственное средство не выдерживает испытание, если содержание более чем в трех единицах выходит за пределы 85 – 115% от среднего содержания или если хотя бы в одной единице выходит за пределы 75 – 125% от среднего содержания.
Если содержание в двух или трех единицах лекарственного средства выходит за пределы 85 -115 %, но находится в пределах 75 – 125 %, определяют содержание в каждой из 20 дополнительных однодозовых единиц лекарственного средства, отобранных по статистически обоснованной схеме. Лекарственное средство выдерживает испытание, если содержание не более чем в трех из проанализированных 30 единиц выходит за пределы 85 – 115 % и ни в одной единице не выходит за пределы 75 -125% от среднего содержания.
2.9.5. ОДНОРОДНОСТЬ МАССЫ ДЛЯ ЕДИНИЦЫ ДОЗИРОВАННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
Однородность массы (2.9.5). Капсулы должны выдерживать испытание на однородность массы для единицы дозированного лекарственного средства. Испытание на однородность массы не требуется, если испытание на однородность содержания предусмотрено для всех действующих веществ.
20 единиц дозированного лекарственного средства или содержимое каждого из 20 контейнеров, в случае однодозовых лекарственных средств в индивидуальных контейнерах, отбирают по статистически обоснованной схеме, взвешивают каждую в отдельности и рассчитывают среднюю массу.
Лекарственное средство считают выдержавшим испытание, если не более двух индивидуальных масс отклоняются от средней массы на величину, превышающую значение, указанное в Таблице 2.9.5.-1. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину в два раза превышающую значение, указанное в Таблице 2.9.5.-1.
| Лекарственная форма | Средняя масса | Допустимое отклонение, % |
| Капсулы, гранулы (без покрытия, однодозовые) и порошки (однодозовые) | Менее 300 мг | 10 |
| 300 мг и более | 7,5 | |
| Если средняя масса равна 40 мг и менее, лекарственное средство подлежит испытанию на однородность содержания действующего вещества в единице дозированного средства (2.9.6). | ||
Для капсул и порошков для приготовления лекарственных средств для парентерального применения испытание проводят, как описано ниже.
# Данное испытание не проводится для поливитаминных лекарственных средств и для лекарственных средств, содержащих микроэлементы, если нет других указаний в частной статье.
КАПСУЛЫ
Взвешивают невскрытую капсулу. Затем вскрывают капсулу таким образом, чтобы не была потеряна какая-либо часть оболочки, и удаляют как можно полнее ее содержимое. В случае капсул с мягкой оболочкой промывают оболочку растворителем, указанным в частной статье, и оставляют на воздухе до удаления запаха растворителя. Затем взвешивают оболочку. По разности взвешиваний рассчитывают массу содержимого капсулы. Повторяют процедуру с другими 19 капсулами.
2.9.3. ТЕСТ «РАСТВОРЕНИЕ» ДЛЯ ТВЕРДЫХ ДОЗИРОВАННЫХ ФОРМ
Растворение. Испытание проводят для подтверждения высвобождения действующего вещества или веществ, например, одним из способов, описанных в статье «Тест «Растворение» для твердых дозированных форм» (2.9.3). Если проводится испытание по показателю «Растворение», испытание по показателю «Распадаемость» не требуется.
# Под степенью растворения твердой дозированной формы понимают количество действующего вещества, в процентах, от содержания, указанного в разделе «Состав», которое в условиях, описанных в частной статье, должно перейти в раствор.
Для проведения испытания может использоваться прибор с лопастью-мешалкой, корзинкой или, в специальных случаях, с проточной кюветой, если нет других указаний в частной статье. # Проточный прибор обычно целесообразно применять в том случае, когда действующее вещество испытуемого лекарственного средства плохо растворимо в воде и водных средах растворения.
В каждом конкретном случае применения теста «Растворение» должно быть указано следующее:
- используемый прибор; в тех случаях, когда применяется прибор с проточной кюветой, должен быть указан тип проточной кюветы (Рисунок 2.9.3.-4/5/6);
- состав, объем и температура среды растворения;
- скорость вращения или скорость протекания среды растворения;
- время, методика и объем отбираемого испытуемого раствора или условия для непрерывного контроля;
- методика анализа;
- количество или количества действующих веществ, которые должны раствориться за указанное время.
ПРИБОР
Выбор используемого прибора зависит от физико-химических характеристик дозированной формы. Все части прибора, которые могут вступать в контакт с лекарственным средством или средой растворения, должны быть химически инертны, не адсорбировать, не реагировать или каким-либо другим способом искажать результаты испытания. Все металлические части прибора, которые могут вступать в контакт с лекарственным средством или средой растворения, должны быть изготовлены из нержавеющей стали или покрыты соответствующим материалом для того, чтобы эти части не взаимодействовали или каким-либо другим способом не искажали результаты испытания. Прибор должен быть сконструирован таким образом, чтобы свести к минимуму любые колебания и вибрацию, обусловленную проточной системой или элементом, который плавно вращается. Желательно использовать прибор, который позволяет наблюдать за испытуемым лекарственным средством и мешалкой во время проведения теста «Растворение».
Прибор с лопастью-мешалкой. Прибор (см. Рисунок 2.9.3.-1) состоит из:
- цилиндрического сосуда из боросиликатного стекла или другого подходящего прозрачного материала с полусферическим дном и номинальным объемом 1000 мл; крышки, замедляющей испарение; в крышке должно быть центральное отверстие для оси мешалки и другие отверстия для термометра и устройств, используемых для отбора жидкости;
- мешалки, состоящей из вертикального вала, к концу которого прикреплена лопасть, имеющая форму части круга, отрезанного двумя параллельными хордами; лопасть должна проходить через диаметр вала таким образом, чтобы нижняя часть лопасти находилась на одном уровне с нижней частью вала; вал должен располагаться таким образом, чтобы его ось находилась на расстоянии не более 2 мм от оси сосуда, а нижняя часть лопасти была на высоте (25±2) мм от внутренней поверхности дна сосуда. Верхняя часть вала должна присоединяться к мотору, снабженному регулятором скорости; мешалка должна вращаться плавно, без заметного качания;
- водяной бани, которая поддерживает постоянную температуру среды растворения 37,0±0,50С.
Рисунок 2.9.3.-1. – Прибор с лопастью-мешалкой
Размеры указаны в миллиметрах
Прибор с корзинкой. Прибор (см. Рисунок 2.9.3.-2) состоит из:
- сосуда, идентичного описанному выше сосуду для прибора с лопастью-мешалкой;
- мешалки, состоящей из вертикального вала, к нижней части которого прикреплена цилиндрическая корзинка, которая состоит из двух частей: верхняя часть, имеющая отверстие диаметром 2 мм, должна быть приварена к валу и снабжена тремя упругими зажимами или другим подходящим приспособлением, позволяющим удалять нижнюю часть корзинки для введения испытуемого лекарственного средства и прочно удерживать нижнюю часть концентрически с осью сосуда во время вращения; нижняя часть корзинки представляет собой сваренную в виде цилиндра оболочку с узким ободком листового металла вверху и внизу; если нет других указаний в частной статье, сетка состоит из проволоки диаметром 0,254 мм, образующая квадратные отверстия площадью 0,381 мм2; корзинка с золотым покрытием толщиной 2,5 мкм может использоваться для проведения испытаний в разведенной кислотной среде; дно корзинки должно находиться на высоте 25±2 мм от внутренней поверхности дна сосуда; верхняя часть вала должна подсоединяться к мотору, снабженному регулятором скорости; мешалка должна вращаться плавно, без заметных качаний;
- водяной бани, которая поддерживает постоянную температуру среды растворения 37,0±0,50С.
Рисунок 2.9.3.-2 – Прибор с корзинкой
Размеры указаны в миллиметрах
Проточный прибор. Прибор (см. Рисунок 2.9.3.-3) состоит из:
- резервуара для среды растворения;
- насоса, который прокачивает среду растворения вверх через проточную кювету;
- проточной кюветы (см. Рисунок 2.9.3.-4/5/6) из прозрачного материала, установленную вертикально, с фильтрующей системой, предотвращающей потерю нерастворившихся частиц. Проточная кювета, представленная на Рисунке 2.9.3.-6, специально предназначена для липофильных твердых дозированных форм, таких как суппозитории и мягкие капсулы. Она состоит из трех прозрачных частей, которые вставляются друг в друга. Нижняя часть (1) сделана из двух сообщающихся камер, присоединенных к устройству переполнения.
Среда растворения проходит через камеру А и поднимается вверх. Движение потока в камере В направлено вниз, потом к маленькой капиллярной трубке, которая ведет вверх к фильтрующему устройству. Средняя часть (2) кюветы имеет полость, предназначенную для сбора липофильных вспомогательных веществ, которые всплывают в среде растворения. Металлическая решетка служит в качестве грубого фильтра. В верхней части (3) имеется место, куда помещается фильтр из бумаги, стекловолокна или целлюлозы;
- водяной бани, которая поддерживает постоянную температуру среды растворения 37±0,50С.
Рисунок 2.9.3.-3. – Проточный прибор
Среда растворения. # В качестве среды растворения могут использоваться вода Р, 0,1 М раствор кислоты хлористоводородной, фосфатные буферные растворы с рН от 6,8 до 7,6 и другие водные растворители. # Неводные растворители в средах растворения используют в исключительных случаях, и их применение требует дополнительного обоснования.
Если средой растворения является буферный раствор, его рН устанавливается с точностью до ±0,05 от указанного значения.
Перед проведением испытания из среды растворения удаляются растворенные газы, (# например, фильтрованием под вакуумом, обработкой ультразвуком, кипячением либо любым другим методом), поскольку они могут вызвать образование пузырьков, которые существенно влияют на результаты испытаний.
# Обычный объем среды растворения – 900-1000 мл, температура среды растворения – 37,0±0,50С.
МЕТОДИКА
Дата добавления: 2019-07-15; просмотров: 1408; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
