Эмульсии и суспензии для инъекций
Суспензии готовят в асептических условиях диспергированием стерильного действующего вещества в стерильном профильтрованном растворителе (вода для инъекций).
Для улучшения качества получаемой суспензии используют ультразвуковое воздействие. Это во-первых, способствует дополнительному измельчению действующего вещества в растворителе. Во-вторых, придает лекарственной форме стерильность.
Величина частиц уменьшается до 1-3 мкм и такие суспензии (эмульсии) могут быть пригодны для введения в кровяное русло.
Для повышения стабильности в технологии производства суспензий и эмульсий используют сорастворители, стабилизаторы, эмульгаторы и консерванты.
Концентраты для приготовления инъекционных лекарственных средств или инфузий представляют собой стерильные растворы, предназначенные для инъекций или инфузий после разведения. Концентраты разводят до указанного объёма соответствующей жидкостью перед применением. После разведения полученный раствор должен соответствовать требованиям, предъявляемым к инъекционным лекарственным средствам или инфузиям.
72. Порошки для приготовления инъекционных лекарственных средств или инфузионных лекарственных средств. Гели для инъекций, имплантанты и салфетки лекарственные, их характеристика.
Порошки для приготовления инъекционных лекарственных средств или инфузий - твёрдые стерильные вещества, помещенные в контейнеры, которые при встряхивании с указанным объёмом соответствующей стерильной жидкости быстро образуют или прозрачный, свободный от частиц раствор, или однородную суспензию. После растворения или суспендирования они должны соответствовать требованиям, предъявляемым к лекарственным средствам для инъекций или
|
|
|
инфузий соответственно.
Лиофилизированные лекарственные средства для парентерального применения рассматривают как порошки для приготовления инъекционных лекарственных средств или инфузий.
Гели для инъекций – это стерильные гели с вязкостью, обемпечивающей модифицированное высвобождение действующего вещества или веществ в месте инъекции.
Имплантаты
ОПРЕДЕЛЕНИЕ
Имплантаты представляют собой стерильные твёрдые лекарственные средства, имеющие подходящие для парентеральной имплантации размеры и форму и высвобождение действующего вещества или веществ в течение длительного периода времени. Они упакованы в индивидуальные стерильные контейнеры.
# Салфетки
ОПРЕДЕЛЕНИЕ
Салфетки – стерильная лекарственная форма, имеющая фиксированные геометрические размеры, предназначенная для наружного и имплантационного применения.
ПРОИЗВОДСТВО
|
|
|
Салфетки получают путем сорбции лекарственных веществ на полотне. Стерилизация салфеток осуществляется γ-лучами, что должно быть указано в частной статье.
Испытания лекарственных средств для парентерального применения: однородность дозированных единиц, однородность содержания, однородность массы, бактериальные эндотоксины – пирогенность.
Однородность дозированных единиц.Для обеспечения однородности дозированных единиц (ОДЕ) содержание действующего вещества в каждой дозированной единице в серии должно находиться в пределах узкого диапазона от номинального содержания, указанного в разделе «Состав». Дозированными единицами называют дозированные формы, содержащие единицу дозы или часть дозы действующего вещества в каждой единице дозированного лекарственного средства.
Термин «Однородность дозированных единиц» определяется как степень однородности распределения действующего вещества в дозированных единицах. Однако если нет других указаний в Фармакопее, требования данной статьи распространяются на каждое действующее вещество, входящее в состав дозированных единиц лекарственного средства, содержащих одно или несколько активных веществ.
|
|
|
Для определения ОДЕ следует применять один из двух методов: метод прямого определения или расчетно-весовой метод.
Метод прямогo определения однородности дозированных единиц основывается на количественном определении индивидуального содержания действующего вещества (или действующих веществ) в испытуемых дозированных единицах лекарственного средства с целью выяснения, находится ли это содержание внутри установленных пределов. Метод прямогo определения может применяться во всех случаях.
Для такой дозированной лекарственной формы, как раствор в однодозовом контейнере также применим расчетно-весовой метод.
Метод прямого определения. По статистически обоснованной схеме отбирают не менее 30 единиц лекарственного средства и проводят определение, как указано для данной дозированной формы. В каждой из 10 отобранных единиц определяют количественное содержание активного вещества, используя подходящий аналитический метод. Количественное определение проводят из хорошо перемешанного материала, взятого из индивидуального контейнера в условиях обычного использования. Результаты выражают на выходную дозу. Рассчитывают приемлемое значение (АV) по формуле:
|
|
|
|М-Ẋ|+ks;
где: М-контрольное значение;
Ẋ-среднее значение выборки, выраженное в процентах от номинального значения;
k-константа приемлемости;
s-стандартное отклонение выборки.
Расчётно-весовой метод. Количественное определение действующего вещества (или действующих веществ) проводят на репрезентативном образце серии, используя подходящий аналитический метод. Получают значение А, выраженное в процентах от номинального содержания. Допускают, что концентрация (масса действующего вещества на массу дозированной единицы) одинаковая для всех дозированных единиц. Отбирают не менее 30 дозированных единиц и проводят определение, как указано для каждой дозированной лекарственной формы.
Точно взвешивают количество жидкости, извлеченное из 10 отобранных индивидуальных контейнеров в условиях обычного использования. Если необходимо, рассчитывают эквивалентный объём после определения плотности. Рассчитывают содержание действующего вещества в каждом контейнере, исходя из изъятой из контейнера индивидуальной массы и результатов количественного определения. Рассчитывают приемлемое значение (АV). Его рассчитывают как и для метода прямого определения, заменяя индивидуальное содержание в единицах на рассчитанное содержание, полученное, как указано ниже.
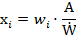
где: х1, х2… хn – отдельные значения содержания в испытанных дозированных единицах;
w1, w2… wn – отдельные массы испытанных дозированных единиц;
А – содержание действующего вещества, полученное с использованием подходящего аналитического метода;
Ẇ – среднее значение отдельных масс.
Критерии
Руководствуются следующими критериями, если нет других указаний в частных статьях. Требования для однородности дозирования удовлетворяются, если приемлемое значение первых 10 дозированных единиц является меньшим или равным L1 %. Если приемлемое значение выше, чем L1 %, то исследуют следующие 20 дозированных единиц и вычисляют приемлемое значение. Требования удовлетворяются, если конечное приемлемое значение 30 дозированных единиц является меньшим или равным L1 %, причем индивидуальное содержание дозированной единицы должно быть не менее чем (1-L2 · 0,01) M и не более чем (1+L2 · 0,01) M при расчете приемлемого значения по методу прямогo определения или по расчетно-весовому методу. Если нет других указаний в частных статьях, то L1 равно 15,0, а L2 равно 25,0.
Однородность содержания
• Испытание на ОСДВ основывается на количественном определении содержания ДВ в индивидуальных однодозовых единицах лекарственных средств с цепью выяснения, находится ли это содержание внутри пределов, установленных по отношению к среднему содержанию в испытуемом образце
• Используя аналитическую методику, указанную в частной статье, определяют содержание действующего вещества в каждой из 10 дозированных единиц лекарственных средств, отобранных по статистически обоснованной схеме,
• Применяют критерии тестов А, В или С.
ТЕСТ А
• Таблетки, порошки для приготовления лекарственных средств для парентерального применения, глазные вставки, суспензии для инъекций.
• Лекарственное средство выдерживает испытание, если содержание в каждой его однодозовой единице находится в пределах 85-115 % от среднего содержания,
• Лекарственное средство не выдерживает испытание, если содержание более чем в одной единице выходит за вышеуказанные пределы или если содержание хотя бы в одной единице выходит за пределы 75-125 % от среднего содержания.
• Если содержание в одной единице лекарственного средства выходит за пределы 1 85-115 %, но находится в пределах 75-125 %, определяют содержание в каждой из 20 дополнительных однодозовых единиц ЛС, отобранных по статистически обоснованной схеме.
• Лекарственное средство выдерживает испытание, если содержание не более чем в одной из проанали-зированных 30 единиц выходит за пределы 85-115 % и не в одной единице не выходит за пределы 75-125 % от среднего содержания.
Однородность массы
20 единиц дозированного лекарственного средства или содержимое каждого из 20 контейнеров (в случае однодозовых лекарственных средств в индивидуальных контейнерах) отбирают по статистически обоснованной схеме, взвешивают каждую в отдельности и рассчитывают среднюю арифметическую массу.
Лекарственное средство считают выдержавшим испытание, если не более двух индивидуальных масс отклоняются от средней массы на величину, превышающую данное значение
При этом не одна индивидуальная масса не должна отклоняться от средней массы на величину в два раза превышающую данное значение
Бактериальные эндотоксины - пирогенность.ЛАЛ-тест.
Испытание на бактериальные эндотоксины (ИБЭ) проводят для определения наличия или количества эндотоксинов, источником которых являются грамотрицательные бактерии, с использованием лизата амебоцитов мечехвоста.
· В настоящем разделе описаны следующие шесть методов:
· Метод А. Гель-тромб метод: предельное испытание.
· Метод В. Гель-тромб метод: количественное испытание.
· Метод С. Турбидиметрический кинетический метод.
· Метод D. Хромогенный кинетический метод.
· Метод Е. Хромогенный метод конечной точки.
· Метод F. Турбидиметрический метод конечной точки.
Испытание выполняют любым из этих шести методов.
В сомнительных и спорных случаях окончательное решение принимают, основываясь на методе А, если иное не предписано в частной статье. Испытание выполняют в условиях, не допускающих загрязнения посторонними эндотоксинами.
Пирогенность. Биологический метод.Испытание состоит в измерении роста температуры тела, вызванного у кроликов внутривенным введением стерильного раствора испытуемого образца.
Выбор животных. Используют здоровых взрослых кроликов обоего пола массой не менее 1,5 кг, получавших полноценное сбалансированное питание, не включающее антибиотиков, масса тела которых не снижалась в течение недели, предшествующей испытанию. Кролика не следует использовать в испытании на пирогeннocть, если:
а) он использовался в аналогичном испытании, давшем отрицательный результат, в течение предшествующих 3 дней;
b) он использовался в аналогичном испытании, в котором испытуемая субстанция была признана несоответствующей требованиям, в течение предшествующих 3 недель.
Предварительное испытание.
После отбора животных за 1-3 дня до проведения испытания продукции тем из них, которые не использовались для опытов в течение последних двух недель, вводят внутривенно апирогенный раствор 9 г/л натрия хлорида Р, нагретый до температуры около 38,5оС, в количестве 10 мл на килограмм массы тела. Записывают температуру животных, начиная не менее чем за 90 мин до введения и продолжая в течение 3 ч после введения раствора. Животные, температура которых колеблется в пределах более 0,6оС, не используются в основном испытании.
Основное испытание. Испытание проводят с использованием группы из трех кроликов.
Подготовка и введение продукта. Испытуемую жидкость перед введением нагревают до температуры около 38,5оС. Испытуемый продукт может быть растворен или разведен в апирогенном растворе 9 г/л хлорида натрия Р или другом растворителе, указанном в частной статье. Раствор медленно вводят в крайнюю вену уха каждого из кроликов в течение не более 4 мин, если в частной статье нет других указаний. Количество вводимого продукта варьируется в зависимости от испытуемого продукта и указывается в частной статье. Вводимый объем должен составлять не менее 0,5 мл и не более 10 мл на 1 кг массы тела.
Определение исходной и максимальной температуры. За «исходную температуру» каждого из кроликов принимают среднее из двух значений температуры, записанных для данного кролика с интервалом 30 мин в течение 40 мин, предшествующих введению испытуемого продукта. «Максимальная температура» каждого из кроликов — самая высокая температура, записанная для данною кролика в течение 3 ч после введения. Температуру каждого из кроликов записывают с интервалами, не превышающими 30 мин, начиная не менее чем за 90 мин до введения испытуемого продукта и продолжая в течение 3 ч после введения. За результат испытания принимают разность между максимальной и исходной температурами каждого из кроликов. При отрицательной разности результат принимают равным нулю.
При определении исходной температуры кролики, у которых два последовательных значения температуры варьируются в пределах, превышающих 0,2оС изымаются из испытания.
В каждом из испытаний используют животных, исходная температура которых отличается друг от друга не более чем на 1оС. Кролики, исходная температура которых выше 39,8оС или ниже 38,0оС, изымаются из испытания.
Интерпретация результатов. После проведения испытания на группе из трех кроликов его при необходимости повторяют на других группах из трех кроликов (суммарно до четырех групп, в зависимости от полученных результатов). Если суммированный результат, полученный в первой группе, не превышает значение, данное во второй колонке таблицы 2.6.8.-1, считают, что продукт выдерживает испытание. Если суммированный результат превышает значение, данное во второй колонке таблицы, но не превышает значение, данное в третьей колонке таблицы, испытание повторяют, как указано выше.
Если суммированный результат превышает значение, данное в третьей колонке таблицы, считают, что продукт не выдерживает испытание.
Таблица 6. Интерпретация результатов теста пирогенность
| Количество кроликов | Продукт выдерживает испытание, если суммированный результат не превышает: (оС) | Продукт не выдерживает испытание, если суммированный результат превышает: (оС) |
| 3 | 1,15 | 2,65 |
| 6 | 2,80 | 4,30 |
| 9 | 4,45 | 5,95 |
| 12 | 6,60 | 6,60 |
Кролики, которые использовались в проведении испытаний на пирогенность, в случае если повышение их температуры составило 1,2оС, исключаются из дальнейших испытаний.
Характеристика и влияние на организм человека бактериальных эндотоксинов-пирогенов. Источники пирогенных веществ в стерильных и асептически приготавливаемых лекарственных формах. Биологические испытания для инъекционных лекарственных средств: пирогенность, аномальная токсичность, бактериальные эндотоксины.
Пирогенными (жаронесущими) веществами называют такие вещества, которые, попадая в организм извне или образуясь внутри него, вызывают лихорадку. По происхождению пирогены делят на экзогенные (бактериальные, небактериальные) и эндогенные (лейкоцитарные), а по механизму действия на первичные и вторичные.
Инъекционные препараты, глазные капли и мази, препараты для новорожденных должны быть стерильными. В ряде случаев инъекционные средства, оставаясь стерильными, обладают пирогенными свойствами. Пирогенная реакция организма человека, возникающая за счет применения лекарств, характеризуется повышением температуры, вазомоторными расстройствами, в тяжелых случаях – шоковым состоянием. Пирогенные вещества (пирогены), представляющие собой эндотоксины (преимущественно грамотрицательных бактерий), не инактивируются при кипячении, для их разрушения необходимо автоклавирование в течение 3 ч.
Причиной пирогенности лекарственных препаратов (появление эндотоксинов и вследствие – пирогенности) являются микробное загрязнение дистиллированной воды, нарушения асептики технологического процесса, увеличение времени между приготовлением раствора и стерилизацией.
Бактериальные эндотоксины, пирогенность см. 73.
Аномальная токсичность.
Испытание проводят на здоровых белых мышах обоего пола массой 19-21 г, на которых ранее не проводили никаких испытаний.
За 24 часа до испытания и во время его проведения животные должны находиться в помещении с постоянной температурой. За 2 часа до взвешивания и отбора животных для проведения испытания у них отбирается корм и вода.
Каждой из пяти здоровых мышей вводят внутривенно предписанное в частной статье количество субстанции, растворенное в 0,5 мл воды для инъекций или стерильного раствора хлорида натрия концентрацией 9 г/л. Если не предписано иное, раствор вводят в течение 15-30 секунд. Инъекция производится в хвостовую вену мыши. Считают, что субстанция выдерживает испытание, если ни одна из мышей не погибает в течение 24 часов или времени, указанного в частной статье. Если погибает более одного животного, считают, что субстанция не выдерживает испытание. Если погибает одно животное, испытание повторяют. Считают, что препарат выдерживает испытание, если ни одна из мышей второй группы не погибает в течение указанного промежутка времени.
В случае гибели одной мыши опыт повторяют на 5 мышах; в случае гибели при первоначальном испытании двух мышей повторное испытание проводят на 15 животных. Если при повторном испытании ни одна мышь не погибнет, т.е. суммарная гибель животных в двух опытах не превысит 10%, препарат считается выдержавшим испытание. В противном случае препарат бракуют.
Контейнеры стеклянные и полимерные для стерильных лекарственных средств, требования и классы стекла. Проверка качества стеклянных контейнеров. Испытание на гидролитическую и термическую устойчивость, фиксируемость укупорочных средств и их герметичность.
Контейнер для фармацевтического использования
Представляет собой изделие, которое содержит продукцию или предназначен для ее хранения находится или может находится в непосредственном контакте с ней. Укупорочное средство является частью контейнера.
Однодозовый контейнер - контейнер, который содержит количество лекарственного средства,соответствующее полностью или по частям дозе для одноразового применения.
Мультидозовый контейнер который содержит количество лекарственного средства, соответствующее двум или более дозам.
Плотно укупоренный контейнер - контейнер, который защищает содержимое от загрязнения из вне твердыми веществами и жидкостями, а также от потери компонентов в обычных условиях, при применении, хранении и транспортировке.
Воздухонепроницаемый контейнер - контейнер, который непроницаем для твердых веществ, жидкостей, газов в обычных условиях при применении, хранении, транспортировке.
Запаянный контейнер (или герметично укупоренный контейнер) - контейнер, укупоренный с помощью расплавления материала контейнера.
Контейнер с контролем первого вскрытия - укупоренный контейнер, обеспеченный приспособлением для контроля его первого вскрытия.
Стеклянные контейнеры. Для фармацевтического использования - изделия из стекла, которые непосредственно контактируют с лекарственными средствами.
Ампулы – тонкостенные стеклянные контейнеры, которые после заполнения укупоривают запаивая стекло.
Объемы:
1 мл
2 мл
5 мл
10 мл
20 мл
Флаконы, пузырьки, шприцы, карпулы, катриджи
Более или менее толстостенные контейнеры с пробками из стекла или другого материала (пластмассы, эластомеров), содержимое которых может быть изъято за один или несколько раз.
Контейнеры предназначенные для человеческой крови и ее компонентов - более или менее толстостенные цилиндрические контейнеры различной емкости из бесцветного прозрачного нейтрального стекла.
Бесцветное стекло имеет высокою светопроницаемость видимой части спектра.
Цветное стекло получают добавлением небольших количеств оксидов металлов, выбранных согласно желаемым спектральным характеристикам.
Нейтральное стекло представляет собой боросиликатное стекло, содержащее значительные количества бора оксида, алюминия оксида и оксидов щелочных и / или • щелочноземельных металлов. Благодаря своему составу нейтральное стекло характеризуется высокой термической и гидролитической устойчивостью
Натрий - кальциевое силикатное стекло - стекло на основе кремния окейда, содержащее оксиды щелочных металлов, главным образом оксид натрия, и оксиды щелочноземельных металлов, главным образом оксид кальция. Благодаря своему составу силикатное стекло характеризуется только средней гидролитической устойчивостью.
Гидролитическая стабильности стеклянных контейнеров для фармацевтического использования выражается устойчивостью к выделению растворимых минеральных веществ в воду в предписанных условиях при контакте внутренней поверхности контейнера или порошкообразного стекла с водой.
Гидролитическая устойчивость оценивается титрованием выделившейся щелочи.
В зависимости от гидролитической устойчивости стеклянные контейнеры классифицируют следующим образом
контейнеры из стекла класса I.
Изготовлены из нейтрального стекла имеют высокую гидролитическую устойчивость благодаря химическому составу самого стекла;
контейнеры из стекла класс II.
Изготовлены обычно из натрий - кальциевого силикатного стекла и имеют высокую гидролитическую устойчивость благодаря специальной обработки поверхности;
контейнеры из стекла класс III.
Изготовлены обычно из натрий кальциевого силикатного стекла и имеют среднюю гидролитическую устойчивость.
Контейнеры из стекла класса I пригодны для хранения большинства лекарственных средств, • предназначенных для парентерального и непарентерального применения,
Контейнеры из стекла класса II пригодны для хранения в основном кислых и нейтральных водных растворов для парентерального и непарентерального применения.
Контейнеры из стекла класса III пригодны для хранения неводных растворов и порошков (за исключением лиофилизированных) для парентерального применения, а также для лекарственных средств для непарентерального применения.
Рекомендуется, чтобы все стеклянные контейнеры для жидких лекарственных средств и порошков для приготовления растворов для парентерального применения позволяли проводить визуальный контроль их содержимого.
Испытания на гидролитическую устойчивость проводился для определении класса стекла и для контроля его гидролитической устойчивости.
Кроме этого, для контейнеров для водных лекарственных средств для парентерального применения проводят испытания на мышьяк, а для цветных стеклянных контейнеров - на спектральное пропускание.
Таблица 1 Типы стеклянных контейнеров
| Тип контейнера | Проводимые испытания |
| Контейнеры из стекла класса I и класса II (для отличия от контейнеров из стекала III) | Испытание А (поверхностная ГУ) |
| Контейнеры из стекла класса I (для отличия от контейнеров из стекала класса II и класса III) | Испытание В (ГУ измельченного в порошок стекла) или испытание С (проверки наличия специальной обработки поверхности) |
| Контейнеры из стекла класса I и класса II в случае определения, чем вызвана высокая ГУ: химическим составом стекла или специальной обработкой поверхности | Испытание А и В или испытание А и С |
Испытания проводят путем титрования растворов, полученных как указано в испытаниях А, В и С.
А. Испытание на поверхностную гидролитическую устойчивость.
Определение проводится на контейнерах, не используемых ранее. Количество испытуемых контейнеров и необходимый объем жидкости для конечного испытания указаны в таблице 2.
объем жидкости и количество титрований
| Объем наполнения | Количество титрований | Объем испытуемой жидкости для одного титрования |
| До 3 | 1 | 25,0 |
| 3-30 | 2 | 50,0 |
| 30-100 | 3 | 100,0 |
| Свыше 100 | 4 | 100,0 |
Очистка. Очищают контейнеры от посторонних частиц и осколков. Незадолго до проведения испытания контейнеры ополаскивают не менее двух раз водой Р и оставляют. Непосредственно перед проведением испытания контейнеры опустошают, ополаскивают Один раз водой P, затем один раз водой Р1 и оставляют до высыхания. Полная процедура очистки от первого ополаскивания не должна длиться меньше 20 мин и больше 25 мин.
Укупоренные ампулы нагревают на водяной бане или сушильном шкафу при температуре около 50°С в течение 2 мин; дополнительное ополаскивание перед испытанием не допускается.
Наполнение и нагревание. Контейнеры заполняют водой P1 до достижения объема наполнения. Контейнеры в форме картриджей или предварительно заполненных шприцев укупоривают подходящим способом с помощью материала, не оказывающего влияние на проведение испытания. Все контейнеры, включая ампулы, должны быть неплотно прикрыты инертным материалом, таким как, например, чашка из нейтрального стекла или алюминиевая фольга, предварительно промытые водой Р. Контейнеры помещают на поддон автоклава и затем в авто-
клав, содержащий такое количество воды Р, чтобы поддон с ней не соприкасался.
Закрывают автоклав и выполняют последовательно следующие операции:
нагревают автоклав до температуры 100°С и выпускают пар через вентиль в течение 10 мин
повышают температуру от 100°С до 12 1 °С в течение 20 мин;
поддерживают температуру на уровне (121:1)°C в течение 60 мин;
снижают температуру от 121 °С до 100°С в течение 40 мин, не допуская образования вакуума;
автоклав не открывают до тех пор, пока температура не снизится до 95° С:
вынимает контейнеры из автоклава, соблюдая обычные меры предосторожности, помещают их в водяную баню при температуре 80°С и пропускают через нее холодную проточную воду, обращая внимание на то, чтобы вода не контактировала с неплотно прикрывающим колпачком и не загрязняла экстракционный раствор в контейнерах;
время охлаждения не должно превышать 30 мин.
Объем наполнения - это объем воды. которой наполняют контейнер для проведения испытания. Для пузырьков и флаконов объем наполнения составляет 90% от объема наполнения до краев контейнера. Для ампул это объем до высоты плеча.
Экстракционный раствор титруют в соответствии с методикой, описанной ниже.
титрование выполняют в течение 1 ч после извлечения контейнеров из автоклава. Объединяют жидкости из контейнеров и перемешивают. В коническую колбу помешают необходимый объем жидкости (таблица 2). В другую идентичную колбу помещают такой же объем воды P1 (контрольный раствор). Добавляют в каждую колбу по 0,05 мл раствора метилового красного Р на каждые 25 мл жидкости. Титруют контрольный раствор 0,01 M раствором кислоты хлористоводородной. Испытуемую жидкость также титруют 0,01 M раствором кислоты хлористоводородной до тех пор, пока цвет раствора не станет аналогичен цвету, полученному в контрольном опыте. Находят разность объемов титранта, израсходованных на титрование испытуемой жидкости и контрольного раствора и выражают ее в миллилитрах 0,01 М раствора кислоты хлористоводородной на IOO мл.
Значение объема, затраченного на титрование, в количестве менее l мл выражают с точностью до сотых, a в количестве 1,0 мл и более - до десятых.
Пределы. Результаты не должны превышать значений, приведенных в таблице 3.

Дата добавления: 2019-07-15; просмотров: 352; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
