Сосудистые изменения в очаге воспаления.
Фазы:
1. Первая кратковременная реакция- это ишемия сосудов (от 3-5 сек.до нескольких минут). Артериолы и венулы сужаются, число функционирующих капилляров уменьшается, кровоток замедляется. Ишемия имеет смешанный нейро-гуморальный механизм. В ее развитии участвуют эндотелины, катехоламины, лейкотриены, освобождаемые поврежденными при альтерации ТЦ и эндотелием. Также участвует рефлекторное повышение тонуса вазоконстрикторов и снижение активности вазодилататоров сосудов. Защитное значение ишемии- это уменьшить кровопотерю. Она кратковременная за счет быстрой инактивации катехоламинов и лейкотриенов под влиянием моноаминооксидазы и арилсульфатазы.
2. Артериальная гиперемия. Начинается с массированного расширения артериол и венул. Возрастает число функционирующих капилляров, объемная и линейная скорость кровотока, увеличивается лимфообразование и лимфоотток. Повышается парциальное давление кислорода в тканях. Повышенное содержание окисленного гемоглобина в оттекающей крови и увеличение числа функционирующих капилляров обусловливают классический признак воспаления- красноту (rubоr). Это влезет за собой увеличение скорости рассеивания тепла воспалительной тканью. Активация метаболизма (особенно в фагоцитирующих клетках), при этом теплопродукция возрастает, приводит к локальному повышению температуры над очагом воспаления (calor). Местная гипертермия сильно выражена при воспалении покровов тела, скелетных мышц, но не внутренних органов, т.к. они имеют и так высокую базальную температуру.
3. Транссудация- увеличение выхода жидкой составляющей плазмы из сосуда под воздействием повышенного местного гидростатического давления в артериолах и на артериальном конце капилляров. Происходит ультрафильтрация плазмы и белка (в основном альбумина). Транссудат не содержит фибрина, конц белка до 2%, удельная платность 1,012.
3 механизма артериальной гиперемии:
1. Нейротонический (происходит аксон-рефлекторное возбуждение вазодилататоров «няшка-стесняшка»)
2. Нейропаралитический (например, при обморожении)
3. Миопаралитический (при неспособности сосудов отвечать на вазоконстрикторную нервную импульсацию- «тахофилаксия сосудов»)
Явление функционального отключения иннервации сосудов при воспалении: если вызвать на одном из ушек кролика воспаление, а затем раздражать шейные симпатические нервы, то вазоконстрикция будет только на неповрежденной стороне. (Н.Н.Аничков)
После артериальной гиперемии идет смешанная гиперемия, а потом венозная. При смешанной- происходит экстравазация жидкости и формируется краевое стояние лейкоцитов, медиаторы воспаления изменяют поверхностные свойства и форму клеток эндотелия. При венозной происходит замедление кровотока (ограничением венозного оттока), расширение капилляров и венул, нарастанием в них гидростатического давления, диаметр артериол нормализуется, понижается парциальное давление кислорода в очаге воспаления. Участок повреждения- багрово-синюшного цвета. Внесосудистые процессы: эмиграция лейкоцитов, хемотаксис и фагоцитоз максимальны. Предстатические изменения- это толчкообразные и маятникообразные движения крови. Процесс заканчивается стазом. Во время стаза диапедез иммунных клеток затрудняется
Факторы, затрудняющие кровоток:
· Внутрисосудистые:
1. ЛЦ участвуют в маргинации и образовании белого тромба (+свертывающие факторы и противосвертыващие, например III фактор свертывания и плазминоген).
2. ТЦ подвергаются адгезии и агрегации, они основа белых тромбов.
3. ЭЦ претерпевают «сладж-феномен»- глобулины адсорбируются на ЭЦ, снижают их поверхностный потенциал. Увеличивается СОЭ, нарушается реология крови, ток крови- зернистный, образуются монетные столбики- агрегация ЭЦ. Они причина микроэмболов.
4. Фибринообразование в кровеносных и лимфатических сосудах, увеличение клейких свойств эндотелиоцитов и форменных элементов.
5. Эндотелиоциты набухают и округляются.
· Внесосудистые:
1. Сдавление венул и лимфатических сосудов отечной жидкостью => уменьшается ее отток, отсюда см. старлинговское равновесие
2. Наружение протеазами и гликозидазами десмосом и околососудистой соединительной ткани.
3. Повышение тонуса вен под влиянием гистамина, кининов и серотонина.
В итоге венозная гиперемия и стаз блокируют всасывание тканевой жидкости из очага воспаления и обеспечивают барьерность воспаления.
Полипептидные медиаторы.
Большинство есть в неактивной форме до начала воспаления.
Группы:
1. Контактная система плазмы крови. Компоненты системы- протеазы: комплемент, свертывающая система, система фибринолиза и кининовая система. Работают по каскадному принципу. Источник: белки макрофагального происхождения. Основа системы состоит из 4 белков:
· Фактор Хагемана (7 фактор всертывания)
· Высокомолекулярный кининоген
· Плазменный прекалликреин
· 11 фактор свертывания
Их взаимосвязь ведет к активации ступенчатого протеолиза, хемотаксису гранулоцитов.
ВМК — высокомолекулярный кининоген;
ППК — плазменный прекалликреин;
2. Лейкокинины
3. Цитокины (ИЛ-1, ИЛ-6, ИЛ-8, интерфероны, фактор некроза опухолей).
4. Ферменты и антиферменты (АТ)
5. Катионные неферментативные белки
6. Транспортные и распознающие белки. Это церулоплазмин (катализатор окисления КА, вит. С, фибрина, это белок острой фазы, антиоксидант, комплексный стимулятор миелопоэза), транскобаламин, трансферрин, ферритин- компоненты антиоксидантных и прооксидантных механизмов тканей.
7. Нейропептиды
8. Факторы роста.
Кининовая система- система убиквитарных коротких пептидных медиаторов, активируемая после прямого контакта фактора Хагемана ( XII ) с полианионными поверхностями.
Пептид 7а от фактора Хагемана активирует фермент прекалликреин, который переходит в калликреин и расщепляет плазмнный высокомолекулярный кининоген (ВК) с образованием брадикинина. Такие же реакции приводят к появлению каллидина из аналога ВК
Калликреин превращает плазминоген в плазмин. Кинины образуются в крови и секретируются слюнными железами. Кинины- коротокоживущие медиаторы, расщепляются карбоксипептидазой N. играют роль местных аутокоидов. Кинины- медиаторы артериальной гиперемии. При воспалении их много образуется. Кинины- блокаторы двигательных аксонов вазомоторных нейронов и индукторы экспрессии эндотелиальных клейких молекул. Они формируют воспалительную геперемию, отек и эмиграцию лейкоцитов.

Нейропептиды- синтезируются апудоцитами и сенсорными нейронами С-волокон. С-волокна- ноцирецепторы. Их раздражение гистамином, простагландином, простациклином, кининами- ведет к боли. Нейропептид вещество Р потенциирует боль. Она отвечает за проведение болевого ощущения в спинной мозг. Нейропептиды обладают альгоэргическим действием, они повышают проницаемость сосудов и потенциируют привлечение нейтрофилов в очаг.
Боль зависит от координированного действия кининов и нейропептидов.
52. Механизмы экссудации. Проницаемость сосудов при воспалении. Патогенез воспалительного отека. Виды экссудатов, их химический и морфологический состав. Хемоаттрактанты, их виды и механизмы действия. Хемотаксис, механизм, значение.
Воспаление – типовой патологический процесс, развивающийся в васкуляризованных областях в ответ на повреждение, характеризующийся комплексом местных функциональных и структурных изменений, направленных на локализацию (разведение, изоляцию, устранение) агента, вызвавшего повреждение, и на восстановление поврежденной ткани.
Экссудация всегда присутствует при воспалении (при сухом плеврите не обильный фибринозный экссудат).
При экссудации значение имеет увеличение венозного, внутрикапиллярного давления при вышеописанных сосудистых реакциях, увеличение осмотического давления тканевой жидкости + решающая роль – повышение сосудистой проницаемости.
Сосудистая проницаемость при воспалении. 3 типа динамики:
Ранняя преходящая фаза:
· Быстрое и непродолжительное увеличение проницаемости малых и средних венул
· Максимум за 5-10 минут после повреждения
· Участники: гистамин (т.к. блокируется антагонистами гистамина), брадикинин, лейкотриены, простогландины
· Механизм: расширение межклеточных промежутков за счет сокращения эндотелиоцитов, менее значителен трансцитоз
· Проницаемость понижается через 30 минут (гистамина мало, он разрушается гистаминазой, происходит понижение чувствительности его рецепторов
2) Поздняя продленная фаза:
· Через 1-2 часа после повреждения, максимум через 4-6 часов (при солнечных ожогах), при ГЗТ латентный период от 4-6 часов до 6-8 суток
· Длительность не менее 24 часов
· Повышается проницаемость капилляров и венул, происходит активация цитосклета эндотелиальных клеток
· Механизм: повышение трансцитоза, втягивание эндотелиоцитами отростков, участвующих в соединении клеток → появляются промежутки
· Участники: полипетидные медиаторы воспаления, в т.ч. цитокины макрофагального и лимфоцитарного ряда (ИЛ-1, кахексин, γ-интерферон).
3) Раннее стойкое повышение проницаемости (при значительной альтерации, e.g. тяжелые ожоги):
· Проницаемость растет на протяжении первых 30-45 минут до максимума и не снижается в течении нескольких часов, затем медленное снижение, охватывающее несколько суток.
· Затрагиваются артериолы, капилляры, венулы, наблюдается некроз, слущивание эндотелия и разрывы базальных мембран
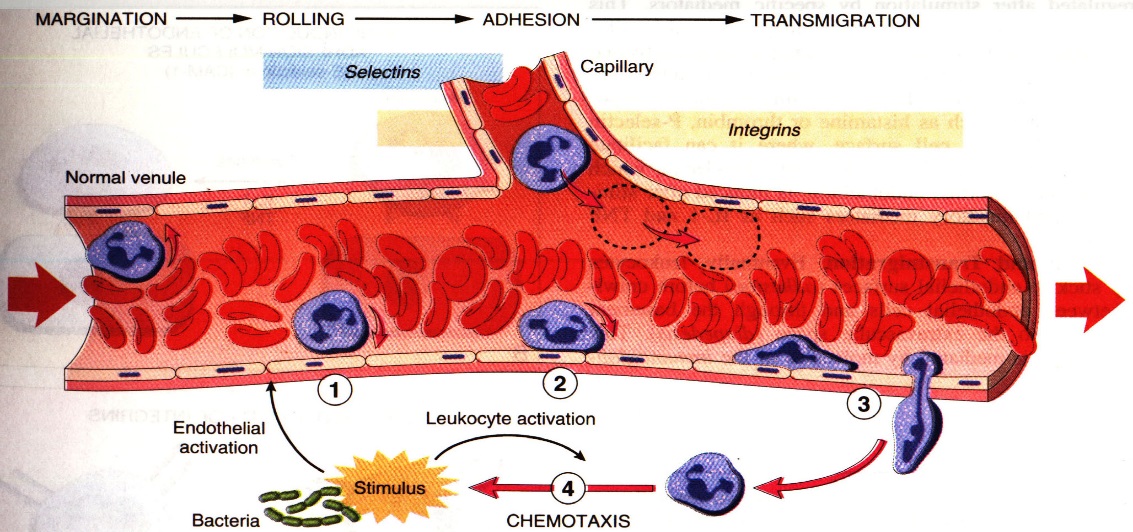 Для воспаления характерна инфильтрация ткани лейкоцитами. Лейкоцитарная инфильтрация – стадийный процесс:
Для воспаления характерна инфильтрация ткани лейкоцитами. Лейкоцитарная инфильтрация – стадийный процесс:
Краевое стояние лейкоцитов/маргинация → роллинг → адгезия → 2) трансмиграция/диапедез (явление эмпериполеза) → хемотаксис
Маргинация начинается на стадии смешанной гиперемии и далее продолжается при стазе. Полный стаз уменьшает миграцию.
Основа механизма миграции лейкоцитов – комплементраные лиганд-рецепторные взаимодействия между лейкоцитом и сосудистой стенкой, причем появления рецепторов индуцируется медиаторами воспаления (краевое стояние лейкоцитов, 40% лейкоцитов не циркулируют, обитают по ходу сосудистой стенки).
Хемотаксис – движение фагоцита по градиенту хемоаттрактантов, открыт М. Пфайфером.
Хемоаттрактанты, если они имеются на поверхности выделяющего их объекта, являются, в то же самое время, и опсонинами и опосредуют прилипание.
Хемокинез – явление ненаправленного увеличения локомоторной активности клеток под влиянием медиаторов воспаления.
Основные группы хемоаттрактантов:
· Микробы и их продукты
· Ig и имунные комплексы
· Хемокины, фрагменты комплемента и др. аутакоиды
· Внеклеточные пурины (ДНК, АТФ)
Механизм хемотаксиса: Ca2+ входит в лейкоцит через занятый рецептор хемоаттарктанта, белка гельзолина и цитосклета, причем клетка вращается вокруг максимальной желатинизации цитоплазмы как передней-приводной автомобиль (Чурилов J см. стр. 332 1 тома)
По типу экссудата воспаление делят на: а) экссудативное (в экссудате больше жидкости, механизм-ГНТ; б) продуктивное (в экссудате больше клеток, механизм – ГЗТ).
Патогенез воспалительного отека:
Флогоген → ишемия → артериальная гиперемия → смешанная гиперемия → венозная гиперемия → стаз.
Сосудистым реакциям сопутствуют: маргинация (НФ, моноциты), трансмиграция (НФ, моноциты), фагоцитарная реакция, формирование экссудата.
Повреждение эндотелия → обнажение базальной мембраны → активация F. XII → активация: коагуляции, антикоагуляции, комплемента, кининов. Собственно восалительный отек формируется как за счет экссудативного повышения сосудистой проницаемости (активация трансцитоза этими медиаторами), так и за счет транссудации (вследствие смешнной и венозной гиперемии).
Воспалительный отек – экссудативно-серозное (обязательно присутствие Na) пропитывание тканей, развивающееся на фоне активной гиперемии и характеризующееся преобладание набухания эластических, коллагеновых волокон и клеток поврежденных тканей.
Экссудативное воспаление по характеру экссудата подразделяется на:
1) Серозное (в прозрачном экссудате белка чаще 2-2,5% + небольшое количество клеток, в основном – лимфоциты). e.g. лучевой ожог
2) Гнойное (много полиморфонуклеаров, особенно нейтрофилов) e.g. гонорея
3) Фибринозное (много факторов свертывания + образуется фибрин):
a) крупозное (фибиринозная пленка отделяется от ткани, пленка на однослойном эпителии при тонкой соединительнотканной основе e.g. пневмония)
b) дифтерическое (пленка не отделяется, на многослойном или переходном эпителии при рыхлой толстой соединительнотканной основе e.g. дизентерия)
4) Гнилостное (гнойный экссудат с анаэробной флорой и продуктами ее жизнедетельности) e.g. анаэробная инфекция
5) Геморрагическое (любой экссудат с примесью эритроцитов) e.g. грипп
6) Катаральное (любой экссудат, выделяемый слизистой оболочкой и богатый секретом местных слизистых желез) e.g. астматический бронхит у детей
53. Барьерная роль воспаления (виды барьеров, процессы, участвующие в создании барьеров). Последствия нарушения барьерной функции. Понятие об информационных барьерах при воспалении. Системное действие медиаторов воспаления, его роль в патологии. Липидные медиаторы воспаления, спектр, источники, пути активации, роль при воспалении.
Очаг воспаления обособлен от организма: он имеет свой собственный обмен, концентрацию ионов водорода, свое модифицированное кровообращение.
Воспаление процесс аутохтонный (для тех кто еще не понял «заканчивается только при прохождении через все свои стадии, не прерываясь») и развивается при участии каскадного принципа, под управлением химических регуляторов, возникающих, действующих, инактивируемых в самом очаге воспаления. ( т.е. МЕСТНО)
Ряд факторов обеспечивают барьерную роль воспаления:
-замедление венозного оттока
-стаз
- фибринообразование
-лейкоцитарный вал
- формирование гранулем, капсул вокруг очага (соединительнотканной природы)
Все эти процессы ограничивают распространение возбудителей и попадание местных аутокоидов в системный кровоток.
Информационная блокада вокруг очагов двусторонняя (правило системно-местного равновесия защит). Здесь пригодится термин ортофлогоз – одномоментная штатная работа воспаления и стресса. Предотвращение системного действия медиаторов воспаления. И невозможность действия системных эндокринных стимулов на клетки-участники воспаления, так как стаз нарушает кровяной транспорт гормональных сигналов в очаг.
Аутокоиды в очаге воспаления необходимы для репаративного процесса, при системном воспалении они вводят здоровые клетки в программу воспаления. (вспомните системное действие гистамина).
Системное действие медиаторов воспаления может наступить, если суммарная поверхность очагов воспаления очень велика и барьеры не сдерживают распространение аутокоидов (обширные ожоги). Системное действие медиаторов воспаления приводит к развитию плюриорганной недостаточности, шоку.
Липидные медиаторы воспаления:
Липидные медиаторы воспаления производные арахидоновой кислоты. Повреждение мембран активирует каскад арахидоновой кислоты. Фосфолипаза А2 освобождает из фосфотидилхолина арахидоновую кислоту. Затем под действием ЦОГ образуются Pg, под действием ЛОГ –LT.


54. Репаративная стадия воспаления. Противовоспалительные медиаторы. Полисахаридные медиаторы воспаления. Спектр, источники, роль. Механизмы и регуляторы процессов пролиферации. Регенерация и фиброплазия в исходе воспаления. Роль медиаторов. Воссоздание ткани в очаге воспаления, участники и регуляторы этого процесса.
Успешный ход репаративных процессов: затухание острых альтеративных и экссудативных изменений (устранение флогогенного объекта и присутствие противовоспалительных медиаторов).
Противовоспалительные медиаторы: гепарин (структурный компонент межлеточного вещества и участие в регенерации), аденозин, хондроэтин-сульфат, апопротеин Е, ингибиторы протеаз, антиоксиданты, инактиваторы воспалительных медаторов, гистамин, фрагменты реагиновых рецепторов, полиамины, интерлейкин-10, липоксины.
Полисахаридные медиаторы – гликозамингликаны (гепарин, хондроэтинсульфаты, гепаран-сульфат). Все они вырабатываются многими клетками – это и фибробласты, и гладкомышечные элементы, и эндотелий, и макрофаги. Спектр, синтезируемый различными клетками, безусловно, отличается (допустим, для гепарина основные продуценты – базофилы, для гепарансульфата – эндотелий и т.д.). Эффекты полисахаридных медиаторов – прежде всего противовоспалительное действие (гепарин, гепаран-сульфат – сильные антикоагулянты и антиагреганты. Препятствуют тромбооразованию и фибринообразованию). Перечисленные гликозамингликаны связывают гистамин, ингибируют активность комплемента, снижают степень функционирования сторожевой полисистемы плазмы крови. Хондроэтин-сульфаты, хотя и не ингибируют свертывание и тромбообразование, более активны, чем гепариноиды, в отношении снижения сосудистой проницаемости, связывают липопротеиды, что в свою очередь способствует поставке холестерина в очаг воспаления (играет роль в атерогенезе!). Так же гликозамингликаны, взаимодействуя с коллагеном и адгезивными белками, принимают участие в самосборке ткани при фиброплазии и регенерации.
Пролиферация – фаза воспаления завершающая, обеспечивает репаративную регенерацию тканей на месте очага альтерации. Развивается пролиферация с самого начала воспаления наряду с явлениями альтерации и экссудации. При репарации в очаге фиброплазия и регенерация клеток достигаются как активацией процессов пролиферации, так и ограничением апоптоза. Размножение клеток начинается с периферии, в то время как в центре еще может по полной царствовать альтерация. Расцвет пролиферации начинается после отчистки зоны повреждения от клеточного детрита и возбудителей нейтрофилами и тканевыми макрофагами (следовательно, перед пролиферацией должны сформироваться нейтрофильный и мноцитарный барьер по периферии зоны альтерации).
Восстановление и замещение тканей начинается с выходом из сосудов фибриногена => образование фибрина, который формирует своеобразную сетку, каркас для последующего клеточного размножения. По нему фибробласты в очаге репарации и распределяются (деление, рост, их перемещение возможно только после их связывания с фибрином или коллагеновыми волокнами (связывает фибронектин). Размножение по периферии – формируется фибробластический барьер. Дальнейшая активация и пролиферация их под воздействием: 1) ФРФ (фактор роста фибробластов) 2) Цитокинов (ФНО, ИЛ-1) 3) Тромбоцитарного фактора роста 4) Кининов 5) Тромбина 6) Траснформирующего фактора роста b
В начале незрелые фибробласты не обладают достаточной синтетической активностью. Внутренняя их функционально-структурная перестройка фибробластов предшествует созреванию (гипертрофия ядра, гиперплазия ЭПС, повышение количества ферментов (эстеразы неспецифической, б-глюкуронидазы)). Только после того, как фибробласты перестроились, их милость изволит синтезировать коллаген, эластин, коллагенассоциированные белки и протеогликаны (стимуляция ФНО, ИЛ-1, ИЛ-4, фактор роста фибробластов). Начинается активная продукция кислых мукополисахаридов. Зона воспаление инкапсулируется, постепенно мигрируют клеточные и бесклеточные компоненты соединительной ткани от периферии к центру, формируется соединительнотканный остов на месте первичной и вторичной альтерации. Начинают размножаться и другие тканевые клетки. В зону альтерации мигрируют клетки эндотелия по градиенту ангиогенных факторов. Просвет новообразующихся капилляров формируют внеклеточные пространства соседних эндотелиоцитов. (тут собираются к ним все ребята, и тучные клетки, и макрофаги, и нейтрофилы, они все делятся активными веществами и капилляры дружно пролиферируют). (Ангиогенез стимулируют: 1) ФРФ 2) Сосудистый эндотелиальный фактор роста 3) Трансформирующие факторы роста b 4) Эпидермальный фактор роста.
Фибробласты + вновь образованные сосуды = грануляционная ткань (молодая соединительная ткань, богатая клетками, капиллярами). Основные функции – защита, репарация и восстановление. Но ее формирование – не строго обязательно, конечно же, все зависит от величины повреждения. Параллельно происходит эпителизация раны. (2-4 слоя базального эпителия в течении первых суток). Какие плюсы: препятствие обезвоживания, предпреждение инвации МО.
Так же в пролиферации учавствуют и органспецифические клеточные элементы органов и тканей. Все органы и ткани с точки зрения возможности пролиферации могут быть разбиты на три группы:
1) Органы и ткани, клеточные элементы которых обладают активной или практически неограниченной пролиферацией, достаточной для полного восполнения дефекта (слизистых ДП, ЖКТ, МПС, эпителий кожи, гемопоэтическая ткань).
2) Ограниченная регенерационная способность (сухожилия, связки, хрящи, кости)
3) Не способные к пролиферации (сердце, ЦНС)
Какие факторы регулируют процессы пролиферации и дифференцировки клеток в очаге воспаления: 1) ФР (эпидермиса, стимулятор ангиогенеза, синтеза коллагена, фибронектина, тромбоцитарный фактор роста, эндотелиоцитов, фибробластов кислый и основной, колониестимулирующие факторы, фактор роста нервов) 2) Пептид гена, родственного кальцитонину, стимулирует пролиферацию эндотелиальных клеток 3) Простагландины группы Е 4) Кейлоны и анликейлоны 5)Полиамины 6) Циклические нуклеотиды
55. 1Особенности этиологии и патогенеза хронического воспаления. 2Роль и судьба макрофагов при хроническом воспалении. 3Понятие о цитокинах. 4Источники, пути активации и роль цитокинов в развитии острого и хронического воспаления.
1 Острое воспаление, как аутохтонный (местный) процесс, самопроизвольно заканчивается при условии искоренения причинного агента. Но могут создаваться условия для продолжения альтерации и экссудации на фоне развернувшихся пролиферативных процессов, если: возбудитель персистирует в тканях, если причинный агент воспаления является неметаболизируемым, если процесс вызван атакой иммунной системы против конституционального аутоАГ. Создающееся сочетание волнообразных острых альтеративно-экссудативных явлений, ГЗТ и фиброплазии определяет специфику хронического воспаления. То есть хроническое воспаление протекает как череда острых на фоне репарации ткани.
Выделяют подострое воспаление – острое воспаление в ходе хронического, первично-хроническое течение – при недостаточной интенсивности иммунного ответа и регенерации.
В пат.анатомии хроническое воспаление обозначают как мононуклеарно-инфильтративное, подчеркивая ключевую роль макрофагов и лимфоцитов в патогенезе. Продолжительность хронического воспаления зависит от этиологии и локализации, нет определенного срока, после которого воспалению однозначно присваивается статус хронического. Хроническому воспалению способствуют выраженный ангиогенез и формирование в его очагах высокоэндотелиальных венул(обеспечивают миграцию лимфоцитов).
Особенности хронического воспаления:
2,3,4
· Происходит мононуклеарная инфильтрация пораженных тканей лимфоцитами и макрофагами (это особенно характерно для аутоиммунных хронических воспалений). Происходит накопление макрофагов в очаге и их длительное активное функционирование благодаря факторам, ингибирующим миграцию МФ (окисленные липиды, и пептиды, выделяемые Т-лимфоцитами). Нейтрофильная же инфильтрация не характерна для хронического воспаления, кроме случая гнойного хронического воспаления.
· МФ пролиферируют на месте воспаления. Цитокины взаимно активируют МФ и лимфоциты, создавая порочный круг, поддерживающий воспаление. Главную роль здесь играют гамма-интерферон и интерлейкин-4, активирующие МФ. МФ в свою очередь выделяют другие цитокины: фактор некроза опухолей, ИЛ-1, ИЛ-6, активирующие лимфоциты, а также способствующие их (МФ) слиянию в гигантские клетки. В основном, МФ осуществляют фагоцитоз.
· Сенсибилизированные лимфоциты претерпевают клональную пролиферацию и мигрируют в очаг воспаления, где оказывают свои эффекторные иммунные воздействия. Хроническое воспаление может сопровождаться любыми иммунопатологическими реакциями и их комбинациями (иммунокомплексные, цитотоксические, анафилактические), но наиболее характерно развитие гиперэргических реакций замедленного типа. При персестировании АГ в организме происходит хроническая аттракция и активация МФ и лимфоцитов в очагах воспаления. Морфологическим эквивалентом этих процессов (характеризуемых как продуктивное хроническое воспаление) является образование гранулем. При этом большую роль играют вышеперечисленные цитокины. Главным медиатором гранулематоза можно считать ФНО-альфа. Гранулема: казеозный некроз и гигантские клетки, вокруг МФ с персистирующими в них живыми возбудителями, перифокальное скопление активных Т-лимфоцитов.
· В очагах хронического воспаления происходит изменение структуры органов вследствие неполной регенерации, фиброплазии и некроза. Следствием этого является образование абсцессов, язв.
Цитокины – это гликопротеидные и пептидные факторы, которые производятся элементами иммунной системы и взаимодействуют с ними и соматическими клетками,
- это растворимые медиаторы иммунного ответа,
- это небольшие по размеру молекулы, не комплементарные антигенам, но их продукция часто управляется антигенами.
В ответ на повреждение всегда появляются три основных цитокина: ИЛ-1, ИЛ-8, ФНО-альфа. ИЛ-1 – в любой ядерной клетке. С ним провзаимодействуют соседние клетки и выделят ИЛ-1, ИЛ-8 и ФНО. (это со слов ВИ)
ИЛ-1, ИЛ-8 – биогенные амины, медиаторы воспаления. При ГЗТ.
Цитокины, о которых здесь шла речь:
| Источник | эффекты | |
| ИЛ-1 | МФ, кератиноциты, эндотелий, микроглия, лимфоциты, фибробласты, дендритные клетки | Провоспалительные эффекты, индукция адгезивных молекул, эндогенный пироген, главный медиатор иммунного ответа на чужеродные вещества, причина продромального синдрома, триггер ответа острой фазы, стимулятор стресса, активатор ЛФ, МФ, ФБ, запускает синтез многих цитокинов (в т.ч. ФНО, ИЛ-6, КСФ) |
| ИЛ-4 | Т-лимфоциты, мастоциты | Индуцирует пролиферацию и дифференцировку Т-хелперов2, фактор дифференцировки В-лимфоцитов, подавляет Т-хелперы1, ингибитор роста эпителиальных клеток тимуса |
| ИЛ-6 | Т- и В-лимфоциты, МФ, ФБ, эндотелий, астроциты | Дифференцировка В-лимфоцитов, индуктор ответа острой фазы, эндогенный пироген, провоспалительный эффект, стимулятор ГГНС |
| ИЛ-8 | Моноциты, МФ, ФБ, кератиноциты | Инициация ответа острой фазы и воспаления, активатор дегрануляции гранулоцитов и Т-лимфоцитов, ростовой фактор Т-лимфоцитов |
| ИФН-гамма | Т-хелперы1, НК; МФ и ФБ в ответ на ИЛ-2 | Активатор МФ, индуктор экспрессии МНС1,2, способствует презентации АГ, антагонист ИЛ-4 в действии на В-лимфоциты. Тормозит синтез цитокинов, IgE. Эндогенный пирогенный эффект. |
| ФНО-альфа | МФ, лимфоциты, астроциты | Эндогенный пироген, стимулятор ответа острой фазы, индуктор ИЛ-1, ИЛ-6, КСФ. Стимулятор апоптоза опухолевых и других клеток, кахексия. Индукция адгезинов. Стимулятор гранулематоза, ангиогенеза. |
56. Учение о фагоцитозе. Стадии фагоцитоза. Механизмы приближения и прилипания. Фагоцитоз и иммунитет. Значение фагоцитоза в воспалении. Морфогенетическая роль фагоцитоза в осуществлении запрограммированной гибели клеток. Процессинг и презентация антигенов. Что нового внесли работы Мечникова в учение о воспалении по сравнению с работами Вирхова и Конгейма? Сравнительная патология воспаления.
Фагоцитоз - захват клеткой путем рецепторного эндоцитоза при участии микрофиламентов объектов с диаметром более 1 мкм.
Модель – фагоцитоз птичьих Er в асептическом экссудате брюшной полости крысы (модель перитонита в опыте Мечникова). Причина воспаления – мясопептонный бульон (5 мл 10%, стерильный, интраперитонеально). Через 24-48 ч в брюшную полость вводят объект фагоцитоза (через 15 мин – повторно, чтобы наблюдать разные стадии на одном препарате) – Er птицы (ядерные, хорошо видны). Субъект фагоцитоза – МФ. Изучение экссудата в висячей капле и окрашенных мазках.
Защита против экзогенных агрессоров, механизм устранения состарившихся клеток, клеток с неоантигенами и апоптотических телец на протяжении морфогенеза. Тенденция применять термин «запрограммированная клеточная гибель» к процессам устранения клеток в раннем онтогенезе, а понятие апоптоз - только к программируемой гибели зрелых дифференцированных клеток. Так указывают на наличие аутофагии и отсутствие разрывов ДНК при эмбриональной клеточной гибели, в отличие от апоптоза зрелых клеток. Неправильно формируется структура при эмбриогенезе –> уничтожение.
Развитие преиммунного и иммунного ответов, устранение ИК из кровотока, утилизация материала тромбов и участие в рассасывании рубцов, устранении микроэмболов и патологических продуктов обмена при тезаурисмозах. Фагоциты реализуют цитотоксическое или бактерицидное действие и секрецию медиаторов воспаления, активацию энергетического метаболизма фагоцита (дыхательная вспышка), процессинг антигенов (расщепление АГ, вывод эпитопа в комплексе с ГКГС на наружную мембрану), их представление лимфоцитам (иммунологический синапс: Т-клеточный рецептор и ГКГС-белок с процессированным пептидом из состава АГ, белки семейства В7 и их лиганды - лимфоцитарные CD 28 и CD 152; лиганд АПК CD 40 и лимфоцитарные молекулы CD 154 , а также молекулы клеточной адгезии ICAM -1 и LFA -3 на АПК и их лимфоцитарные лиганды LFA -1 и CD 2).
Живые инфекционные возбудители способны персистировать внутри фагоцитов при незавершенном фагоцитозе - главный механизм хронического и рецидивирующего течения инфекций, путь их генерализации. Это условие протекания гиперергических реакций замедленного типа по гранулёматозному варианту. Неметаболизируемый флогоген при силикозе, асбестозе -> хроническое воспаление. Основной механизм гнойного расплавления тромба - выход жизнеспособных МО из лейкоцитов, входящих в его состав. Фагоцитоз - фактор повреждения тканей при аутоиммунных болезнях.
Макрофаги и лимфоциты в очаге хронического воспаления вырабатывают цитокины, влияющие на гипоталамо-гипофизарный нейросекреторный аппарат, и аналоги гипофизарных гормонов, поддерживая хронический стресс, который способствует длительному течению воспаления и препятствует его репарации.
Макрофагальные АПК — это клетки Лангерганса в коже, интердигитирующие клетки тимуса и лимфоузлов, фолликулярные дендритические клетки герминативных центров. Помимо фагоцитоза, они специализированы на взаимодействии с лимфоцитами, обладают экспрессией белков ГКГС не только первого, но и второго класса, осуществляют процессинг антигенов и их презентацию. Макрофаги и АПК выделяют хемоаттрактанты в ингибиторы миграции для лимфоцитов и гранулоцитов, участвующие в рекрутировании клеток в состав экссудатов и гранулём.
4 стадии фагоцитоза:
1. Приближение к объекту фагоцитоза;
2. Прилипание фагоцита к поверхности объекта (распознавание рецепторами фагоцита опсонических детерминант объекта)
3. Погружение объекта в цитоплазму фагоцита
4. Внутриклеточное переваривание (киллинг-эффект, деградация объекта).
Механизм приближения – положительный хемотаксис, либо оно случайное (у фиксированных фагоцитов). Прямая ассоциация фагоцитарного рецептора хемоаттрактанта с его лигандом обеспечивает опсонизацию — способствует прилипанию. Часть хемоаттрактантов не является опсонинами, т.к. не присутствует на поверхности мишени фагоцитоза.
Прилипание лейкоцитов к объектам фагоцитоза связано с распознаванием поверхностных детерминант мишеней рецепторами фагоцитов: опсонин+опсониновый рецептор. Некоторые объекты распознаются рецепторами экзогенных хемоаттрактантов напрямую, но большинство объектов фагоцитоза нуждается в опсонизации, которая увеличивает активность прилипания, причем эффект иммуноглобулинов и комплемента аддитивен. Индивидуальные антигены часто располагают несколькими различными эпитопами и могут возбуждать ответ нескольких клонов иммунокомпетентных клеток, в т.ч. одновременно — в разных его формах.
Нутритивная, аттракционная теория Вирхова - внимание сосредоточено на изменениях в клетках: изменения в тканях могут быть пассивными (дегенерация, некроз) и активными (прогрессивные гипертрофии, гиперплазии и регенерация). Конхайм описал сосудистые реакции: артериальную, смешанную, венозную гиперемию, стаз. Также – феномен маргинации лейкоцитов и их эмиграции из сосудистого русла. Мечников открыл фагоцитоз. Фагоциты выходят из сосудистого русла в очаг воспаления. Воспаление – защитный ТПП, т.к. фагоцитоз приводит к ликвидации флогогена. Первым применил сравнительный метод в патологии, описав сравнительную патологию воспаления: воспаление имеет место только у животных, в полном объеме проявляется начиная с рыб.
У одноклеточных сопряжены защитная и пищеварительная функции, так как одной из форм защиты, помимо удаления (отрицательный хемотаксис) и спорообразования, является внутриклеточное переваривание объекта фагоцитирующей клеткой. Появление многоклеточности -> планарии имеют специализированные клетки мезодермального происхождения, которые осуществляют защиту путем фагоцитоза. С появлением сосудистой системы к воспалению присоединяются сосудистые реакции, экссудация и эмиграция фагоцитов из просвета сосудов в ткань. С развитием нервной, эндокринной, иммунной и других систем механизмы усложняются.
57. Учение о фагоцитозе. Понятие о системе мононуклеарных фагоцитов. Особенности фагоцитоза макрофагов и нейтрофилов. Экзоцитоз. «Метаболический взрыв» фагоцитов. Механизмы погружения и переваривания. Кислородные и бескислородные бактерицидные механизмы фагоцитов. Роль антиоксидантных систем фагоцитов при воспалении. Наследственные и приобретенные расстройства фагоцитоза и их последствия.
Система мононуклеарных фагоцитов - моноциты крови и различные макрофаги (купферовские клетки печени, альвеолярные макрофаги, макрофаги соединительной ткани, клетки Лангерганса, астроциты глии, остеокласты). Все они возникают из гемопоэтической стволовой клетки и проходят ряд стадий: монобласт-промоноцит-моноцит-макрофаг.
Созревают гранулоцитарно-моноцитрарные колониеобразующие клетки-предшественники КМ под влиянием гранулоцитарно-макрофагальных колониестимулирующих факторов (ГМ-КСФ) по путям, ведущим к нейтрофилам (НФ) и эозинофилам (ЭФ) либо к моноцитам.
Очаги воспаления – мощный источник этих цитокинов, которые вырабатываются МФ или гранулоцитами…
В зависимости от последующей локализации макрофаги приобретают специфические структурные и морфологические черты. Они несут на поверхности маркеры: CD14, Fc-рецепторы для иммуноглобулинов, рецепторы для СЗ-компонента комплемента и HLA-DR антигены. CD14 молекулы связывают липополисахариды бактерий вместе с белком сыворотки крови, при активации макрофагов они сбрасываются с клетки.
Дата добавления: 2019-03-09; просмотров: 4166; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
