Значение воспаления для организма:
Воспаление – процесс, необходимый для поддержания жизни. Обеспечивается распознавание опасных местных процессов, предотвращается генерализация инфекции и сепсис, восстанавливаются тканевые дефекты. Однако механизмы воспаления обязательно причиняют тканям вторичные самоповреждения, а хроническое воспаление может привести к системным повреждениям.
Связь с иммунитетом и другими ТПП.
В развитии воспаления не последнюю роль играют сосудистые реакции: кратковременная ишемия, артериальная гиперемия, смешанная и венозная гиперемия, стаз (являются ТПП). При венозной гиперемии => гипоксия (ТПП). При попадании токсинов из очага воспаления в системный кровоток => лихорадка (ТПП).
Именно иммунные клетки (лейкоциты) эмигрируют в очаг воспаления + фагоцитоз (макро- и микрофаги) + активация плазматических клеток (нарастает количество АТ). Кроме того, возможна перестройка иммунной системы организма, что способствует развитию аллергических реакций.
Рудольф Вирхов (1859) создал первую гистологически обоснованную теорию воспаления – «нутритивно-аттракционную» теорию. Согласно нутритивной теории, воспаление вызывается раздражением клеток, которые вследствие этого начинают притягивать и накапливать питательные вещества, необходимые им для обеспечения последующей репарации повреждений, составляющей цель всего процесса. Питательные вещества формируют в клетках включения, вызывающие патоморфологическую картину клеточной дистрофии. В ходе развития воспаления они расходуются и исчезают. Клетки же набухают от усиленного питания, а затем делятся. Вирховская теория воспаления была первой, где повреждение стоит на месте пускового сигнала процесса, а репарация выступает как его цель. Наличие в клетке включений не подлежит сомнению, однако эти включения имеют сигнальное назначение (медиаторы воспаления), поэтому не представляется возможным рассмотрение воспаления, как частного вида дистрофии.
Экспериментальные модели воспаления:
Опыт 1. Модель сосудистой реакции при воспалении на брыжейке лягушки (опыт Конгейма): извлечение петли кишки из брюшной полости, подсыхание являются достаточными для повреждения и развития острого воспаления. Наблюдаем фазы артериальной, смешанной и венозной гиперемии + краевое стояние лейкоцитов.
Опыт 2. Тканевые и сосудистые изменения при воспалении на языке лягушки. Извлекается язык, край прижигается нитратом серебра (ляпис), наблюдается воспалительная реакция.
48. Медиаторы воспаления, их основные группы, источники, механизмы активации, роль на различных стадиях процесса. Понятие о противовоспалительных медиаторах. Значение работ В.Менкина и К. де Дюва в учении о воспалении. Биогенные амины как медиаторы воспаления. Спектр, источники, способ активации, основные эффекты.
Медиаторы воспаления – местные химические сигналы, образующиеся, освобождаемые либо активируемые в очаге воспаления, действующие и разрушаемые также в пределах очага (Менкин). Медиаторы воспаления распространяются без участия проводников (в отличие от нейромедиаторов) и эффективны, как правило, в пределах очага воспаления из-за его барьерности (в отличие от гормонов). Инактивируются, распадаются или метаболизируются также в пределах очага.
Источники медиаторов: плазма крови (тканевая жидкость) или клетки-участницы воспаления. Гуморальные медиаторы, преимущественно пептидной природы и чаще всего активируются путем ограниченного протеолиза. Клеточные медиаторы могут ресинтезироваться (Pg, IL-1, IL-2), а также освобождаться в готовом виде из депо путем дегрануляции или экзоцитоза. Наиболее большой спектр медиаторов у макрофагов, другими важными источниками являются гранулоциты, тучные клетки, эндотелиоциты, тромбоциты.
Медиаторы либо распознаются соответствующими рецепторами, либо оказывают энзиматическое действие. Отдельно выделяют кислородные радикалы, которые напрямую повреждают свою мишень. Медиаторы могут образовывать цепи сигналов, активируя или освобождая друг друга, ех: некоторые цитокины способствуют дегрануляции тучных клеток, которые выделяют гистамин, который способствует метаболизму арахидоновой кислоты. При этом действуя на резличные рецепторы один и тот же медиатор может вызывать разные реакции, ех: гистамин вызывает бронхоспазм/бронходилатацию, действуя на Н1/Н2-рецепторы.
Основные группы медиаторов выделяют на основе их строения:
ü низкомолекулярные кислородсодержащие радикалы;
ü пептидные;
ü липидные;
ü полисахаридные;
ü биогенные амины.
Противовоспалительные медиаторы необходимы для перехода к репаративным процессам. К ним относятся ингибиторы экссудации и литических ферментов, инактиваторы провоспалительных сигнальных молекул, антиагреганты, антикоагулянты и фибринолитики. Наиболее важные из них:
§ гепарин; связывает биогенные амины, ингибирует комплемент, коагуляцию, агрегацию, адгезию, участвует в процессах регенерации;
§ аденозин; образуется при распаде АТФ, обладает анальгетическим эффектом, блокирует фагоцитоз и образование активных окислителей;
§ хондроитин-сульфаты, эффекты близки к гепариновым;
§ апопротеин Е, макрофагальное происхождение, иммуносупрессорная активность;
§ ингибиторы протеаз: α1-антитрипсин, α1-микроглобулин, ингибиторы комплемента и плазмина: уменьшают альтерацию, ликвидируют последствия экзоцитоза;
§ антифосфолипазы вырабатываются макрофагами, ингибируют фосфолипазу А2;
§ антиоксиданты: церулоплазмин, гаптоглобин, СРБ и т.д.
§ инактиваторы воспалительных медиаторов: гистаминаза, кининаза;
§ действие гистамина на Н2-рецепторы также оказывает противовоспалительный эффект;
§ полиамины;
§ интерлейкин 10: ингибирует выработку других цитокинов.
Биогенные амины
| Медиатор | Источники | Способ активации | Основные эффекты |
| Гистамин | Мастоциты, базофилы, эозинофилы, тромбоциты, эндотелий, ГМК | Преформирован, освобождается из гранул | · Н1+Н2: боль, зуд, фибрилляция, гиперсекреция слизи; · Н1: бронхоспазм, повышение проницаемости, подавление номотопного водителя ритма, генерация липидных медиаторов, активация хемокинеза, лимфоцитотоксичности; · Н2: бронходилатация, расширение артериол, аритмогенный эффект, торможение хемокинеза, дегрануляции, экзоцитоза, лимфоцитотоксичности, стимуляция супрессорного действия лимфоцитов. |
| Серотонин | Энтерохромафинные клетки, тромбоциты, эозинофилы | Тот же | Агрегация Tr, бронхоспазм, повышение проницаемости, расширение артериол, спазм поврежденных сосудов, стимуляция стероидогенеза, мигрень. |
| Полиамины | Все клетки | Ресинтез | Торможение экссудации, стимуляция регенерации |
| Адреналин, норадреналин | Тромбоциты | Преформированы, дегрануляция | Вазоспазм, агрегация Tr, снижение проницаемости. |
Ø Гистамин образуется из гистидина во всех клетках, но в значительных количествах накапливается в клетках-участницах воспаления. Дегрануляция с высвобождением гистамина может быть в ответ на: связывание антигенов, связывание комплемента, нейропептиды ДЭС (ех: вещество Р), цитокины (ИЛ-1, ИЛ-8), физические повреждения клеток, никотиновую кислоту, агонистов Pg рецепторов. Гистамин действует непродолжительно и инактивируется гистамин-N-метилтрансферазой и диаминоксидазой.
Ø Серотонин образуется из триптофана; его высвобождению в очаге воспаления способствуют агреганты и активаторы тромбоцитов (ФАТ, тромбин), а также иммунные комплексы. Разрушается МАО.
Ø Полиамины: спермин, спермидин, путресцин, кадаверин. Являются противовоспалительными медиаторами и стимуляторами репарации, клеточные медиаторы ростового эффекта соматомединов.
Менкин В. проводил хроматографические опыты с воспалительными экссудатами. Разделил химическим путем фракции выпота, содержащие факторы, способные провоцировать различные компоненты воспалительного ответа ткани и выделил некоторые хемоаттрактанты => медиаторная теория воспаления. Ех: пирексин (↑t˚), некрозин (некроз), экссудин (экссудация), лейкопенический фактор, фактор пролиферации, лейкотаксин. Задержка повреждающего агента определяется выходом фибриногена с образованием сетки фибрина и тромбов, закупоривающих просвет отводящих лимфатических сосудов. Первыми в очаг воспаления мигрируют полиморфонуклеары (реагируют на лейкотаксин, обуславливающих хемотаксис и повышенную проницаемость). Постепенно их вытесняют мононуклеары, но при снижении рН ниже 6,9-6,8 они гибнут, образуя гной. Очаг воспаления обособлен от организма: имеет свой собственный обмен, свою рН, свое модифицированное кровообращение. Т.о. по Менкину воспаление – это экстраординарный комплексный механизм, направленный на задержание или уничтожение химического или бактериального возбудителя, приводящий в конечном счете к организации и регенерации поврежденной ткани.
Кристиан де Дюв в начале 50-х гг. в связи с развитием электронной микроскопии описал лизосомы и пероксисомы, показал их важную роль в ходе развития воспаления.
49.Этиология и патогенез первичной и вторичной альтерации. Роль медиаторов и клеточных механизмов альтерации. Система комплемента, источники, пути активации, роль при воспалении. Наследственные и приобретенные дефекты системы комплемента и их последствия.
Первичная альтерация - комплекс изменений, вызванных непосредственным действием повреждающего фактора.
- Является компонентом воспаления.
- Вызывает дистрофические процессы, некробиоз, некроз, апоптоз.
- Повреждение провоцирует ацидоз, накопление ионов К в очаге воспаления, повышение осмотического давления в тканях.
- Результат – боль, спазм сосудов, возможно возникновение нейропаралитической артериальной гиперемии ( при прекращении проведения возбуждения по нервным волокнам). а также синтез и активация ряда медиаторов воспаления, высвобождение продуктов повреждения и метаболитов, которые ответственны за сосудистую реакцию при воспалении и начало экссудации.
Вторичная альтерация. Вызвана продуктами первичной альтерации и клетками- участниками воспаления.
- Вторичная альтерация не зависит от воспалительного агента, для ее развития не нужно дальнейшее присутствие флогогена в очаге.
- Это необходимый компонент воспаления как защитно-приспособительной реакции, направленный на скорейшее отграничение флогогена или поврежденной под его воздействием ткани от остального организма.
- Ценой повреждения достигаются и другие защитные явления: более выраженный микробицидный и литический эффект лизосомальных ферментов и активных метаболитов кислорода, вовлечение других медиаторов воспаления и клеток, усиленная экссудация, эмиграция и фагоцитоз.
- В результате воспалительный процесс завершается быстрее.
1. Гуморальные агенты вторичной альтерации – служат бактерицидными и цитоцидными медиаторами для уничтожения агентов, вызвавших воспаления, но их действие не строго избирательно, плюс многие повреждающие агенты располагаются внутриклеточно, поэтому гуморальные агенты вторичной альтерации повреждают и нормальные клетки. К ним относят:
- Активные кислородные и кислород- галлогеновые радикалы, освобождаемые при гибели клеток в результате первичного повреждения и при экзоцитозе. Механизм повреждения не избирателен. Собственные клетки защищает антиоксиданстная система.
- Оксид азота. Также свободный радикал. Выделяют МФ и эндотелиоциты. Оказывает неселективный цитотоксический эффект на клетки бактерий. паразитов, собственные клетки.
- Конечный продукт активации комплемента - комплекс мембранной атаки С5-С9. Нарушает целостность мембран клеток, помеченных АТ или ИК. В образующиеся поры заходит Са и гранзим В.
- Гидролитические ферменты лизосом, освобождаемые при гибели клеток и при экзоцитозе (липазы, коллагеназа, ЩФ,эластазы, мураминидаза).Разрушают компоненты межкл. вещества (ГАГи, гликопротеины), мертвые клетки. Лучше работают в условиях ацидоза.
- ФНО МФ и Т-лимфоцитов. Вызывает апоптоз и некроз опухолевых, а в высоких концентрациях и некоторых собственных клеток (гепатоцитов).
- Катионные антибиотические белки ( дефензины, азуроцидин А, катепсин G)–группа протеинов, богатых аргинином и цистеином. Наибольшая активность при нейтральных рН – действуют до развития ацидоза, на начальных стадиях. Содержатся в МФ, НФ, высвобождаются экзоцитозом и при разрушении последних. Катионные белки встраиваются в мембраны клеток-мишений и формируют ионный канал. Побочный эффект их действия – повышение сосудистой проницаемости. Могут повреждать Гр+, Гр-, собственные клетки, пораженные вирусами.
- Эозинофильные цитотоксические белки (катионный и главный основный белки эозинофилов). Повреждают паразитов, особенно гельминтов. Могут вызвать гибель и собственных клеток. Более аутопатогенны, чем катионные антибиотические белки, возможно, вследствие явления молекулярной мимикрии паразитов.
- Лактоферрин. Бактерицидный белок НФ. Связывает железо. Бактериальные клетки теряют способность размножаться, испытывают блокаду железозависимых ферментов. Для своих клеток обладает цитопротекторным действием, т.к. уменьшает проникновение железа в очаги воспаления и ослабляет интенсивность разветвления цепных свободнорадикальных реакций.
Гуморальные механизмы вторичной альтерации могут быть связаны и с действием антител (через комплемент или АЗКЦ). Из-за перекрестного действия антител на белки теплового шока (являются высококонсервативными , сходное строение БТШ бактерий и человека).
2. Клеточные агенты вторичной альтерации.
1. НФ и МФ фагоцитоз. Фагоциты не выдерживают собственный окислительный удар и гибнут, выделяются радикалы, дефенсины, лактоферрин и др. , эти гуморальные агенты повреждают прилежащие клетки.
2.Клеточно – опосредованная цитотоксичность. (антителозасимимая и антителонезависимая). Участвуют Т-киллеры, НК и различные К- клетки, МФ:
А. АЗКЦ осуществляется К –клетками (это все клетки, имеющие рецептор к Fc-фрагменту иммуноглобулинов , в т.ч. Эозинофилы). Пример - гиперэрг. анафил. восп-е: Тh2 выделяют ил-5, ил-4 . Они являются стимуляторами продукции IgЕ. IgЕ вызывает выделение из ТК фактор хемотаксиса эоз.
Б. Антителонезависимая клеточная цитотоксичность. В этом случае клетка-мишень или АГ на ней опознаются различными киллерами.
Система комплемента.
Комплемент - система сывороточных белков и нескольких белков клеточных мембран, выполняющая ряд важных функций:
- Опсонизация микроорганизмов для дальнейшего их фагоцитоза (С3b).
- Инициация сосудистых реакций воспаления.
- Перфорация мембран бактериальных и других клеток.
- Хемотаксис и усиление фагоцитоза.
- Регуляция иммунного ответа.
- Освобождение медиаторов воспаления.
- Активация лейкоцитов и опосредование их адгезии.
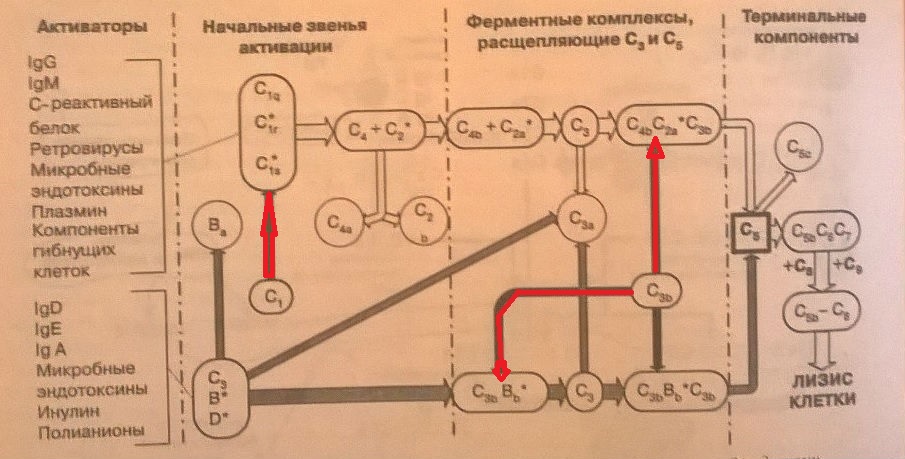
Выделяют классический, альтернативный и лектиновый пути активации комплемента. Все три пути сходятся после образования активированной С3-конвертазы.
Классический путь
1.Активаторы:
- IgG , IgM ( комплекс антиген – антитело)
- C-реактивный белок
- Ретровирусы
- Микробные эндотоксины
- Плазмин
- Компоненты гибнущих клеток
2.В основном это участник эффекторных механизмов приобретенного иммунитета.
3.Это быстрый и эффективный путь активации.
Активируется комплексом антиген-антитело. При фиксации С1q к Fc фр. антител иммунных комплексов, С1q активируется . Конформационные изменения С1q в присутствии кальция приводят к аутокаталитической активации двух молекул С1r. Он становится протеазой и активирует С1s. C1s становится протеазой и гидролизует С4 и С2. С4 расщепляется на С4а и С4b . С4b адсорбируется на мембранах и принимает участие в конвертировании С3. С2 взаимодействует с С 4b и конвертируется С1s в С2a (протеазный комплекс C3\C5 конвертазы).С3 расщепляется C4b2a конвертазой на анафилатоксин С3а и опсонин С3b.С3 служит компонентом С5 конвертазы. Участвует в альтернативном пути активации. С С5b начинает формироваться мембраноатакующий комплекс (C5-С9). Он вызывает перфорацию мембраны.
Альтернативный путь.
1.Активаторы:
- Ig E (необходима очень высокая концентрация), Ig D, IgA
- Микробные эндотоксины (ЛПС)
- Полианионы (инулин)
2.Теряется селективность, чаще всего этот тип активации предшествует иммунному ответу ( т.к. для активации не нужен комплекс антиген – антитело).
3.Медленный и менее эффективный путь активации.
4.В основном участник эффекторных механизмов врожденного иммунитета.
Факторы альтернативного пути имеют буквенное обозначение: P- пропердин, B- аналог С2 классического пути активации, D-сывороточная протеаза, активирующая фактор В путем его расщепления. В итоге также образуется С3-конвертаза.
Активация альтернативного и классический путей. Белые стрелки – классический путь. Серые – альтернативный. Красные – ингибирующее воздействие.
Лектиновый путь.
- При активации по лектиновому пути один из белков острой фазы – маннансвязывающий лектин- взаимодействует с маннаном на поверхности клеток МО. МСЛ-ассоциированная сериновая протеаза катализирует активационное расщепление С4 и С2,после образования активированной С3- конвертазы пути сходятся.
Дата добавления: 2019-03-09; просмотров: 635; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
