Механизмы маргинации и диапедеза. Взаимодействие ЛЦ и эндотелия. Молекулы клеточной адгезии.
По современным представлениям, основной механизм эмиграции ЛЦ состоит в комплементарных лиганд-рецепторных взаимодействиях между ЛЦ и сосудистой стенкой, причем появление рецепторов индуцируется медиаторами воспаления.
МКА играют роль в выселении лейкоцитов из сосудистого русла при воспалении, из растворимые аналоги связаны с патогенезом онкологических, иммунопатологических, инфекционных болезней. Эти молекулы минимально представлены на покоящихся ЛЦ и эндотелиоцитах и могут быть секвестрированы во внутриклеточных гранулах (Р-селектин в альфа-гранулах Тц и др). Часть из них распознает свои лиганды только когда первичная альтерация и/или медиаторы воспаления вызовут в них конформационные изменения.
Медиаторы:
· Освобождение МКА и их лигандов из гранул, конформационные изменения, синтез МКА де ново обеспечивают – некоторые фрагменты комплемента, лейкотриен В4, фактор активации тромбоцитов, трансферрин, ИЛ1, ИЛ8, гамма-интерферон ФНОальфа и ФНОбета, мастоцитарные факторы хемотаксиса базофилов, нейтрофилов, эозинофилов, ЛПС бактерий, перекиси, гистамин, тромбин
· Повышают клейкость только у ЛЦ: лейкотриен В4 - на нейтрофилах, факторы компелемента – на полиморфонуклеарах и моноцитах
· Действую на эндотелий – ИЛ1, эндотоксины бактерий
· Стимулирует адгезивность ЛЦ и клейкость эндотелия – ФНО
Семейства МКА:
1) Селектины – лектиновые молекулы клеточной адгезии; трансмембранные белки, похожие по структуре на рецепторы комплемента и факторов роста; их концевой домен способен связывать олигосахариды, т.е является белком-лектином. Лиганды селектинов – олигосахаридсодержащие молекулы. Селектины опосредуют стадию маргинации – обратимую адгезию ЛЦ. Селектины экспрессируются рано. Первым экспрессируется Е-селектин под действием ИЛ1 и ФНОальфа. для нейтрофилов (поэтому они эмигрируют раньше остальных).
При болезни Кавасаки (системный панваскулит с лизисом активированного эндотелия и лихорадкой) установлено наличие аутоАТ против селектинов.
После активации ИЛ8, ФАТ, МХБ-1 лейкоциты отщепляют L-селектин и синтезируют интегрины
2) Интегрины – гетеродимерные трансмембранные белки, экспрессируемые лейкоцитами и другими клетками, фибробластами, клетками ряда внутренних органов. Эндотелий экспрессирует лишь некоторые интегрины. Интегрины опосредуют прикрепление клеток к субстрату и друг другу. Состоят из единой альфа-цепи и варьирующей бета-цепи. Ответственны за поздние стадии адгезии ЛЦ и ТЦ к эндотелию и частично за диапедез ЛЦ.
3) Белки суперсемейства Ig ( ICAM ) – участвуют в адгезии и экспрессируются эндотелием и агранулоцитами, некоторыми мезенхимальными клетками. Это трансмембранные протеины, их экспрессия усиливается ИЛ1, ФНО, ИЛ2, ЛПС, гамма-интерфероном. ICAM-2 и 3 экспрессируются также неактивированным эндотелием, степень экспрессии 2 определяет интенсивность физиологической миграции ЛЦ в органах (высокая – в тимусе, низкая – в ГМ). ICAM-3 позволяет ЛЦ взаимодействовать.
Обеспечивают отсроченную фазу адгезии и прохождение ЛЦ через сосудистую стенку, все комплементарны интегринам.
4) Адресины – белки клеток внутренней выстилки высокоэндотелиальных венул. При хроническом воспалении происходит усиленный ангиогенез с образованием в его очагах аналогичных венул для усиленной эмиграции лимфоцитах при аутоиммунных заболеваниях (напр, ревматоидный артрит)
5) Хрящевые соединительные белки – имеют значение для диапедеза ЛЦ и дальнейшего таксиса после выхода из сосудистого русла. CD44 экспрессируется ЛЦ, макрофагами глией, фибробластами, эпителиоцитами, миоцитами – распознает гиалуроновую кислоту, коллаген и фибронектин, что обеспечивает адгезию, диапедез ЛЦ и перемещение в соед. ткани.
Асинхронность эмиграции клеток связана с неодновременным появлением МКА и хемотактических факторов для разных ЛЦ.
59. Ответ острой фазы.
Патогенез:

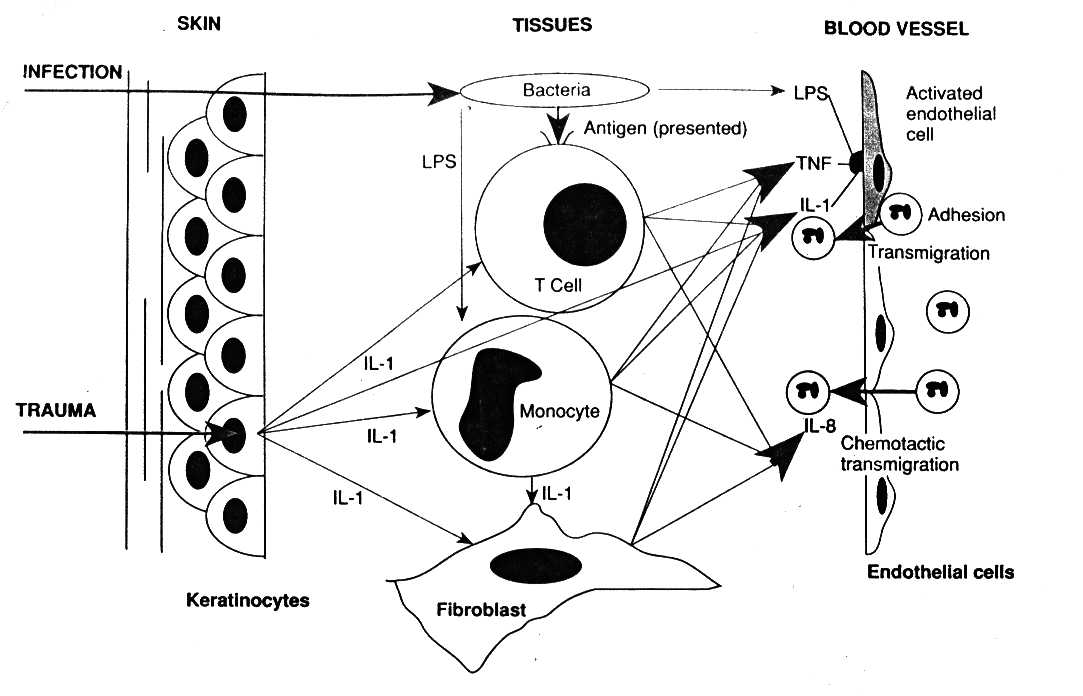
Во время преиммунного ответа, сразу же после контакта возбудителей, их липополисахаридов и/или медиаторов воспаления с макрофагами, лимфоцитами и эндотелием происходит освобождение и совокупное действие ряда пептидов.
Свои эффекты на многие клетки они реализуют через рецепторы, внутриклеточными посредниками стимуляции которых служат медиаторы арахидонового каскада.
Патофизиологическими результатами этого каскадного процесса служит резкое повышение в печени и макрофагах синтеза положительных глобулинов острой фазы: фибриногена,
· С-реактивного белка,
· амилоида А и Р,
· гаптоглобина,
· церулоплазмина,
· антигемофильного глобулина,
· VII и IX факторов коагуляции,
· антикоагулянтных белков С и S,
· антитромбина III,
· плазминогена,
· α2‑макроглобулина,
· α2-макрофетопротеина,
· компонентов комплемента,
· α1-кислого гликопротеина,
· ингибиторов протеаз,
· транскобаламина-2,
· орозомукоида,
· ферритина
Белки острой фазы (синтезируются в печени, макрофагах, тучных клетках, нейтрофилах и др.)
Выполняют три задачи:
1. Оказывают антимикробное действие: С – реактивный белок, факторы комплемента; гаптоглобин, лактоферин, трансферин.
2. Уменьшают повреждение тканей: церулоплазмин, гаптоглобин, лактоферин, ↓ трансферин.
3. Регулируют гомеостаз и антигомеостаз (факторы коагуляции и антикоагуляции)
Ответ острой фазы - это развитие целого ряда системных реакций организма, возникающих в ответ на выделение цитокинов из клеток места повреждения, опосредующих свои эффекты через кровь и рецепторы клеток организма, посредниками которых внутри этих клеток чаще всего бывают производные арахидоновой кислоты. Острофазный ответ подразумевает широкую типовую метаболическую перестройку.
ИЛ-1.
1. Образуется в макрофагах, лейкоцитах, NK-клетках, дендритных клетках кожи, в клетках глии, нейронах, опухолевых клетках.
2. Продукция стимулируется инфекционными и неинфекционными факторами.
3. Как медиатор острого воспаления способствует выходу нейтрофилов в участок воспаления.
4. Как медиатор ответа острой фазы (ООФ) активирует Т - и В-клетки иммунитета → ↑ AT.
5. Как медиатор ответа острой фазы (ООФ) активирует стволовые клетки КМ: ↑НФ, ↑ тромбоциты.
6. Как медиатор ответа острой фазы (ООФ) активирует - гипоталамус-гипофиз-надпочечники: ↑ АКТТ + ↑ вазопрессин + ↑ кортикостероиды → распад белка; ↓ соматолиберин → ↓ СТГ, ↑ соматостатин (↓ избыточная активация образования АТ!); ↓ секреция гонадотропина → ↓ секреция половых стероидных гормонов, ↓ секреция пролактина.
7. Как медиатор ответа острой фазы (ООФ) влияет на ЦНС: сонливость, депрессия, снижение интереса к окружающему → ↓ аппетита, ↓ полового влечения, адинамия; лихорадка - ↑ t° тела.
8. Как медиатор ответа острой фазы (ООФ) влияет на другие органы (производные соединительной ткани): через О¯2 → ↑ ПОЛ → ↑ АЛФ → боль в мышцах (протеаз), боль в суставах (↑ коллагеназ), ↑ активность остеокластов, разрушающих кость, ↑ активность плазминогена → плазмин → распад белка → ↑ аминокислот (защ. акт + ресурсы).
ИЛ-6.
1. Образуется в тех же клетках, что и ИЛ-1, кроме нейтрофилов («не любят» ИЛ-6-ф-р апоптоза этих клеток), особенно много в Т-лимфоцитах, в эпителии.
2. Главные стимуляторы образования ИЛ-6-инфекционногопроисхождения (вирусы, бактерии, липополисахариды, бактериальные пептиды, эндотоксины, грибки).
3. Как медиатор острого воспаления прекращает выход нейтрофилов (апоптоз), способствует выходу моноцитов в участок воспаления; способствует пролиферации через ФРФ моноцитов, лимфоцитов, макрофагов, тромбоцитов. Играет поэтому большую роль в, хроническом (пролиферативном) воспалении.
4. Как медиатор ответа острой фазы (ООФ) активирует иммунитет: (Т - и В-клетки иммунитета, ↑ продукцию ИЛ-2 зрелыми Т-лимфоцитами).
5. Как медиатор ответа острой фазы (ООФ) - на КМ: ↑ НФ, позднее: ↑ МОН, ↑ тромбоциты, ↑ эритроциты.
6. Как медиатор ответа острой фазы (ООФ) влияет на эндокринную систему: активирует гитоталамо-гипофизарно-надпочечниковую ось стресса (КРГ, АКТГ, гормоны надпочечников → распад белка!).
7. Как медиатор ответа острой фазы (ООФ) влияет на ЦНС: → ↑ t тела, но менее пирогенен, чем ИЛ-1: слабая лихорадка.
8. Особые функции ИЛ-6-главный стимулятор синтеза белков ООФ печеночными клетками и макрофагами (комплемент).
ФНО - α.
1. Образуется в макрофагах, лейкоцитах, лимфоцитах (лимфотоксин – ФНО - β), адипоцитах, тучных клетках, клетках глии, нейронах. Опухолевые клетки его не производят («могильщик»).
2. Стимуляторами продукции являются инфекционный фактор (бактерии, вирусы, их токсины, грибки, паразиты), АГ + АТ, С3а, C5а, цитотоксины.
3. Как медиатор острого воспаления активирует все клетки в участке воспаления: эндотелий, лейкоциты, ↑ их адгезию, эмиграцию, фагоцитоз, ↑ О-2, усиливает выход хемоаттрактантов ИЛ-1, ИЛ-8, ИЛ-6, НФН γ, стимулирует пролиферацию фибробластов, ангиогенез. Особая роль в развитии первичного хронического воспаления!
4. Как медиатор ООФ активирует иммунитет, ↑ рост NK-клеток, их цитотоксичность (к опухолевым клеткам).
5. Как медиатор ООФ активирует оси стресса: катехоламиновую (катехоламины, глюкагон), гипоталамо-гипофизарно-надпочечниковую (АКТТ → кортизол).
6. Как медиатор ООФ действует на ЦНС: на гипоталамус (лихорадка, ↑ активность центра голода, ↓ активность центра сытости → снижение аппетита → похудание (кахексии).
7. Как медиатор ООФ - прямое действие на жировую ткань (ингибиция липогенных ферментов) → исчезновение жировой ткани не зависимо от аппетита (кахексии).
8. Как медиатор ООФ оказывает цитотоксическое действие на клетки органов и тканей: ↑ О¯2 → активация протеолиза, ↑ NO¯ в эндотелии сосудов, апоптоз клеток, выработка в АПУД-клетках сердца миокардиального депрессорного полипептида → ↓ УО, ↓ МО сердца; боли в мышцах, суставах, костях; токсичен в больших дозах для ЖКТ, почек, печени, эндотелия сосудов, нейронов.
9. Как медиатор ООФ обладает особым действием – тормозит экспрессию противошоковых агентов - эндогенных опиатов.
10. Как медиатор ООФ замедляет рост опухолей in vivo (геморрагический некроз), цитотоксичен для многих опухолей in vitro.
Проявления:
Недомогание: депрессия, сонливость, безразличие, снижение интереса к окружающему, потеря аппетита, ↓ полового влечения, боли в мышцах, суставах, костях, головные боли, адинамия, мышечная слабость, похудание, снижение трудоспособности.
60. Аллергия. Определение понятия. Распространенность. Сенсибилизация. Классификация аллергич.р-ций. Этиология. Роль наследственной предрасположенности. Роль и виды аллергенов. Общий патогенез и стадии аллергических реакций.
В МЕДИЦИНЕ Аллергия – ситуация, при которой слишком сильный, плохо отрегулированный, либо неверно нацеленный имунный ответ приводит к нежелательным для пациента последствиям.
В ПАТОФИЗИОЛОГИИ понятию Аллергия соответствует термин гиперчувствительность. Гиперчувствительность – это явление, в основе которого лежат типовые иммунопатологические процессы, развивающиеся в сенсибилизированном организме, в режиме вторичного иммунного ответа, при контакте с антигеном, вызвавшим сенсибилизацию, имеющие своим итогом гиперэргическое воспаление. Антигены, провоцирующие аллергию, называются аллергенами. Процесс невозможен без генетически детерминированных особенностей реакции организма на данный антиген.
Аллергия – проблема организма, который генетически предрасположен к необычной реакции на заурядный для многих других антигенный раздражитель. Важна генетическая предрасположенность. Например, семейная предрасположенность к анафилаксии обусловлена мультифакториальным наследованием и контролируется несколькими генами, действующими аддитивно и подверженными пороговому эффекту, связанному с рядом внешних и внутренних условий. Предрасположенные индивиды дают более интенсивный синтез IgE при меньшей степени воздействия провоцирующих аллергенов. К некоторым антигенам аллергичны большие группы людей (к АГ гельминтов аллергически реагирую практически все).
Соответственно двум основным формам иммунного ответа (нормальной физиологической функции иммунной системы, постоянно происходящей в здоровом организме, как по отношению к собственным АГ, так и по отношению к чужеродным АГ) иммунопатологические реакции могут иметь следующие механизмы:
1) преимущественно гуморального типа (антитело-опосредованные иммуноповреждения или АТОИП) - реакции гиперчувствительности немедленного типа (ГНТ)
В сенсибилизированном организме развиваются быстро (от нескольких мин до 4 часов с момента поступления аллергена), хотя для самой сенсибилизации требуют относительно большего срока (7-12 дней), пассивно переносятся сывороткой, вызываются иммуноглобулинами. Подразделяются на: 1) анафилактические; 2) цитотоксические; 3) иммунокомплексные.
2) преимущественно клеточного типа (клеточно-опосредованные иммуноповреждения или КОИП) - реакции гиперчувствительности замедленного типа (ГЗТ).
В сенсибилизированном организме развиваются позднее (48-72 часа с момента поступления аллергена), хотя требуют меньшего срока для приобретения самой сенсибилизации (3-6 дней), пассивно переносятся лимфоцитами (адоптивный перенос), высызваются сенсибилизированными Т-лц. По глубине проникновения аллергена в организм ГЗТ подразделяют на 3 категории: 1) реакции типа контактного дерматита; 2) реакции туберкулинового типа; 3) гранулематозную гиперчувствительность.
Подробнее про ГНТ и ГЗТ в 61 и 62 билетахJ
Первичный иммунный ответ на аллерген называется сенсибилизацией. Суть сенсибилизации – выработка в ходе первичного иммунного ответа достаточного (для последующего развития аллергии) количества специфических иммуноглобулинов (АТОИП-реакции) и сенсибилизированных Т-лимфоцитов (при КОИП-реакциях). Понятие КОИП условно, так как и для АТОИП необходимы клетки, в частности, плазматические.
Основные этапы иммунного ответа: представление АГ, распознавание АГ, бласттрансформация, деление бластов, специализация бластов.
Аллергия, как и любой типовой патологический процесс, обладает стадийностью. В патогенезе аллергических реакций различают три стадии: 1) иммунологическую; 2) патохимическую; 3) патофизиологическую.
Иммунологическая стадия – специфическая стадия аллергии. Охватывает период от первичной до вторичной встречи с аллергеном включительно. В эту стадию происходит взаимодействие аллергена со специфическими иммуноглобулинами (АТОИП) или с сенсибилизированными Т-лц (КОИП).
Патохимическая стадия – неспецифическая стадия, т.к. не обнаружено медиаторов, которые опосредовали бы, исключительно, аллергическое воспаление, не участвуя в нормэргическом. Характеризуется освобождением, активацией и синтезом биологически активных веществ (БАВ) - медиаторов аллергии. Сигналом для ее начала служит взаимодействие антигена (аллергена) с антителами (ГНТ) или с сенсибилизированными Т-лимфоцитами (ГЗТ). Далее к действию первичных медиаторов аллергии присоединяются вторичные медиаторы воспаления.
Патофизиологическая стадия – неспецифическая стадия. Представляет собою результат действия медиаторов на клеточные рецепторы: ответную реакцию на повреждение - гиперэргическое воспаление и/или нарушение информационных взаимодействий клетки с биорегуляторами (дизрегуляторные процессы).
Сходные с аллергическими патофизиологические проявления имеют аллергоидные реакции (псевдоаллергия), при которых механизм освобождения медиаторов не связан с иммунными процессами (иммунологическая стадия отсутствует), но имеет место связь с другими процессами, вызывающими активацию, освобождение или синтез медиаторов гиперэргического воспаления. ПРИМЕР: крапивница в ответ на употребление в пищу клубники является аллергоидной реакцией, вызванной неспецифической дегрануляцией мастоцитов в ответ на клубничный лектин, действующий на реагиновые рецепторы (рецепторы для аллергических АТ).
Этиология. Причина аллергии состоит в аномальном взаимодействии иммунной системы с антигеном. При этом имеет значение и вид антигена, и путь внедрения, срок его персистирования в АПК, и его доза при первом и повторном контакте, а также и общее состояние иммунной системы, но прежде всего - индивидуальная реакция на конкретный антиген.
Аллергены делятся на:
1) Экзогенные: к ним относятся гетероаллергены - вдыхаемые, контактные (действуют на кожу и слизистые), пищевые, инъекционные, инфекционные, лекарственные;
2) Эндогенные: а) гетероаллергены – 1. Неинфекционные (индуцируемые повреждением; атипические – опухолевые, эмбриональные, АГ стареющих клеток); 2. Инфекционные (вирус-индуцированные; индуцированные микроорганизмами);
б) аутоаллергены – нормальные интактные антигены собственных клеток и их продуктов. В норме вызывают аутотолерантность.
61. Патогенез ГНТ. Стадии. Разновидности ГНТ. Особенности сенсибилизации и ответной реакции при ГНТ. Методы экспериментального моделирования ГНТ. Роль ГНТ при патологии. Сравнение ГНТ и ГЗТ. Возможности пассивной передачи ГНТ и ГЗТ. Концепция "аллергического прорыва"
Синоним - антитело опосредованные иммуноповреждения. В сенсибилизированном организме эти реакции развиваются быстро, от 4 минут до часа после поступления аллергена, но для сенсибилизации требуют большего срока - 7-12 дней. Пассивно переносится сывороткой, вызывается иммуноглобулинами.
Виды - анафилактические
цитотоксические
иммунокомплексные
Стадии:
Иммунологическая
Патохимическая
Патофизиологическая
Суть иммунологической стадии - встреча антигена со специфическим иммуноглобулином - это СПЕЦИФИЧЕСКАЯ стадия аллергии.
Для развития ГНТ антиген должен быть представлен А-клеткой, как экзоцеллюлярный, т.е. в контексте белков ГКГС II класса. Тогда антиген распознают Т-хелперы 2 типа и представляют В-лимфоцитам. Т.е. ГНТ развивается когда антиген экстрацеллюлярный, а попав в клетку он разрушается.
Особенности в том, что за их проявление отвечают иммуноглобулины, разные АТ дают разные повреждения, которые определяются свойствами Ig. IgG не цитофильны, не прилипают к клеткам, проникают через биологические мембраны, через плаценту. Проникают до ядра и могут регулировать генетический аппарат. Сорбируют белки системы комплемента и могут образовать комплекс мембранной атаки, который формирует поры.
Анафилактические реакции - это местные или системные проявления гиперэргического воспаления, которые развиваются вследствие выделения короткоживущих БАВ из специальных клеток, поверхность которых снабжена цитофильными иммуноглобулинами, присоединяющими поливалентные Т-зависимые антигены.
Пример - ГБН - гемолитическая болезнь новорожденных. Как правило развивается при повторной беременности, т.к. в ходе первой происходит сенсибилизация. Является проявлением резус-конфликта, когда резусположительный плод развивается у резусотрицательной матери.
К иммунокомплексным патологиям относятся васкулиты (сывороточная болезнь) и феномен Артюса. Стадии - специфическое связывание, циркуляция, оседание, сорбция комплемента, образование пор в эндотелии, васкулит. Феномен Артюса (постинъекционные процессы) - развивается у предрасположенных людей, когда АГ оказывается в тканях организма, и затем АТ и АГ диффундируют по направлению друг к другу, после чего происходит разрушение стенки сосудов, развиваются массивные кровоизлияния и воспаление. Аналогичным образом развивается альвеолит - легкие фермера, птичника.
Анафилаксия играет роль в проявлении таких заболеваний, как аллергическая бронхиальная астма, вазомоторный ренит, гемолитический синдром, крапивница.
ГНТ и ГЗТ схожи в том, что в обоих случаях участвуют как гуморальный, так и клеточный компоненты, а также поздние проявления ГНТ по времени укладываются в интервал, ранее безусловно отводившийся для ГЗТ (18-48ч).
ГНТ и ГЗТ различаются по:
Времени сенсибилизации (7-12 дней/3-6 дней)
Времени развития ответа после вторичного контакта (первый час/48 часов)
Основному агенту, оказывающему развитие гиперчувствительности (иммуноглобулины/лимфоциты)
Типу MHC (тип II/тип I)
ГНТ переносится сывороткой крови, ГЗТ переносится только сенсибилизированными лимфоцитами.
Концепция аллергического прорыва - концепция, согласно которой анафилактический ответ, помимо присутствия аллергенов и измененной реактивности, требует перехода определенного общего порога активации иммунной системы. Неспецифические факторы (поликлональные иммуностимуляторы, суперантигены, воздействия, подавляющие активность супрессии и синтез IgA, повышающие проницаемость естественных барьеров и уровень гистамина, подавляющие активность аденилатциклазы), могут способствовать снижению этого порога и играть роль неспецифического повода для реакции на специфический аллерген. Классический пример - провоцирующая роль герпетических явлений. В качестве примера порога активации см. салицилатный аллергоидный синдром, где ключевую роль играет баланс лейкотриенов и простагландинов
Антителозависимая клеточная цитотоксичность - когда К-клетки повреждают другие клетки за счет взаимодействия с Fc фрагментом иммуноглобулинов. К-клетки - клетки в которых имеется много Fc рецепторов (CD16). К К-клеткам относят микро и макрофаги, натуральных киллеров.
Также при анафилактических реакциях возможна специфическая десенсибилизация, и только при них, по методу Безредко. Суть - постепенное вводимых доз антигенов, чтобы связать циркулирующие в крови антитела.
Методы моделирования :
Опыт 1. Анафилактическая реакция тучных клеток белой крысы. Белую крысу, сенсибилизированную лошадиной сывороткой (0,5мл через день 3 раза), забивают эфиром через 12-19 дней после инъекции. В брюшную полость вводят 5мл р-ра Тироде. Брюшная стенда массируется 2-3 минуты и рассекается по средней линии. Жидкость, содержащую тучные клетки, отсасывают и центрифугируют. На предметном стекле, по концам которой нанесена краска нейтральрот, на пятне высушенной краски смешивают каплю центрифугата и каплю специфического антигена (белок лошадиной сыворотки), на другом конце смешивают с каплей неспецифического антигена. Обе смеси накрывают покровными стеклами и смотрят на x40. Отмечают, какая стадия аллергической реакции соответствует дегрануляции тучных клеток.
Стоит отметить что в контроле тоже имеется неспецифическая дегрануляция мастоцитов от контакта со стеклом - аллергоидная реакция.
Опыт 2. Анафилактическая реакция на сосудах брыжейки сенсибилизированной лягушки. Лягушку сенсибилизируют за 30 дней до опыта, введением лошадиной сыворотки трехкратно в спиной лимфатический мешок. Затем лягушку обездвиживают и извлекают кишечник вместе с брыжейкой. Затем сначала капают неспецифический антиген (собачью сыворотку) и оценивают эффект. Затем брыжейку отмывают и наносят специфический антиген. Отмечают изменение кровотока через 30-45 секунд, расширение сосудов, замедление и остановку тока в капиллярах.
Опыт 3. Анафилактическая реакция на сердце сенсибилизированной лягушки. Та же самая лягушка, с сердца снимают перикард, подсчитывают число сокращений, затем наносят неспецифический антиген, считают число сердцебиений, после чего отмывают и наносят специфический. При этом исследуют патофизиологическую стадию аллергии.
Также для моделирования иммунологической стадии можно использовать метод радиальной иммунодиффузии по Ухтерлони, когда в центр наносят сыворотку, а по углам антигены. Они диффундируют друг к другу, и по характеру преципитации можно судить о специфичности сывороток и характера антигена.
В дополнение к билету 63:
Анафилактическая реакция=реагиновая=атопическая=реакция 1 типа. Если в ходе первичного ответа образуется достаточно большое количество хелперов 2 типа, которые способны выделять не только IL-2, но и IL-4,5,6), то многие плазмоциты будут секретировать антитела-реагины - Ig E и Ig G4. Они цитотропны, не связывают комплемент и не проникают через биологические мембраны. При повторной встрече иммуноглобулины (преимущественно E) взаимодействуют с аллергеном и взаимодействуют с реагиновыми P1 рецепторами слизистых и соединительнотканных мастоцитов и базофильных гранулоцитов. В них активируется каскад образования фосфотидилхолина и арахидоната, формируется кальциевый канал. Ионы кальция активируют фосфолипазу А2, арахидоновая кислота затем метаболизируется до простагландинов (ЦОГ) или до лейкотриенов (ЛОГ). Также ионы кальция активируют дегрануляцию.
Ранняя фаза анафилаксии - в пределах первого часа после контакта. В случае ингаляционного пути поступления, сначала дегранулируют тучные клетки слизистой, затем тучные клетки субмукозальной соединительной ткани. В результате дегрануляции выделяется гистамин (вызывает бронхоконстрикцию напрямую через Н1 и опосредовано через холинэргические нервные окончания), и другие медиаторы воспаления.
Простогландины F2альфа, тромбоксан А2 - потенциальные короткоживущие констрикторы гладких миоцитов. Также тромбоксан А2 активирует коагуляцию и быструю агрегацию тромбоцитов. Лейкотриены C4, D4, E4 составляют медленно реагирующую субстанцию анафилаксии (МРСА), которая в 100-1000 раз мощнее гистамина. МРСА вызывает сокращение мельчайших воздухопроводящих путей бронхиального дерева. В продукции некоторых лейкотриенов могут кооперироваться тромбоциты и лейкоциты белого тромба, передавая друг другу из мембраны в мембрану предшественники.
ФАТ - фактор активации тромбоцитов - самый мощный активатор тромбоцитов и нейтрофилов, активный констриктор гладких миоцитов.
Еще один мощный медиатор, спазмирующий гладкие миоциты - ТАМЭ (тоциларгининметилэстераза) - мастоцитарно-базофильная эстераза.
Основные дилататоры бронхов - ВИП (вазоактивный интестинальный полипептид), образуемый местными эндокриноцитами, а также простогландин Е2.
При дегрануляции выделяются литические ферменты триптаза (маркер мастоцитов) и химаза, которые разрушают ВИП. Трипаза также лизирует С3 компонент комплемента с образованием анафилотоксина (С3а - пептид), вызывающего новую волну дегрануляции мастоцитов, активацию нейтрофилов и макрофагов, вазодилатацию. Трипаза активирует систему кининов, через нее - белки сторожевой полисистемы плазмы. Химаза разрушает протеогликаны, провоцируя усиление экссудации.
Простагландины увеличивают секрецию слизи.
Лейкотриен D4 - стимулятор слезоотделения, лейкотриен В4 - хемокин нейтрофилов, маркер базофилов.
Эотаксины вовлекают эозинофилы - важнейший эффектор поздней фазы анафилаксии.
По ходу этих событий низкоаффинные реагиновые рецепторы R2 появляются на остальных типах лейкоцитов, на тромбоцитах и антигенпрезентирующих клетках.
62. Гиперчувствительность замедленного типа. Особенности периода сенсибилизации и ответной реакции при ГЗТ. Особенности генетической предрасположенности, сенсибилизации, аллергенов и эффекторных механизмов при ГЗТ. Классификация ГЗТ. Сравнительная характеристика отдельных разновидностей. Механизмы контактного дерматита, туберкулиновой реакции и гранулематозной гиперчувствительности. Общие закономерности строения и формирования гранулем. Примеры.
ГЗТ – гиперчувствительность замедленного типа, или клеточно-опосредованное иммуноповреждение.  Обычно в сенсибилизированном организме развиваются позднее (48-72 часа с момента поступления), хотя требуют меньшего срока сенсибилизации (3-6 дней), пассивно переносятся лимфоцитами (адоптивный перенос), вызываются сенсибилизированными Т-лимфоцитами.
Обычно в сенсибилизированном организме развиваются позднее (48-72 часа с момента поступления), хотя требуют меньшего срока сенсибилизации (3-6 дней), пассивно переносятся лимфоцитами (адоптивный перенос), вызываются сенсибилизированными Т-лимфоцитами.
Для того, что бы реакцияГЗТ развилась, антиген должен быть представлен А-клеткой, как эндоцеллюлярный, в контексте белков ГКГС 1 класса. Тогда Т-хелперы 1 типа и Т-эффекторы его распознают. Поэтому, реакции КОИП – обязательно и преимущественно развиваются, если аллерген персистирует в клетках долгое время – например, при инфекциях с внутриклеточным паразитированием. Эти реакции участвуют в поздней стадии отторжения трансплантата и пр. Итог – продуктивное воспаление, которое управляется цитокинами.
3 категории, если подразделять по глубине проникновения аллергена в организм:
Контактный дерматит (аллерген в эпидермисе).
Реакции туберкулинового типа (аллерген, собственно, в дерме).
Гранулематозная гиперчувствительность (распространение за пределы кожи, системно.
При аллергоидных реакциях (псевдоаллергия) механизм высвобождения медиатора не связан с иммунными процессами. Неиммунологические триггеры вызывают выделение медиаторов и последующее развитие патофизиологической стадии.
63. Этиология и патогенез анафилактических реакций. Роль в патологии. Механизмы генетической предрасположенности, особенности аллергенов и антител при анафилаксии. Особенности периода сенсибилизации. Реагины. Ранняя и поздняя стадии анафилаксии. Разнообразие тучных клеток и их роль при анафилактических реакциях. Разнообразие и примеры анафилаксии. Патогенные и защитные аспекты действия IgE в организме.
Анафилаксия - реакция 1 типа, типичная гиперчувствительность немедленного типа.
Анафилактические реакции - местные или системные проявления гиперэргического воспаления, которые развиваются вследствие выделения короткоживущих биологически активных из специальных клеток, поверхность которых снабжена цитофильными иммуноглобулинами, присоединяющими поливалентные Т-зависимые зоны.
При А. в сенсибилизированном организме в реакцию с аллергеном при повторной встрече вступают IgE, прочно и длительно связанные своими Fc-фрагментами с мастоцитами, гранулоцитами и тромбоцитами. В меньшей степени и на более короткий срок (до 24 ч) сенсибилизацию собственных клеток- резервуаров медиаторов- способны у человека обеспечивать поверхностно фиксированные не активирующие комплемент IgG4. Обе субпопуляции иммуноглобулинов носят наименование гомоцитотропные антитела, или реагины.
Семейная предрасположенность к анафилаксии
Обусловлена мультифакториальным наследованием и контролируется несколькими генами, действующими аддитивно и подверженными пороговому эффекту, связанному с рядом внешних и внутренних условий.
Предрасположенность > более интенсивный синтез IgE при меньшей степени воздействия провоцирующих аллергенов.
· Способность к ИО на аллергены, вызывающие анафилаксию, контролируется Ir-генами, тесно ассоциированными с ГКГС
· Некоторые анафилактические АТ среди Ig, вырабатываемых при первичной иммунной реакции
зависят от ряда генов, контролирующих выработку всех регуляторов продукции IgE.
· Цитокины, управляющие развитием иммунного ответа по анафилактическому, либо нормергическому руслу
кодируются генами 5-й хромосомы (локус 5q31.1).
У «гиперреакторов», предрасположенных к анафилаксии, могут быть ↑:
· эффективность ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-13
· гликозилирование IgE-СФ
· действие кининогенов
и/или ↓:
· эффективность действия ИФН-α и, особенно, секреция ИФН-γ
· функции супрессорных лимфоцитов, кортикостероидов и липомодулина,
· продукция ИЛ-12 макрофагами.
Низкий уровень продукции IgE зависит у человека от доминантного гена. Аддитивно-полигенное наследование анаф-и с пороговым эффектом вызвало к жизни концепцию «аллергического прорыва», согласно которой анаф-ий ответ помимо аллергенов и измененной реактивности, требует перехода определенного общего порога активации имм.системы.
Неспец-е факторы (поликлональные иммуностимуляторы, суперантигены, воздействия, подавляющие активность супрессии и синтез IgA, ↑ проницаемость естественных барьеров и уровень гистамина, ↓ активность АЦ):
· способствуют ↓ этого порога или его переходу
· играют роль неспецифического повода для реакции, причина которой- специфический аллерген (провоцирующая роль окислов серы, NO, сиг.дыма →астм.бронхит, вызванного аллергенами, аллергоидными и нейроэндокринными механизмами за счет неспецифического повреждения слизистой бронхов, и/ или адъювантного эффекта).
В зависимости от вида антигена, его дозы и пути введения, индивидуальных особенностей ИС и генов ГКГС при ответе на АГ образуются Т-хелперы преимущественно 1-го или 2-го типа.
Первичный иммунный ответ:
аллерген –
· стимуляция выброса ИЛ-2, ИЛ-4, 5, 6 и ИЛ-13 – активация и образование большого числа Т-хелперов 2-го типа – стимуляция плазматицированных В-лимфоцитов – продуцирование В-л-ми Ig G1 (у человека G4), IgE.
Эти Ig служат при вторичном контакте с аллергеном триггерами ранней стадии анафилактической реакции.
· Поглощается мононуклеарными фагоцитами – ФЦ активируется, продуцирует ИЛ-12–дифференцировка Т-хелперов 1ого типа, препятствующих развитию иммуннного ответа по анафилактическому типу. Интерфероны сильно тормозят продукцию анафилактических антител.
Свойства IgE:
· Гомоцитотропность
способность сенсибилизировать собственные клетки к аллергенам. Обеспечивается способностью прочно связываться с мастоцитами и базофилами.
· Неспособность активировать систему комплемента по классическому пути
· Неспособность проходить через неповрежденную плаценту
Для фиксации реагинов имеется два типа рецепторов:
· Высокоаффинный Р1 Только у мастоцитов и БФ. Это основной рецептор дегрануляции и ранней фазы анафилаксии.
· Низкоаффинный Р2. Имеется на В-лимфоцитах.
Индуцируется ИЛ-4 на эозинофилах, моноцитах, Т-лимфоцитах и кровяных пластинках, альвеолярных макрофагах.
Способен к аутопротеолизу и освобождению фрагментов, регулирующих синтез IgE-самоподдержание процесса синтеза реагинов.
Активируя ЭФ и ТЦ, Р2 играет роль в реализации поздней фазы анафилаксии и разрешении гиперергического воспаления.
Мастоциты и их гетерогенность.
Общ.КМ предшественник→расселение→ различия под влиянием микроокружения разных тканей.
| Соединительнотканные мастоциты (СТМ): | Слизистые мастоциты (СЛМ): | |
| Локализация | окрестности сосудов и нервных окончаний в с/тк всех органов (в коже и проксимальной части ЖКТ) | слизистая дистальной, и особенно, средней части ЖКТ слизистая дыхательных путей и легких. Возможно, рециркулируют в пределах ассоциированной со слизистыми лимфоидной ткани. |
| Созревание | зависит от нейропептидов или секреторных продуктов диффузной эндокринной системы, с которой тесно связаны и не контролируются действием ИЛ-3 | контролируется Т-клетками через стимуляцию ИЛ-3 |
| Активные вещества | больше гистамина, химазы и триптазы. вырабатывают при стимуляции преимущественно гепарин и Pg | богаты гистамином и протеазами в 5-8 тыс. раз больше реагиновых рецепторов преобладают хондроитинсульфаты D и Ε и лейкотриены |
| Тип реакции | более пролонгированная сенсибилизация и более длительное воспаление. | более острая |
Базофилы имеют иной костномозговой предшественник.
Базофилы беднее протеазами, гликозаминогликанами и гистамином, чем мастоциты, содержат хондроитинсульфаты А и С.
Дегрануляция
1. Две рядом лежащие молекулы IgE на поверхности мастоцита связываются двумя эпитопами молекулы поливалентного аллергена.
2. В молекуле иммуноглобулина открывается ранее скрытый “тканеактивирующий” центр.
3. Этот процесс через цитоплазматический хвост FcRI- рецептора активирует молекулу - предшественник серинэстеразы.
4. Серинэстераза запускает цепь реакций, в результате которых образуется фосфатидилхолин.
5. Мембрана мастоцита становится проницаема для кальция, он проходят через ПМ и активирует
- фосфолипазу А2, которая способствует образованию арахидоновой кислоты – из нее: либо Pg либо LT
Так же параллельно активируются:
- протеинкиназа А (цАМФ-зависимая активация)
-протеинкиназа С
6. Совокупное действие вышеназванных протеинкиназ - фосфорилирование и активация цитозольного белка Р и др. белков семейства кальэлектринов.
Эти белки служат фьюзогенами, расплавляющими перигранулярные мембраны и обеспечивающими слияние гранул с медиаторами в крупные вакуоли.
7. Кальций- индуцирует сокращение микрофиламентов, реорганизацию микротрубочек - гранулы двигаются к ПМ + фьюзогены - дегрануляция.
Патохимическая стадия анафилаксии..
· Ранняя фаза
является результатом реагин-зависимой дегрануляции СЛМ, СТМ и базофилов. Она развивается в пределах первого часа после разрешающего контакта с аллергеном.
* СТМ: простагландиновый путь
ЦОГ превращает арахидоновую кислоту в две циклические эндоперекиси, PgG2 и PgН2. Эти Pg модифицируются синтетазами в биоактивные Pg (D2, Е2, F2а, I2), простациклин и тромбоксан А2.
Pg D2 является уникальным продуктом мастоцитов, важен для сосудисто-секреторных изменений в раннюю стадию анафилаксии и не участвует в поздней фазе ответа.
PgF2a и тромбоксан А2 — потенциальные (но короткоживущие) констрикторы гладкой мускулатуры бронхов.
Pg Е2 — расширяет бронхи.
Тромбоксан А2 вызывает быструю агрегацию тромбоцитов и активирует коагуляцию.
Кроме того, члены семейства простагландинов усиливают активность слизистых желез и вязкость их секрета, склеивание тромбоцитов и угнетают экспрессию клейких молекул на эндотелиоцитах.
* СЛМ: лейкотриеновый путь преобладает
ЛОГ превращает арахидоновую кислоту в 5-НЕТЕ →лейкотриен А4 →В4(при добавлении воды)→ С4(при добавлении глутатиона).
Отщепление глутаминовой кислоты → D4;
отщепление глицина → Е4.
Смесь С4, Е4, D4 - медленно реагирующую субстанцию анафилаксии (МРСА): в сокращении мельчайших воздухопроводящих путей бронхиального дерева лейкотриены действуют в 100-1000 раз сильнее, чем гистамин. Лейкотриен В4 — мощный хемоаттрактант нейтрофилов.
Лейкотриены С4 и D4 — резко усиливают отделение слизи (слизь, содержащая лейкотриены, парализует личинки нематод и выводит их из организма).
Фактор активации тромбоцитов - мощный активатор Tr и Neu и активный констриктор гладких мышц.
Триптаза лизирует С3- фрагмент комплемента – образуется С3а пептид .
С3а пептид – анафилотоксин, и вызывает вместе с С
- новую волну дегрануляции мастоцитов
- активацию Neu и макрофагов
- вазодилатацию
- усиление экссудации и отек
- активирует кининовую систему, а через нее — сторожевую полисистему плазмы.
Химаза мастоцитов - мощный усилитель экссудации: разрушает протеогликаны и ↑проницаемость сосудов и базальных мембран;стимулирует продукцию бронхиальной слизи.
* Базофилы крови
Выделяют при анафилаксии кинин-активирующую протеазу — аналог триптазы.
Триптаза и химаза мастоцитов расщепляют ВИП, лишая бронхи основного дилатирующего пептидного медиатора.
Мастоцитарно-базофильная эстераза способствует спазму ГМК и ↑ проницаемости сосудов при анафилаксии.
Высв-ся хемоаттрактанты, биогенные амины-гистамин и серотонин -сокращение ГМК воздухоносных путей или кишки,
расширение мелких кровеносных сосудов и ↑ их проницаемости для воды и белков плазмы,
секрецию густой вязкой слизи.
В коже - стимуляция своб-х полимодальных ноцирецепторов, возникает боль, зуд.
· Поздняя фаза
4-48 ч после введения аллергена, достигает максимума к 6-12ч и характеризуется участием медиаторов второго порядка, противовоспалительных регуляторов, а также важной ролью эозинофилов.
* Эозинофилы:
- фагоцитируют выделяемые тканевыми базофилами секреторные гранулы, содержащие гистамин
- гистаминаза нейтрализует гистамин, что ↓ интенсивность воспаления и препятствует дальнейшему привлечению ЭФ в очаг
- Pg Ε1 или Pg E2 тормозят дегрануляцию тканевых базофилов
- Фосфолипазы В и D разрушают ФАТ.
- Арилсульфатаза, пероксидаза, перекись водорода инактивируют лейкотриены
* СТМ:
- гепарин
* СЛМ, базофилы :
- хондроитинсульфаты А, С, D, Е тормозят экссудацию и активность сторожевой полисистемы плазмы, связывают гистамин, способствуют репарации.
Разнообразие.
Анафилаксия может проявляться
· местно: крапивница, вазомоторный ринит, атопическая бр.астма, ЖКТ расстройства, отек Квинке и пр.
· системно – анаф.шок.
Пробы анафилактических реакций:
· накожные волдырные пробы с АГ
· прямая р-я Шелли — дегрануляция реагин-сенсибилизированных мастоцитов в присутствии аллергена
· радиоиммуносорбционный тест: основан на конкурентном иммуноферментном или радиоиммунном принципе (определение общего IgE)
· радиоаллергосорбционный тест (определение специфических, по отношению к избранному аллергену, IgE).
В норме в ответ на некоторые антигены в организме образуется IgE в ничтожных количествах.
Единственный пример участия IgE в целесообразном иммунном ответе- иммунологичсекое реагирование на внутритканевых паразитов.
Связь между гельминтозами и анафилаксией через IgE - зависимые эозинофильно-базофильные реакции имеет практическое значение в диф.диагностике бронхиальной астмы.
Общебиологический смысл анафилаксии –против чужеродных АГ. С точки зрения филогенетического подхода, анафилаксия может считаться результатом ошибок иммунной системы, путающей сходные или идентичные АГ гельминтов и других экзоаллергенов.
64. Цитотоксические реакции.
Относятся к ГНТ II типа. ЦР опосредованы АТ к поверхностным АГ клетки или АТ к АГ, вторично связанным с клеточной поверхностью. Главную роль играют Ig M и G, способные активировать комлемент. АТ взаимодействуют с клеткой Fab-фрагментов, то есть мишенью становится именно клеточный рецептор, а не АТ выполняет эту роль.
ЦР протекают по следующему механизму:
1. Стадия иммунных реакций. В ответ на появление аутоаллергенов начинается выработка аутоантител IgG- и ^М-классов.
2. Стадия биохимических реакций. Выделяют 3 типа ее реализации:
a. Комплементзависимый цитолиз. Комплексы АГ+АТ, фиксированные на поверхности измененной клетки, присоединяют и активируют комплемент (по классическому пути). Конечным этапом этой активации является образование медиаторов - компонентов комплемента: С4в2а3в; С3а; С5а; С567; С5678; С56789, лизирующих клетки.
b. Опсоническое действие цитотоксических АТ и фрагментов активированного комплемента ( C3b и С3d), запускающее фагоцитоз клеток-мишеней или фрустрированный фагоцитоз с экзоцитозом медиаторов (для крупных или фиксированных в ткани объектов).
c. АТ способны опосредовать прикрепление К-клеток к клеткам-мишеням и повреждать их путем антителозависимой клеточной цитотоксичности (АЗКЦ). АЗКЦ имеет 2 стадии: специфическую ( присоединение Fab к АГ) и неспецифическую ( активация клеток, несущих рецептор к Fc, таких как макрофаги, лимфоциты, моноциты, гранулоциты). МФ, К-клетки, а при противоопухолевых реакциях - и NK-клетки могут оказать цитотоксический эффект без поглощения мишени (перфоринободобный механизм). АЗКЦ имеет значение при ряде аутоиммунных заболеваний, анитопухолевом иммунитете, паразитарных и вирусных заболеваниях и при реакции отторжения трансплантата.
3. Стадия клинических проявлений. Конечным звеном комплемент- и антителозависимой цитотоксичности служат повреждение и гибель клеток с последующим удалением их путем фагоцитоза.
Переливание несовместимой крови по системе АВ0. Обычно в сыворотке человека уже содержится высокий титр АТ против АГ системы АВ0, которые отсутствуют на эритроцитах индивида. Эти АТ - IgM, обладающие высокой комплементсвязывающей способностью. Они провоцируют цитотоксическую реакцию, сопровождающуюся агглютинацией эритроцитов, микротромбозом, внутрисосудистым гемолизом, гипербилирубинемией, гиперкалиемией и анафилактическим шоком.
Гемолитическая болезнь новорожденных или эритробластоз плода. Вызывается несовместимостью плода и матери по резус-фактору. Обычно резус-отр индивиды не вырабатывают антитела к D-антигену. Но при беременности резус-пол плодом возможна сенсибилизация ее организма эритроцитами плода. Антирезусные антитела относятся к IgG. Они могут проходить через плаценту, связываться с АГ и активировать комплемент, чаще при повторной беременности. При АВ0-конфликтах IgM вызывают последствия только при поврежденной плаценте, в других случаях не могут попасть к плоду.
Аутоиммунные гемолитические анемии (АГА). Вырабатываются IgM и IgG. АГА могут быть первичными (самостоятельными) и вторичными (вызванные инфекциями, лекарствами и тд).
При холодовых АГА вырабатывается IgM. Аутоиммунный реакция происходит в ответ на полисахаридные эритроцитарные антигены. Также холодовая АГА может быть опосредована битермическим IgG, который связывает комплемент при пониженной температуре, но лизис эритроцитов идет при нормальной. Характеризуется нарушением микроциркуляции в дистальных отделах конечностей из-за агглютинации эритроцитов при переохлаждении.
Тепловые АГА вызваны IgG, направленными против с-эпитопа резус-антигена, с преобладанием АТопосредованного фагоцитоза эритроцитов, анемией, внутриклеточным гемолизом и гепатоспленомегалией..Тест Кумбса положителен при любых иммунных-гемолитических анемиях, вызванных IgG.
Возможны и лекарственные гетероиммунные гемоцитопении. Некоторые молекулярные вещества (например, определенные медикаменты), обладая аффинностью к мембране Er, способны стать иммуногенными и вызвать образование АТ и последующее развитие гемолитической анемии как гаптены( хинин, фенацетин, сульфаниламиды, салицилаты, стрептомицин, пенициллин). Объектом цитотоксического действия могут стать и другие ФЭК: гранулоциты, тромбоциты (агранулоцитоз, тромбоцитопения). Мех-мы лекар-й аутоиммунной цитопении мб иными. Лекарство α-метил-ДОПА нередко вызывает тепловую IgG-опосредованную ГА у лиц, лечащихся от гипертензии, нарушая супрессорные функции лимфоцитов→усиление выработки тепловых гемолизинов против эпитопов Rh, аналогичных АТ, вызывающим тепловую ГА. Сходным образом, аутоиммунную гемолитическую анемию могут вызывать противотуберкулёзные препараты, хинин и хинидин, цефалоспорины, пенициллин и фенацетин. Лекарственные гемоцитопении — частный случай лекарственной аллергии, под которой понимают гиперчувствительность, вызванную медикаментами и продуктами их превращения в организме. Своеобразным органоспецифическим аутоиммунным гематологическим заболеванием является аутоиммунная пернициозная мегалобластическая анемия Аддисона-Бирмера. При этом нарушении первичным служит аутоиммунный атрофический гастрит, вызванный блокирующим и цитостатическим эффектом аутоАТ к компонентам водородного насоса и/ или гастринового рецептора обкладочных клеток слизистой желудка. Реже возникают аутоАТ к самому гастромукопротеину — фактору Касла. В результате атрофии слизистой желудка и угнетения продукции гастромукопротеина Касла нарушается всасывание перорального витамина В12. Таким образом, картина анемии — мегалобластическая, хотя ее патогенез — аутоиммунный. Распространенным и практически важным примером служит хроническая рецидивирующая аутоиммунная тромбоцитопеническая пурпура (болезнь Верльгофа), при которой более чем у 70% больных отмечаются аутоантитела IgG к поверхностному гликопротеиду Tr. Цитотоксические реакции при органоспецифических аутоиммунных заболеваниях. Ведущая роль в патогенезе таких органоспецифических поражений, как инсулинозависимый сахарный диабет, симпатическая офтальмия, факогенный увеит, аутоиммунные апластические анемии, синдром Шихана, вульгарная пузырчатка. При некоторых формах диффузного гломерулонефрита у человека (хронический мембранозный гломерулонефрит, болезни Шенляйн-Геноха) и при экспериментальных нефритах Хэймена у животных имеются цитотоксические комплементзависимые реакция против белков трансцитотических пузырьков, либо щеточной каймы эпителия клубочков, или, наконец, белков эндотелия клубочков.Большое значение имеют аутоиммунные цитотоксические реакции против внеклеточных фиксированных антигенов. В этом случае абсолютная органоспецифичность утрачивается. Так, цитотоксические IgG обуславливают клеточную и комплементзависимую реакцию против коллаген-ассоциированного гликопротеида базальных мембран клубочков почек при злокачественном подостром гломерулонефрите с полулуниями у человека. При болезни Шенляйн-Геноха аутоиммунный цитотоксический процесс повышает порозность базальных мембран капилляров, что ведет к вазопатии, а у 30% больных может дополняться нефропатией.Так называемое сверхострое отторжение трансплантата (при несовместимости по АГ ГКГС I класса и по экспрессируемым в почках антигенам АВ0) также является не реакцией ГЗТ, как другие формы транспл-ного иммунитета, а органоспецифичной цитотоксической реакцией. Диагностика цит-х р-й требует открытия и измерения титров спец-х цирк-х АТ. Это достигается на основе реакции связывания комплемента, или менее чувствительных реакций: непрямой гемагглютинации по П. Бойдену (ΡΗΓΑ), иммунопреципитации, и иммунодиффузии.
65. Особенности действия аутоантител к клеточным рецепторам. Деструктивные и недеструктивные последствия воздействия противорецепторных антител и их роль при патологии. Примеры недеструктивных дисрегуляторных аутоимунных реакций при различных болезнях.
Действие противоклеточных антител и аутоантител при цитологических реакциях не обязательно ведет к альтерации клетки-мишени и окружающих тканей. Антитела, направленные против клеточных рецепторов будут подвергаться быстрой интернализации (после связывания лиганда многие рецепторы путем эндоцитоза убираются внутрь клетки) и ускользать от взаимодействия с гуморальными и клеточными агентами альтерации (активация иммунных комплексов, опсоническое действие цитотоксических АТ и фрагментов активированного комплемента), действие которых активируют иммуноглобулины, остающиеся на клеточной поверхности.
Термин «цитотоксические» неприложим к подобным недеструктивным реакциям, хотя их механизмы и имеют много общего с гиперергическими реакциями 2-го типа (опосредована АТ – IgG , IgM (?),которые взаимодействуют с АГ Fab -фрагментом). Для обозначения этих процессов в норме использую термин «циторегулирующие реакции», а для их патологических проявлений обозначение «дисрегуляторные реакции».
Деструктивные последствия: Антитела к рецепторам могут ингибировать связывание природного лиганда с рецептором, нарушать ионный транспорт через рецептор, ускорять деградацию рецепторов — во всех этих случаях их действие на рост или на функцию клеток будет блокирующим.
Недеструктивные последствия: Когда действие антирецепторных антител на клетку является замещение иммуноглобулином функций лиганда (частичное либо полное, длительное либо кратковременное). Клинически при этом наблюдается гиперфункций и/или гиперплазия клеток-мишеней. Антитела могут, например, вызвать гиперпродукцию гормона или секрета, ускорение деления клеток или индукцию гипертрофических изменений в клетках, не вступающих в митоз.
Сейчас получены антирецепторные или антиядерные иммуноглобулины, имитирующие полностью или частично эффекты пролактина, эпидермального фактора роста, инсулина и вазопрессина, АКТГ, ТТГ и либеринов гипоталамуса, инсулиноподобного фактора роста.
Примеры недеструктивных дисрегуляторных аутоимунных реакций при различных болезнях:
| Заболевания | Аутоантитела к - |
| Анемия Аддисона-Бирмера с атрофическим гастритом (перинциозная анемия) | гастриновому рецептору и водородному насосу обкладочных клеток |
| Паркинсонизм | Дофаминергические рецепторы |
| Миастения Гравис | никотинхолинэргическому рецептору моторных бляшек |
| Синдром Ламберта-Итона | пресинаптической мембране моторных нервных окончаний |
| Синдром хронической усталости | Мускарин-холинергическому рецептору |
| Апластическая анемия | эритропоэтину, его рецептору и эритроидным клеткам предшественникам |
| Аллергический ренит, некоторые формы астматического бронхита | 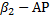
|
| Синдром резистентного яичника | Рецептору ФСГ |
| Гастрит А и некоторые случаи язвенной болезни 12-перстной кишки и желудка | Н2-гистаминовому рецептору слизистой желудка |
| Неспецифический язвенный колит | Перекрестно-реагирующий с кишкой АТ к E. coli |
| Б-нь Аддисона | Стероидгидроксилазам и рецептору АКТГ |
66.Этиология и патогенез иммунокомплексных реакций, их роль при патологии. Судьба иммунных комплексов в норме. Причины задержки катаболизма и нарушение клиренса комплексов при патологии. Особенности генетической предрасположенности и механизмов ответной реакции при иммунокомплексных реакциях. Разновидности иммунокомплексных реакций. Сравнительная характеристика и примеры иммунокомплексных реакций разных подтипов при болезнях.
1. Судьба иммунных комплексов (ИК) в норме
Иммунные комплексы – естественная часть любого гуморального иммунного ответа. В норме их цель – связать растворимые антигены, появившиеся в крови, и обеспечить их выведение из организма. Поэтому любое возникновение иммунного комплекса должно закончиться его элиминацией.
Есть два способа инактивации и физиологического разрушения ИК:
1. В селезёнке и печени ИК поедаются макрофагами. В кровотоке циркулирующие ИК взаимодействуют С3b фрагментом комплемента, оседающего на иммуноглобулинах, с CR1 рецептором эритроцитов, фиксируются на них, и на таком виде транспорта добираются до этих органов, где их обоих фагоцитируют за счет взаимодействия с Fc-фрагментом комплекса макрофагального CD16-рецептора
2. ИК могут захватываться макрофагами непосредственно в токе крови через факторы комплемента, и тоже фагоцитироваться.
Дата добавления: 2019-03-09; просмотров: 789; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
