Энтропия. Вычисление энтропии идеального газа.
Энтропия – это функция состояния системы (S)(S) с дифференциалом в бесконечном обратимом процессе, равным dS=δQTdS=δQT.
Параметр δQδQ обозначает элементарное тепло, которое сообщается системе. Соответственно, TT – это общая температура системы.
Если у системы в обратимом процессе изменяется знак энтропии, то это говорит о смене направления обмена теплом. Основная формула дает нам возможность найти, на сколько изменилась величина энтропии. Важно подчеркнуть, что она будет верной только в том случае, если процесс будет обратим.
Вычисление
Формулы для вычисления изменения энтропии идеального газа могут быть получены из уравнения первого закона термодинамики: 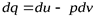
В процессе при v=const , в котором тело не совершает внешней работы 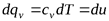
Или, заменив Р на 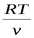 из уравнения Клапейрона, получим
из уравнения Клапейрона, получим 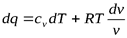
Разделив обе части последнего уравнения на Т, имеем: 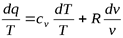
Так как 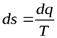 , то
, то
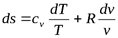 (5.1)
(5.1)
Интегрируя (5.1) при cv=const, найдем
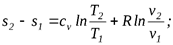
Таким образом, получено уравнение для вычисления энтропии как функции температуры и удельного объема 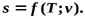
Для получения изменения энтропии как функции температуры и давления 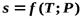 следует из уравнения (5.1) исключить
следует из уравнения (5.1) исключить 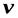 .
.
Из уравнения Клапейрона после дифференцирования получаем
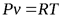 ;
; 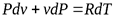 ;
; 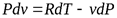 .
.
Так как 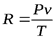 ,то
,то
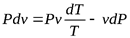
Или, разделив на 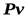 :
:
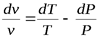 .
.
Подставляя из последнего выражения 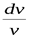 в уравнение (5.1) и учитывая, что из уравнения Майера
в уравнение (5.1) и учитывая, что из уравнения Майера 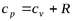 , найдем:
, найдем:
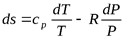 . (5.2)
. (5.2)
Интегрируя последнее уравнение при 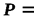 const, получаем выражение для определения изменения энтропии как функции температуры и давления
const, получаем выражение для определения изменения энтропии как функции температуры и давления
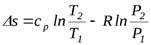 .
.
Для получения изменения энтропии как функции давления и удельного объема следует из уравнения (5.2) исключить 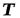 .
.
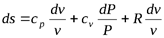 ;
; 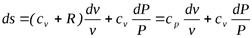 ;
;
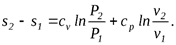 (5.3)
(5.3)
Второе начало термодинамики.
Термодинамика – это наука о тепловых процессах, о превращении тепловой энергии. Для описания термодинамических процессов первого начала термодинамики недостаточно. Выражая общий закон сохранения и превращения энергии, первое начало не позволяет определить направление протекания процессов.
Второе начало термодинамики имеет несколько формулировок:
1) (Формулировка Клаузиуса) невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
2) (Формулировка Томсона) невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды.
3) (Формулировка Больцмана) Энтропия не может уменьшаться в замкнутых системах — то есть, в системах, не получающих внешней энергетической подпитки.
Энтропия — это показатель неупорядоченности системы.
Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему.
Третью формулировку можно рассмотреть как она работает, на примере воды. В жидком состоянии вода представляет собой довольно неупорядоченную структуру, поскольку молекулы свободно перемещаются друг относительно друга, и пространственная ориентация у них может быть произвольной. Другое дело лед — в нем молекулы воды упорядочены, будучи включенными в кристаллическую решетку. Формулировка второго начала термодинамики Больцмана, условно говоря, гласит, что лед, растаяв и превратившись в воду (процесс, сопровождающийся снижением степени упорядоченности и повышением энтропии) сам по себе никогда из воды не возродится.
Дата добавления: 2019-02-22; просмотров: 934; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
