Если разность хода равна нечетному числу полуволн, то в данной точке экрана будет наблюдаться минимум интенсивности при интерференции.
22. Сложение гармонических колебаний одного направления с разными частотами. Биения. Период биений, время когерентности.
Гармонические колебания — колебания, при которых колеблющаяся величина изменяется со временем по закону синуса (косинуса).
Колеблющееся тело может участвовать в нескольких колебательных процессах, тогда необходимо найти результирующее колебание, иными словами, колебания необходимо сложить.
Рассмотрим случай, когда складываемые гармонические колебания имеют одинаковые направления, но разные частоты.
На векторной диаграмме колебаний слагаемые векторыА1 и А2 вращаются с разными угловыми скоростями, в результате чего угол между ними с течением времени изменяется.

В итоге изменяется и результирующая амплитуда A
Пусть слагаемые колебания имеют циклические частоты ω01 и ω02 .
В качестве начального момента времени можно взять такой, при котором начальные фазы обоих колебаний одинаковы.
Уравнения колебаний в этом случае имеют вид:

Найдем разность фаз слагаемых колебаний и подставим в формулу для квадрата амплитуды

Как видим, амплитуда A результирующего колебания изменяется с течением времени с некоторой частотой.
Угловая скорость вращения результирующего вектора А при этом непостоянна, а результирующее движение не является гармоническим колебанием.
Вызывает интерес результат сложения двух колебаний, круговые частоты которых очень мало отличаются друг от друга, а амплитуды равны (А1=А2 ).
Считая, что в формуле




Поэтому результирующее колебание можно рассматривать как гармоническое, совершаемое с круговой частотой
(ω01+ω02)/2
амплитуда которого медленно периодически изменяется с течением времени. Такие колебания называются биениями


Когерентностью называется согласованное протекание двух или нескольких колебательных или волновых процессов
Время когерентности – время, по истечении которого разность фаз волны в некоторой, но одной и той же точке пространства измен
23 . Резонансные кривые для амплитуды скорости и ускорения.
Установление колебаний.
Общей чертой вынужденных колебаний, происходящих под действием периодической внешней силы, является то, что спустя некоторое время после начала действия внешней силы система полностью «забывает» свое начальное состояние, колебания приобретают стационарный характер и не зависят от начальных условий. Начальные условия проявляются только в период установления колебаний, который обычно называют переходным процессом.
Синусоидальное воздействие.
Рассмотрим вначале наиболее простой случай вынужденных колебаний осциллятора под действием внешней силы, изменяющейся по синусоидальному закону.

Такое внешнее воздействие на систему можно осуществить различными способами. Например, можно взять маятник в виде шарика на длинном стержне и длинную пружину с малой жесткостью и прикрепить ее к стержню маятника недалеко от точки подвеса, как показано на рис. 178. Другой конец горизонтально расположенной пружины следует заставить двигаться по закону В с помошью кривошипно-шатунного механизма, приводимого в движение электромотором. Действующая на маятник со стороны пружины вынуждающая сила будет практически синусоидальна, если размах движения левого конца пружины В будет много больше амплитуды колебаний стержня маятника в точке закрепления пружины.
Резонансные кривые.
Амплитуда установившихся вынужденных колебаний пропорциональна амплитуде вынуждающей силы. Исследуем зависимость амплитуды колебаний от частоты со вынуждающей силы. При малом затухании у эта зависимость имеет очень резкий характер. Если, то при стремлении со к частоте свободных колебаний амплитуда вынужденных колебаний а стремится к бесконечности, что совпадает с полученным ранее результатом. При наличии затухания амплитуда колебаний в резонансе уже не обращается в бесконечность, хотя и значительно превышает амплитуду колебаний под действием внешней силы той же величины, но имеющей частоту, далекую от резонансной. Резонансные кривые при разных значениях постоянной затухания у приведены на рис

Для нахождения частоты резонанса сорез, нужно найти, при каком со подкоренное выражение в формуле имеет минимум. Приравнивая производную этого выражения по со нулю или дополняя его до полного квадрата, убеждаемся, что максимум амплитуды вынужденных колебаний имеет место при Резонансная частота оказывается меньше частоты свободных колебаний системы. При малых у резонансная частота практически
совпадает. При стремлении частоты вынуждающей силы к бесконечности при , амплитуда а, как видно, стремится к нулю при действии постоянной внешней силы. Это есть статическое смещение осциллятора из положения равновесия под действием постоянной силы.Максимальная амплитуда. Амплитуду вынужденных колебаний в резонансе находим, подставляя частоту из в выражение.Амплитуда колебаний в резонансе тем больше, чем меньше постоянная затухания. При изучении вынужденных колебаний вблизи резонанса трением пренебрегать нельзя, как бы мало оно ни было: только при учете затухания амплитуда в резонансе яре, получается конечной.Интересно сравнить значение со статическим смещением под действием силы. Составляя отношение, получаем при малом затуханииПодставляя сюда и учитывая, что есть время жизни собственных затухающих колебаний для той же системы в отсутствие внешних сил, находимНо есть число колебаний, совершаемых затухающим осциллятором за время жизни колебаний. Таким образом, резонансные свойства системы характеризуются тем же параметром, что и собственные затухающие колебания.Фазовые соотношения. Формула дает возможность проанализировать изменение сдвига фазы между внешней силой и смещением, при вынужденных колебаниях. При значение д близко к нулю. Это означает, что при низких частотах смещение осциллятора происходит в фазе с внешней силой. При медленном вращении кривошипа на рис. 178 маятник движется в такт с правым концом шатуна.Если стремится к нулю со стороны отрицательных значений,сдвиг фазы равен и смещение осциллятора происходит в противофазе с вынуждающей силой. В резонансе, как видно из, смещение отстает по фазе от внешней силы. Вторая из формул показывает, что при этом внешняя сила изменяется в фазе со скоростью все время действует в направлении движения. Что именно так и должно быть, ясно из интуитивных соображений.Резонанс скорости. Из формулы видно, что амплитуда колебаний скорости при установившихся вынужденных колебаниях равна. С помощью получаемЗависимость амплитуды скорости от частоты внешней силы показана на рис. 184. Резонансная кривая для скорости хотя и похожа на резонансную кривую для смещения, но отличается от нее в некоторых отношениях. Так, при при действии постоянной силы, осциллятор испытывает статическое смещение из положенияравновесия и скорость его после того, как закончится переходный процесс, равна нулю. Из формулы видно, что амплитуда скорости при обращается в нуль. Резонанс скорости имеет место при точном совпадении частоты внешней силы с частотой свободных колебаний.

Рис. 184. Амплитуда скорости при установившихся вынужденных колебаниях
24. Статистический и термодинамический методы исследования. Равновесные состояния и процессы. Молекулярно-кинетическая теория идеального газа. Основное уравнение молекулярно-кинетической теории идеального газа. Закон Дальтона. Температура. Связь температуры со скоростью движения молекул.
Для исследования физических свойств макроскопических систем, связанных с огромным числом содержащихся в них атомов и молекул, применяют2 качественно различных и взаимно дополняющих друг друга метода.
Статистический—метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними значениями физических величин, характеризующих всю систему. Этот метод лежит в основе молекулярной физики,изучающего строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из атомов, молекул или ионов находящихся в непрерывном хаотическом движении.
Термодинамический — метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (например, давление, объем, температура) при различных превращениях энергии, происходящих в системе, не учитывая при этом внутреннего строения изучаемых тел и характера движения отдельных частиц. Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
В основу МКТ положена модель идеального газа, для которого считаются справедливыми следующие утверждения:
– микрочастицы движутся хаотически и подчиняются законам механики;
– хаотичность движения означает, что система – газ изотропна во всех направлениях по своим характеристикам и свойствам. Например, если для какого-либо направления определена средняя скорость частиц газа, то она одинакова для всех направлений;
– размер микрочастиц много меньше расстояния между ними, и поэтому частицы представляются материальными точками, взаимодействие частиц происходит только при их столкновениях, которые подчиняются условиям упругих столкновений в механике;
– абсолютно упругий характер взаимодействия распространяется и на взаимодействие микрочастиц газа с другими макротелами, например, стенками сосуда;
– давление в МКТ есть результат изменения импульса микрочастиц газа при упругом столкновении со стенками сосуда;
– температура в МКТ характеризует скорость теплового движения молекул;
– внутренняя энергия в МКТ есть суммарная энергия теплового хаотического поступательного движения.
Основное уравнение молекулярно-кинетической теории связывает параметры состояния газа с характеристиками движения его молекул, т. е. устанавливает зависимость между давлением и объемом газа и кинетической энергией поступательного движения ег 
о молекул.
 ТЕМПЕРАТУРА Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
ТЕМПЕРАТУРА Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия. Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин).
Связь температуры в энергетических единицах и температуры в градусах Кельвина:

где k = 1,38*10 -23 Дж/К - постоянная Больцмана.
Связь абсолютной шкалы и шкалы Цельсия:
T = t + 273 где t - температура в градусах Цельсия.
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:

Средняя квадратичная скорость молекул

25. Параметры состояния. Законы идеального газа.
Идеальным газом называется газ, при рассмотрении свойств которого соблюдаются следующие условия:
1) соударения молекул такого газа происходят как соударения упругих шаров, размеры которых пренебрежимо малы; 2) от столкновения до столкновения молекулы движутся равномерно и прямолинейно; 3) пренебрегают силами взаимодействия между молекулами.
Реальные газы при комнатной температуре и нормальном давлении ведут себя как идеальные газы. Идеальными газами можно считать такие газы как гелий, водород, свойства которых уже при обычных условиях отвечают закономерностям идеального газа.
Состояние некоторой массы идеального газа будет определяться значениями трех параметров: P, V, T. Эти величины, характеризующие состояние газа, называются параметрами состояния. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Эта связь аналитически может быть задана в виде функции:
 Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Рассмотрим некоторые из параметров состояния, характеризующих состояние газа:
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Рассмотрим некоторые из параметров состояния, характеризующих состояние газа:
 Для однозначного определения температурной шкалы необходимо условиться, кроме способа градуировки, также о выборе термометрического тела (т.е. тела, которое выбирается для измерения) и температурного признака.
Известны две температурные шкалы:
1) t – эмпирическая или практическая шкала температур (°C). (О выборе термометрического тела и температурного признака для этой шкалы скажем позже).
2) T – термодинамическая или абсолютная шкала (°K). Эта шкала не зависит от свойств термодинамического тела (но об этом речь пойдет позже).
Температура T, отсчитанная по абсолютной шкале, связана с температурой t по практической шкале соотношением
T = t + 273,15.
Единицу абсолютной температуры называют Кельвином. Температуру по практической шкале измеряют в град. Цельсия (°C). Значения град. Кельвина и град. Цельсия одинаковы. Температура равная 0°K называется абсолютным нулем, ему соответствует t=-273,15°C
Газовые законы.
Если разрешить уравнение состояния идеального газа
Для однозначного определения температурной шкалы необходимо условиться, кроме способа градуировки, также о выборе термометрического тела (т.е. тела, которое выбирается для измерения) и температурного признака.
Известны две температурные шкалы:
1) t – эмпирическая или практическая шкала температур (°C). (О выборе термометрического тела и температурного признака для этой шкалы скажем позже).
2) T – термодинамическая или абсолютная шкала (°K). Эта шкала не зависит от свойств термодинамического тела (но об этом речь пойдет позже).
Температура T, отсчитанная по абсолютной шкале, связана с температурой t по практической шкале соотношением
T = t + 273,15.
Единицу абсолютной температуры называют Кельвином. Температуру по практической шкале измеряют в град. Цельсия (°C). Значения град. Кельвина и град. Цельсия одинаковы. Температура равная 0°K называется абсолютным нулем, ему соответствует t=-273,15°C
Газовые законы.
Если разрешить уравнение состояния идеального газа
 относительно какого-либо из параметров, например, p, то уравнение состояния примет вид
относительно какого-либо из параметров, например, p, то уравнение состояния примет вид
 .
Законы Бойля-Мариотта и Гей-Люссака дают уравнения состояния для случаев, когда один параметров остается постоянным. Эти законы были установлены на опытах с газами, находящимися в условиях, не очень сильно отличающихся от нормальных атмосферных условий, т.е. при не очень низких температурах и не очень высоких давлениях. При иных условиях экспериментальные газовые законы уже не точно отражают свойства газов, т.е. все эти законы являются приближенными.
Рассмотрим некоторые из этих законов:
1) Закон Бойля-Мариотта (m = const, T = const).
Для данной массы газа при постоянной температуре (T = const) давление газа изменяется обратно пропорционально объему.
Аналитически это можно записать в виде: P·V = const (T = const). Совокупность состояний, отвечающих одной и той же температуре, изобразится на диаграмме (P, V) кривой, определяемой уравнением гиперболы. Каждому значению температуры соответствует своя кривая, называемая изотермой. А переход газа из одного состояния в другой, совершающийся при постоянной температуре, называется изотермическим процессом.
2) Закон Гей-Люссака (m = const, P = const).
Для данной массы газа при постоянном давлении объем газа меняется линейно с ростом температуры: .
Законы Бойля-Мариотта и Гей-Люссака дают уравнения состояния для случаев, когда один параметров остается постоянным. Эти законы были установлены на опытах с газами, находящимися в условиях, не очень сильно отличающихся от нормальных атмосферных условий, т.е. при не очень низких температурах и не очень высоких давлениях. При иных условиях экспериментальные газовые законы уже не точно отражают свойства газов, т.е. все эти законы являются приближенными.
Рассмотрим некоторые из этих законов:
1) Закон Бойля-Мариотта (m = const, T = const).
Для данной массы газа при постоянной температуре (T = const) давление газа изменяется обратно пропорционально объему.
Аналитически это можно записать в виде: P·V = const (T = const). Совокупность состояний, отвечающих одной и той же температуре, изобразится на диаграмме (P, V) кривой, определяемой уравнением гиперболы. Каждому значению температуры соответствует своя кривая, называемая изотермой. А переход газа из одного состояния в другой, совершающийся при постоянной температуре, называется изотермическим процессом.
2) Закон Гей-Люссака (m = const, P = const).
Для данной массы газа при постоянном давлении объем газа меняется линейно с ростом температуры:  , где V – объем газа при температуре t°; V0 – объем газа при 0°C; a – термический коэффициент объемного расширения ( , где V – объем газа при температуре t°; V0 – объем газа при 0°C; a – термический коэффициент объемного расширения (  ).
Термический коэффициент объемного расширения показывает, на какую часть относительно первоначального объема изменится объем газа при его нагреве на 1°. Для большинства газов ).
Термический коэффициент объемного расширения показывает, на какую часть относительно первоначального объема изменится объем газа при его нагреве на 1°. Для большинства газов  .
Процесс, протекающий при постоянном давлении, называется изобарическим. Для газа такой процесс отобразится на диаграмме (V, t°) прямой; здесь различные прямые отвечают разным давлениям и называются изобарами.
26. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы. Теплоемкость идеального газа и кристаллической решетки. .
Процесс, протекающий при постоянном давлении, называется изобарическим. Для газа такой процесс отобразится на диаграмме (V, t°) прямой; здесь различные прямые отвечают разным давлениям и называются изобарами.
26. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы. Теплоемкость идеального газа и кристаллической решетки.
|
Итак, средняя энергия приходящаяся на одну степень свободы:

|
У одноатомной молекулы i = 3, тогда для одноатомных молекул

|
для двухатомных молекул

|
я трёхатомных молекул

|
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится

|
Это и есть закон Больцмана оравномерном распределении средней кинетической энергии по степеням свободы.
Если система находится в состоянии термодинамического равновесия, при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы. На каждую поступательную iп и вращательную iвр степени свободы приходится энергия 1/2 kT. Для колебательной iкол, степени свободы она равна kT. Таким образом число степеней свободы i = iп + iвр + 2iкол
Закон о равномерном распределении энергии по степеням свободы перестает быть справедливым при квантовом описании системы частиц, когда каждому квантовому состоянию системы с i-степенями свободы соответствует ячейка объемом hi в фазовом пространстве “координаты – импульсы” тождественных (неразличимых между собой) частиц, где h – постоянная Планка (М. Планк (1858-1947) – немецкий физик–теоретик).
При этом энергии вращения и колебания молекул принимают дискретные значения или говорят, что они квантуются. Энергия колебания молекулы (как квантового гармонического осциллятора равна
Eкол = (1/2+n) hv,
где v – собственная частота колебаний; n = 0,1,2,… - квантовое число.
Энергия Eкол при n = 0, равная E0 = 1/2 hv, называется нулевой колебательной энергией (энергией нулевых колебаний). Разность энергий ΔEколмежду соседними уровнями энергии равна hv. Энергия вращательного движения молекулы зависит от её вида. Для двухатомной молекулы с жесткой связью эта энергия имеет вид Евр = 
Где I – момент инерции молекулы вокруг оси, проходящей через центр инерции молекулы; l = 0,1,2,… - вращательное квантовое число. Расстояние между соседними уровнями энергии вращения ΔEвр приблизительно в тысячу раз меньше ΔEкол
Для двухатомных молекул:

|
для трехатомных молекул:
 . .
|
В общем случае для молярной массы газа
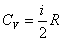 . .
| (4.4.6) |
 . .
| (4.4.7) |
Для произвольного количества газов:
 , ,
| (4.4.8) |
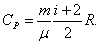 . .
| (4.4.9) |
Из теории также следует, что СV не зависит от температуры (рис. 4.4).

Рис. 4.4
Для одноатомных газов это выполняется в очень широких пределах, а для двухатомных газов только в интервале от 100 до 1000 К. Отличие связано с проявлением квантовых законов. При низких температурах вращательное движение как бы «вымерзает» и двухатомные молекулы движутся поступательно, как одноатомные; равны их теплоёмкости.
При увеличении температуры, когда Т > 1000 К, начинают сказываться колебания атомов молекулы вдоль оси z (атомы в молекуле связаны не жёстко, а как бы на пружине). Одна колебательная степень свободы несет  энергии, так как при этом есть и кинетическая, и потенциальная энергия, то есть появляется шестая степень свободы – колебательная. При температуре равной 2500 К, молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри него.
энергии, так как при этом есть и кинетическая, и потенциальная энергия, то есть появляется шестая степень свободы – колебательная. При температуре равной 2500 К, молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри него.
Теплоёмкость идеального газа
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
|
Во многих случаях удобно использовать молярную теплоемкость C:
|
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:

|
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
| pV = RT, |
где R – универсальная газовая постоянная. При p = const
 или или 
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| Cp = CV + R. |
Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом (рис. 3.10.1).

|
| Рисунок 3.10.1. Два возможных процесса нагревания газа на ΔT = T2 – T1. При p = const газ совершает работу A = p1(V2 – V1). Поэтому Cp > CV |
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
|
В частности, это отношение входит в формулу для адиабатического процесса (см. §3.9).
Между двумя изотермами с температурами T1 и T2 на диаграмме (p, V) возможны различные пути перехода. Поскольку для всех таких переходов изменение температуры ΔT = T2 – T1 одинаково, следовательно, одинаково изменение ΔU внутренней энергии. Однако, совершенные при этом работы A и полученные в результате теплообмена количества теплоты Q окажутся различными для разных путей перехода. Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей.

|
| Модель. Теплоемкости идеального газа |
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса ΔT = 0, поэтому CT = ∞. В адиабатическом процессе ΔQ = 0, следовательно, Cад = 0.
Следует отметить, что «теплоемкость», как и «количество теплоты» – крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII веке. Эта теория рассматривала теплоту как особое невесомое вещество, содержащееся в телах. Считалось, что оно не может быть ни создано, ни уничтожено. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты».
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией  поступательного движения молекул и абсолютной температурой T:
поступательного движения молекул и абсолютной температурой T:

|
Внутренняя энергия 1 моля идеального газа равна произведению  на число Авогадро NА:
на число Авогадро NА:

|
При изменении температуры на ΔT внутренняя энергия изменяется на величину
|
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
|
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.

|
| Рисунок 3.10.2. Модель двухатомной молекулы. Точка Oсовпадает с центром масс молекулы |
На рис. 3.10.2 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула. Каждое независимое движение называется степенью свободы. Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные).
В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
|
где i – число степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i = 3)
|
Для газа, состоящего из двухатомных молекул (i = 5)
|
Для газа, состоящего из многоатомных молекул (i = 6)
|
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле.
Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени свободы. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна:
| U = 3NАkT = 3RT. |
Поэтому молярная теплоемкость вещества в твердом состоянии равна:
|
Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии.
Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений.
Дата добавления: 2019-02-22; просмотров: 359; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!







