Статистическое истолкование второго закона термодинамики.
1. Утверждение второго закона (начала) термодинамики о невозможности убывания энтропии в изолированной системе может быть истолковано статически, на основе молекулярно-кинетической теории строения вещества, с помощью формулы Больцмана:
S=kLnP+const,
где S - энтропия системы, k - постоянная Больцмана, P- термодинамическая вероятность состояния.
2. Термодинамическая вероятность состояния P тела (системы) равна числу всевозможных распределений частиц по координатам и скоростям, соответствующих данному термодинамическому состоянию. По определению, P- есть целое число не меньшее единицы (P≥1) .Из формулы Больцмана вытекает следующее статистическое истолкование второго закона термодинамики: термодинамическая вероятность состояния замкнутой системы при всех происходящих в ней процессах не может убывать.
При любом процессе, который протекает в замкнутой системе и переводит ее из состояния 1 в состояние2. изменение ΔP термодинамической вероятности P положительно или равно нулю:
ΔP=P2-P1≥ 0.
В случае обратимого процесса ΔP =0, т.е. термодинамическая вероятность P-постоянна. Если происходит необратимый процесс, то ΔР>0 и Р возрастает. Это означает, что необратимый процесс переводит систему из менее вероятного состояния в более вероятное, в пределе - равновесное состояние.
Барометрическая формула. Закон Больцмана для распределения частиц во внешнем потенциальном поле.
При выводе основного уравнения МКТ(молекулярно-кинетической теории) предполагалось, что на молекулы не действуют внешние силы, и поэтому молекулы равномерно распределены по объему. Но молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул – с другой, приводят к некоторому стационарному состоянию газа, при котором концентрация молекул и давление газа убывают с высотой.
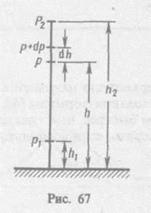
Если температура воздуха T и ускорение свободного падения g не меняются с высотой, то давление воздуха p на высоте h, отсчитанной от некоторого уровня, принятого за начальный, связано с давлением p0 на этом начальном уровне экспоненциальной зависимостью:
p(h)=p0e(-Mgh/RT) (36)
Выражение (36) называется распределением Больцмана, или барометрической формулой. Оно позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту.
Из формулы (36) следует, что давление убывает с высотой тем быстрее, чем тяжелее газ (чем больше его молярная масса M) и чем ниже температура T.
Барометрическую формулу (36) можно преобразовать,
n(h)=n0e(-Mgh/RT), (37)
Где n – концентрация молекул на высоте h, n0 – концентрация молекул на высоте h=0. Так как M=m0NA и k=R/NA, то:
n(h)=n0e(-m0gh/kT), (38)
гдеm0gh - потенциальная энергия одной молекулы в поле тяготения, и:
n(h)=n0e(-П/kT). (39)
Выражение (39) называют законом Больцмана для распределения частиц во внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Среднее число столкновений и средняя длина свободного пробега молекул газа.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь < l >,который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул< l >,
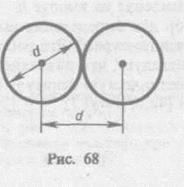
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис. 68). Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости <v>, и если < z> — среднее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега
< l > = < v> / < z>.
Для определения <z> представим себе молекулу в виде шарика. Диаметром d, которая движется среди других «застывших» молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри «ломаного» цилиндра радиусом d (рис. 69).
Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра:
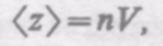
где n — концентрация молекул, 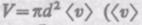 — средняя скорость молекулы или путь, пройденный ею за 1 с). Таким образом, среднее число столкновений
— средняя скорость молекулы или путь, пройденный ею за 1 с). Таким образом, среднее число столкновений 
Расчеты показывают, что при учете движения других молекул 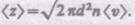
Тогда средняя длина свободного пробега 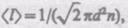
т. е. 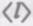 обратно пропорциональна концентрации л молекул. С другой стороны следует, что при постоянной температуре л пропорциональна давлению р. Следовательно,
обратно пропорциональна концентрации л молекул. С другой стороны следует, что при постоянной температуре л пропорциональна давлению р. Следовательно, 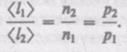
Дата добавления: 2019-02-22; просмотров: 697; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
