ДИАГРАММЫ ДВОЙНЫХ СПЛАВОВ И ИХ АНАЛИЗ
(Практическая работа)
5.1 Цель работы
Ознакомиться с методикой построения диаграмм состояния сплавов, научиться определять фазовый и структурный состав сплава, строить кривые охлаждения с помощью правила фаз Гиббса, определять концентрацию сплава при различных температурах.
5.2 Задание
5.2.1 Изучить справочные данные.
5.2.2 Выполнить работу.
5.2.3 Написать отчёт.
5.3 Оборудование и материалы на рабочем месте
5.3.1 Линейка, карандаш.
5.3.2 Альбомы микроструктур.
5.3.3 Справочные данные.
5.4 План выполнения работы
5.4.1 Дать характеристику основным видам сплавов: механическая смесь, твердый раствор, химическое соединение.
5.4.2 Зависать правило фаз Гиббса, указать его назначение.
5.4.3 Зарисовать диаграммы состояния сплавов, дать им определение. Заполнить все зоны диаграмм.
5.4.4 Построить с помощью привила фаз кривые охлаждения сплавов позаданию преподавателя, выявить критические точки, обозначить их.
5.4.5 Описать процесс кристаллизации.
5.4.6 Зарисовать структуры сплавов.
5.4.7 Определить концентрацию сплавов в заданных точках и, применив правило отрезков, рассчитать количественное соотношение фаз, концентрацию структурных составляющих.
5.4.8 Описать графически связь между типом диаграммы и изменением свойств сплавов по Курнакову.
5.5 Справочные данные
При всем многообразии сплавов различных элементов в процессе кристаллизации и образования структуры выявляется закономерность. Два компонента – исходные элементы сплава, могут образовывать следующие виды соединений:
|
|
|
– механическую смесь;
– твердый раствор;
– химическое соединение.
В случае, когда два компонента образуют механическую смесь, отсутствует способность растворяться в твердом состоянии или образовывать химическое соединение. Структура сплава представляет собой смесь кристаллов, построенных из атомов одного или другого компонента. Кроме этого возможны варианты, когда в структуре наблюдается смесь твердых растворов.
Твердые растворы – это сплавы, в которых атомы растворимого компонента располагаются в кристаллической решетке компонента – растворителя. Различают твердые растворы: замещения и внедрения.
В твёрдом растворе замещения (рисунок 5.1 а) атомы растворителя частично замещены в узлах кристаллической решётки атомами второго компонента.
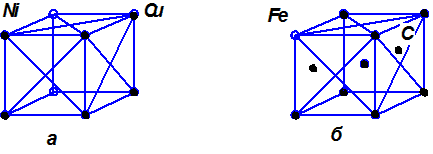
Рисунок 5.1 – Схема кристаллической решётки твёрдых растворов:
а – замещения, б – внедрения
Твёрдые растворы замещения образуют компоненты, имеющие одинаковый тип кристаллической решётки. Если отличие размеров атомных диаметров не превышает 8%, то образуется твердый раствор с неограниченной растворимостью. При отличии параметров на 8–15% растворимость компонентов ограничена.
|
|
|
В твердом растворе внедрения атомы растворенного элемента размещаются между узлами кристаллической решетки растворителя (рисунок 5.1 б). Растворы подобного типа образуют металлы и металлоиды, например, углерод, растворяясь в железе Feα, образует общую кристаллическую решетку – твердый раствор феррит. Растворы обозначают буквами греческого алфавита α, β, γ, δ, и т.д.
Химическое соединение образуется при определенном соотношении компонентов сплава. В этом случае строится новая кристаллическая решетка, отличная от решеток исходных компонентов. Химическое соединение отличается высокой твердостью и хрупкостью. Обозначается в общем виде химическое соединение формулой AmBn.
Характер взаимоотношений компонентов в сплаве можно определить по диаграммам состояния сплавов.
Анализ диаграмм состояния сплавов
Диаграмма первого рода или случай, когда два компонента:
а) растворимы в жидком состоянии;
б) не образуют химическое соединения;
в) в твердом состоянии образуют механическую смесь.
Такой вид соединения имеют сплавы Pb–Sb, Sn–Zn, Pb–Аg и др. Рассмотрим систему свинец–сурьма (Pb–Sb) и построим кривые охлаждения их сплавов (рисунок 5.2).
|
|
|
По диаграмме видно, что температура кристаллизации свинца – 327°С, сурьмы – 631°С. Кристаллизация сплавов начинается по линии АСВ (ликвидус), заканчивается – по ECF (солидус).
Кристаллизация сплава 13% Sb, 87% Рb начинается и заканчивается в точке С при температуре 245°С. В этом случае каждый компонент образует свою кристаллическую решетку. При большом увеличении в микроструктуре можно различить смесь мелких кристаллов свинца и сурьмы – эвтектику.
В сплавах с содержанием свинца более 87% кристаллизация начинается с появления кристаллов избыточного свинца. Эти сплавы называются доэвтектическими. Сплавы с содержанием сурьмы более 13% называются заэвтектическими. В них избыточной по сравнению с равновесным составом является сурьма, с неё начинается кристаллизация в сплаве и проходит в интервале температур между линиями СВ и СF.
После кристаллизации избыточного компонента оставшаяся жидкость образует механическую смесь. В твердом состоянии микроструктура доэвтектического и заэвтектического сплавов состоит из кристаллов избыточного компонента и эвтектики.
|
|
|
Правильность построения кривых охлаждения по диаграмме состояния проверяется с помощью правила фаз Гиббса.
Правило фаз Гиббса, устанавливает зависимость между числом степеней свободы С равновесной системы, числом фаз Ф, компонентов К и внешних факторов, которая выражается следующей формулой:
С = К + I – Ф, (5.1)
где К – число компонентов.
Компонент – независимая часть системы (химический элемент, химическое соединение);
Система – совокупность фаз в сплаве;
Ф – число фаз.
Фаза – однородная часть сплава, отделенная, от других частей поверхностью раздела. Фазами могут быть сами компоненты, их растворы, химсоединения.
С – число степеней свободы (вариантность системы) – число возможных вариантов изменения температуры, концентрации фаз без изменения их числа.
Если С = 0, то система называется безвариантной, т.е. процесс идет при постоянной температуре и концентрации.
Используя правило фаз, построим кривую охлаждения сплава, содержащего 13%Sb, 87%Pb. Начнем с выявления критических точек. Вертикаль сплава пересекает только одну линию диаграммы, следовательно, у этого сплава одна критическая точка. До точки 1 в сплаве имеется одна фаза – жидкость. Число степеней свободы С = К + 1 – Ф = 2 + 1 – 1 = 2. В точке 1 появились сразу ещё две фазы: кристаллы – свинца и сурьмы. С = 2 + 1 – 3 = 0. Система безвариантная, т.е. процесс идет без изменения температуры и концентрации. В точке 1' кристаллизация сплава закончилась.
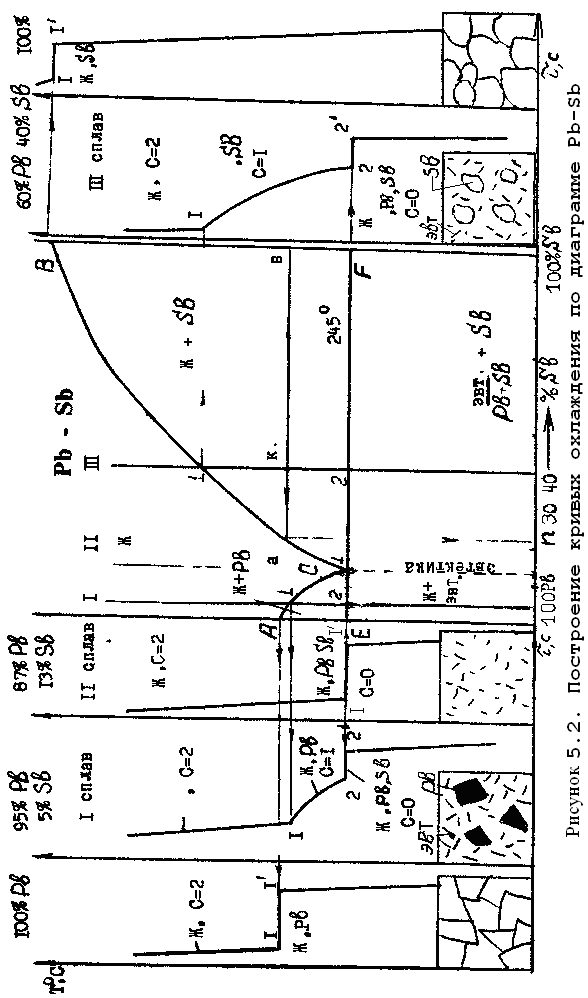
В заэвтектическом сплаве, например, 80% Sb, 20% Pb – две критические точки: 1 и 2.
До т. I. в сплаве фаза – Ж, идет быстрое охлаждение, и фазовых превращений не происходит при изменении двух факторов: температуры и концентрации (С = 2 + 1 – 1 = 2 – две степени свободы), на участке 1–2 появляется вторая фаза – кристаллы сурьмы. С = 2 + 1 – 2 = 1 (одна степень свободы). Процесс кристаллизации сопровождается выделением тепла, скорость охлаждения сплава уменьшится. С понижением температуры количество кристаллов сурьмы увеличивается, концентрация Ж стремится к эвтектической. Концентрацию жидкости в заданной т. «К» можно определить, проведя через нее горизонтальную линию (к аноду) до пересечения с ликвидусом (рис. 5.2.). Концентрацию жидкости т. "К" покажет т. "n".
В т. 2 в жидкой фазе установится равновесное соотношение и начнется образование механической смеси. С = 2 + 1 – 3 = 0, фазы: Рb, Sb Ж. На кривой охлаждения на участке 2–2' будет температурная остановка.
В т. 21 кристаллизация закончится, охлаждение сплава продолжится без фазовых превращений. В микроструктуре видны две составляющие: кристаллы сурьмы на фоне эвтектики.
Правило отрезков: Правило отрезков позволяет определить количество фаз, структурных составляющих в двухфазной зоне диаграммы. Например, в т «К» сплав состоит из фаз: Ж, Sb. Чтобы определить их количество, через точку проводят коноду до пересечения с ликвидусом (т. «а») и до 100% Sb. Отрезок "ав" покажет количество сплава 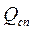 . Согласно правилу отрезков:
. Согласно правилу отрезков:
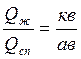 , (5.2)
, (5.2)
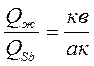 , (5.3)
, (5.3)
где 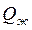 – количество жидкой фазы;
– количество жидкой фазы;
 – количество твердой фазы (Sb).
– количество твердой фазы (Sb).
Диаграмма второго рода или случай, когда два компонента:
а) неограниченно растворимы друг в друге, как в жидком, так и в твердом состоянии;
б) химических соединений не образуют.
К этому типу диаграмм относятся сплавы Cu–Ni, Co–Ni, Fе–Ni.
Рассмотрим диаграмму на примере Cu– Ni (рисунок 5.3):
Линия АСД – ликвидус, показывает начало кристаллизации сплава. В рассматриваемом сплаве – это т.1. 1 Выше т. 1 (рисунок 5.3 а) сплав находится в виде жидкости, т.е. существует одна фаза, следовательно число степеней свободы С =К + 1 – Ф = 2. На участке 1 –2 началась кристаллизация твердого раствора α.

Рисунок 5.3 – Диаграмма второго рода: а – кривая охлаждения сплава
Процесс кристаллизации сопровождается выделением тепла, скорость охлаждения сплава замедляется. С = 2 + 1 – 2 = 1. Концентрация образующихся кристаллов меняется в зависимости от температуры. Её можно определить, проведя горизонталь через рассматриваемую точку "К" до линии АВД – солидус (конец кристаллизации). Если сравнить химический состав участка зерна, образовавшегося при температуре т. "К", то он имеет более высокое содержание Ni, чем следующий участок, образовавшийся в т. "К  " при более низкой температуре. То есть, зерно имеет неодинаковый химический состав. Это явление называется дендритной ликвацией. Устранить ликвацию можно последующим отжигом (термообработка с нагревом до температуры ниже солидуса, выдержкой при этой температуре и медленным охлаждением). При отжиге за счет диффузии химический состав зерна выравнивается.
" при более низкой температуре. То есть, зерно имеет неодинаковый химический состав. Это явление называется дендритной ликвацией. Устранить ликвацию можно последующим отжигом (термообработка с нагревом до температуры ниже солидуса, выдержкой при этой температуре и медленным охлаждением). При отжиге за счет диффузии химический состав зерна выравнивается.
В т. 2 кристаллизация сплава заканчивается, он состоит из одной фазы – α, С = 2 + I – I = 2. Ниже т. 2 идет быстрое охлаждение сплава без фазовых превращений.
Количество жидкой и твердой фаз в т. «К» определяется по правилу отрезков (смотри формулы 5.2, 5.3):
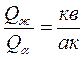 ,
, 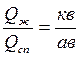
Диаграмма третьего рода или случай, когда:
а) компоненты неограниченно растворимы в жидком состоянии;
б) химсоединения не образуют;
в) в твердом состоянии растворимы ограниченно.
Рассмотрим изменения в этом сплаве на примере компонентов А – В (рисунок 5.4 а)
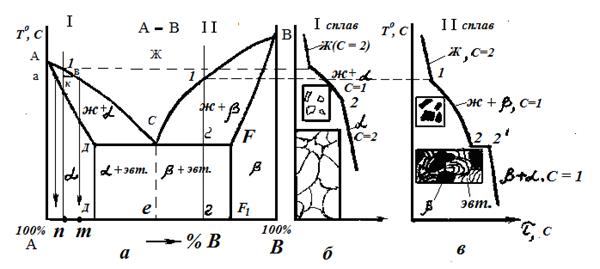
Рисунок 5.4 – Диаграмма третьего рода:
б, в – кривые охлаждения и схемы структур сплавов
Кристаллизация сплава начинается ниже ликвидуса – линии АСВ. В небольших количествах компонент " В" растворяется в "А", образуя α – раствор. Точка Д1 показывает максимальную растворимость «В» в «А». Сплав на основе компонента "В" образует раствор β. Максимальное количество компонента "А", которое может раствориться в "В" указывает точка F. Ниже линия FВ и АД сплавы представляют соответственно твердые растворы β и α. В сплаве концентрации т. С кристаллизуются одновременно α и β – растворы, т.е. образуется эвтектика – смесь α + β. Кристаллизация в доэвтектическом (участок АС) и заэвтектическом (участок СВ) сплавах начинается с образования α или β –растворов соответственно. В процессе кристаллизации концентрация жидкости приближается к эвтектической, и при температуре линии ДF идёт одновременная кристаллизация α и β. Солидус диаграммы – линия АДСFВ.
Превращения в первом сплаве (рисунок 5.4 б). В т. 1 началась кристаллизация α – раствора. На участке 1 – 2 скорость охлаждения замедлилась. В сплаве две фазы: Ж, α, С = 1. В т. 2 кристаллизация и фазовые превращения закончились.
В т. "К" концентрацию кристаллов укажет т. "n", жидкости – т. "m". Количество фаз в т. К определяют по правилу отрезков (смотри формулы 5.2, 5.3):
 ,
, 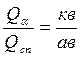
Превращения во втором сплаве (рисунок 5.4 в). Кристаллизация β раствора начинается в т. 1. На участке 1 – 2 в сплаве фазы – Ж, β, число степеней свободы С = 1. Скорость охлаждения уменьшается, при этом концентрация жидкости стремится к эвтектическому составу. Образование смеси наблюдается на участке 2–21. В сплаве присутствуют три фазы: Ж, α, β, С = 0 следовательно, процесс идёт при постоянной температуре. В т. 21 фазовые превращения заканчиваются, по правилу отрезков определим количество структурных составляющих в т."2":
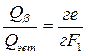 ,
, 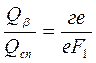
Диаграмма четвёртого рода или случай, когда два компонента в твёрдом состоянии образуют химическое соединение по формуле  .
.
Если в системе А – В (рисунок 5.5) при концентрации т. m образуется устойчивое химсоединение, то его можно рассматривать как самостоятельный компонент, образующий с компонентами А и В две диаграммы, тип которых зависит от свойств образующих их элементов. В данном случае химическое соединение  с компонентом А образует механическую смесь (диаграмма первого рода), а с компонентом В – раствор β (диаграмма второго рода).
с компонентом А образует механическую смесь (диаграмма первого рода), а с компонентом В – раствор β (диаграмма второго рода).

Рисунок 5.5 – Диаграмма четвёртого рода
Дата добавления: 2019-01-14; просмотров: 812; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
