КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ТЕЛ
(Лабораторная работа)
1.1 Цель работы
Изучить законы кристаллизации металлов и их сплавов.
2.2 Задание
2.2.1 Изучить справочные данные. Ознакомиться с устройством и работой приборов, используемых в работе.
2.2.2 Провести эксперимент.
2.2.3 Написать отчёт.
2.3 Оборудование и материалы на рабочем месте
2.3.1 Биологический микроскоп.
2.3.2 Стеклянные пластинки.
2.3.3 Растворы NaCl различной концентрации.
2.3.4 Плакаты.
2.3.5 Излом слитка сурьмы.
2.4 План выполнения работы
2.4.1 Объяснить с помощью второго закона термодинамики механизм процесса кристаллизации.
2.4.2 Изобразить график изменения свободной энергии металла в зависимости от температуры нагрева.
2.4.3 Изобразить график зависимости образования числа центров (Ч.Ц.) и скорости роста кристаллов (С.К.) от изменения степени переохлаждения ΔТ и объяснить, как ΔТ влияет на величину зерна.
2.4.4 Зарисовать схему структуры капель насыщенного и ненасыщенного растворов NaCl и объяснить наблюдаемые различия.
2.4.5 Изобразить схему стального слитка и объяснить наличие его зональной ликвации.
2.4.6 Изобразить схему дендритного строения излома слитка сурьмы.
2.5 Справочные данные
Все металлы и металлические сплавы в твердом состоянии имеют кристаллическое строение, т.е. образуют кристаллическую решетку. В кристаллической решетке атомы занимают определенные места в пространстве, положение их упорядочено.
|
|
|
На основе многолетних исследований Д.К.Чернов установил, что процесс кристаллизации состоит из двух стадий:
– образование центров кристаллизации (зародышей);
– рост кристаллов вокруг этих центров.
Основной причиной и движущей силой процесса кристаллизации по закону термодинамики является стремление вещества к наименьшему запасу свободной энергии, т.е., если свободная энергия жидкого металла 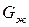 меньше свободной энергии выпавших кристаллов
меньше свободной энергии выпавших кристаллов 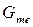 , то жидкое состояние – более устойчиво, идет процесс плавления. На рисунке 2.1 представлена зависимость изменения
, то жидкое состояние – более устойчиво, идет процесс плавления. На рисунке 2.1 представлена зависимость изменения  и
и 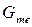 от температуры нагрева.
от температуры нагрева.
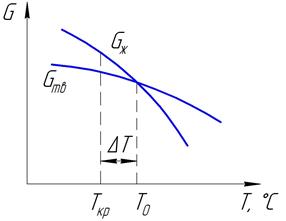
Рисунок 2.1 – Изменение запаса свободной энергии в зависимости
от температуры нагрева
Для развития процесса кристаллизации необходимо создать такие условия, при которых свободная энергия твердой фазы будет меньше, чем у жидкой. Это наблюдается при переохлаждении сплава на величину ΔТ, называемую степенью переохлаждения. Степень переохлаждения зависит от чистоты металла (чем чище сплав, тем больше ΔТ), от скорости охлаждения (чем она выше, тем больше ΔТ).
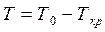 , (2.1)
, (2.1)
где 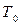 – теоретическая температура плавления;
– теоретическая температура плавления;
|
|
|
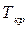 – фактическая температура кристаллизации.
– фактическая температура кристаллизации.
Степень переохлаждения влияет на образование числа центров кристаллизации (Ч.Ц.), на скорость роста зёрен (С.К.) и, как результат, на величину зерна в сплаве. Исследованиями установлено, что характер изменения параметров Ч.Ц. и С.К. в зависимости от степени переохлаждения ΔТ подчиняется закону нормального распределения. При равновесной температуре плавления ( 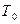 ), когда ΔТ = 0 (рис. 2.2.), Ч.Ц. = 0 и С.К. = 0 процесс кристаллизации не происходит.
), когда ΔТ = 0 (рис. 2.2.), Ч.Ц. = 0 и С.К. = 0 процесс кристаллизации не происходит.
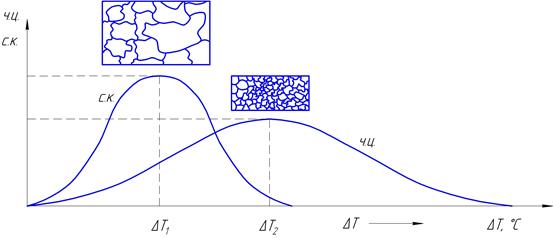
Рисунок 2.2 – Изменение Ч.Ц. и С.К. от степени переохлаждения
Если жидкий сплав переохладить на величину ΔТ1 то число центров (Ч.Ц. – зародышей) – невелико, а скорость роста кристаллов – максимальна, в сплаве получается крупнозернистая структура.
При степени переохлаждения ΔТ2 число центров значительно выше, идёт массовая кристаллизация в итоге сплав приобретает мелкозернистую структуру. Схема зарождения и роста кристаллов показана на рисунке 2.3.

Рисунок 2.3 – Схема зарождения и роста кристаллов, образование зёрен
Сначала кристаллы растут правильной формы, но на последней стадии в местах их соприкосновения правильная внешняя форма нарушается. Получившиеся кристаллы неправильной форма называются зернами.
|
|
|
Механизм зарождения зерна и процесс кристаллизации металлов очень сходны с процессами, протекающими при кристаллизации раствора солей. Так как жидкости прозрачны, то можно пронаблюдать и изучить механизм зарождения кристаллов в них, появление осей первого, затем второго порядка и использовать эту информацию при рассмотрении процесса кристаллизации в металлах и их сплавах. Для исследования используют растворы солей  , хлористого аммония
, хлористого аммония  различной концентрации.
различной концентрации.
Обычно кристаллизация капли раствора соли начинается у краев, т.к. растворитель здесь испаряется быстрее, раствор перенасыщается. Это способствует зарождению большого числа центров кристаллизации и получению мелкого зерна.
В растворе малой концентрации в следующей зоне испарение воды замедляется, зародышей образуется немного, и оси первого порядка растут большие, направление их роста – от края к центру. В центральной части направление осей хаотично, в целом получается крупнозернистая структура (рисунок 2.4 а).
Если рассматривать кристаллизацию перенасыщенного раствора, то можно наблюдать, как в капле сразу образуется много зародышей по всей площади. Оси первого порядка не успевают вырасти, как процесс кристаллизации уже заканчивается. Получается мелкозернистая структура (рисунок 2.4 б).
|
|
|
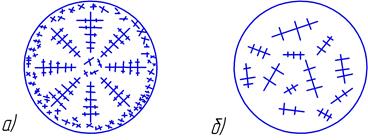
Рисунок 2.4 – Схема строения капли: а – ненасыщенного раствора,
б – перенасыщенного раствора
Из вышесказанного можно сделать вывод, что, создавая искусственные центры кристаллизации, меняя скорость охлаждения, можно регулировать величину зерна в металлических сплавах.
Дата добавления: 2019-01-14; просмотров: 597; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
