ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ДВС-СИНДРОМА
На сегодняшний день в силу выраженной гетерогенности причин, приводящих к ДВС-синдрому, не представляется возможным выработать единые рекомендации, которые было бы целесообразно использовать при лечении различных патологических состояний, вызвавших ДВС-синдром. Однако, учитывая тот факт, что независимо от заболевания-триггера, провоцирующего ДВС-синдром, процесс имеет характерные особенности, можно определить общие принципы профилактики и лечения этого грозного осложнения. Очевидно, что усилия должны быть направлены в первую очередь на ликвидацию или активное лечение основного заболевания. Активное этиотропное лечение, ранний перевод пациентов с клиническими проявлениями развившегося ДВС-синдрома в реанимационное отделение позволяет оптимизировать течение заболевания. Пациенты, у которых диагностирован ДВС-синдром, а особенно его острая или молниеносная формы, - это пациенты реанимационного профиля, нуждающиеся в лечении в условиях отделения интенсивной терапии с обязательным привлечением к лечебному процессу трансфузиологов и специалистов по патологии системы гемостаза.
Основные принципы лечения ДВС-синдрома:
• комплексность;
• патогенетичность;
• дифференцированность в зависимости от стадии процесса.
Своевременное лечение синдрома направлено на:
• устранение клинических проявлений основного заболевания, осложнившегося ДВС;
|
|
|
• прерывание внутрисосудистого свёртывания;
• остановку коагулопатического кровотечения.
Пациентам, попадающим в группу риска по развитию ДВС, обязателен мониторинг лабораторных показателей и функций жизненно важных органов: почасового диуреза, показателей КЩС, paO2, содержания лактата, ЛДГ, клинического анализа крови с определением количества тромбоцитов, содержания мочевины, креатинина крови, электролитов, а также АЧТВ, протромбинового времени, АТ III, Dдимеров фибриногена, ПДФ, РКФМ.
Данные лабораторных показателей в первые часы заболевания могут не выходить за пределы физиологических параметров, поскольку зачастую клинические симптомы значительно опережают лабораторные изменения. И всё же регулярное наблюдение за ними в течение нескольких часов способствует ранней диагностике ДВС, определению стадии и активности патологического процесса, а также осуществлению контроля над эффективностью выбранного лечения.
Основополагающим принципом лечения ДВС-синдрома является максимально раннее устранение триггерного фактора, поскольку диссеминированное внутрисосудистое свёртывание крови - это неспецифическая патология гемостаза, в основе патогенеза которой лежат рассеянное свёртывание крови и блокада микроциркуляторного русла, приводящие к возникновению полиорганной недостаточности с последующей гипокоагуляцией, тромбоцитопенией и геморрагией вследствие коагулопатии потребления. Назначение антибиотиков при гнойно-септических состояниях и осложнениях, хирургическая санация, дренирование очагов инфекции, адекватное инфузионное лечение гиповолемии, коррекция анемии, кардиопрессорное лечение при различных вариантах шока, хирургическое лечение акушерской и гинекологической патологии и другие лечебные мероприятия - это этиотропное лечение ДВС-синдрома, которое прерывает патологический процесс системной активации свёртывания крови, микротромбирования и потребления факторов свёртывающей системы (рис. 12).
|
|
|
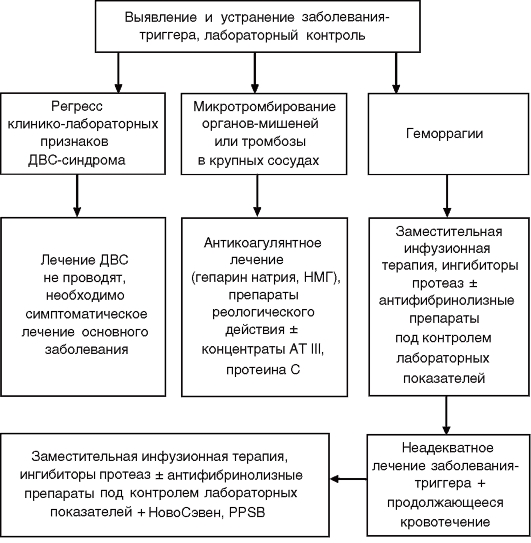
Рис. 12. Схема лечения пациентов с острым ДВС-синдромом
Таким образом, в основе профилактики ДВС лежит максимально раннее лечение патологии, обусловившей тяжёлое состояние больного. Особое значение в профилактике ДВС отводят быстрому восстановлению перфузии тканей, улучшению реологических свойств крови и её кислородтранспортной функции.
Дифференцированный подход к выбору вариантов лечения основан на определении превалирующих клинико-лабораторных признаков ДВС-синдрома, поскольку наличие или отсутствие геморрагий существенно видоизменяют лечение (рис. 13).
|
|
|
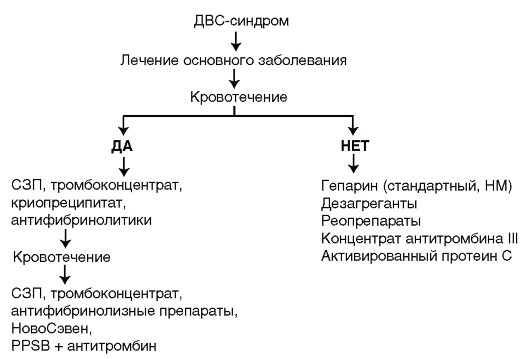
АНТИКОАГУЛЯНТЫ
Гепарин натрия (гепарин♠) - наиболее часто применяемый препарат для профилактики и лечения тромбоэмболических состояний. Использование гепарина натрия (гепарин♠) оправдано на любой стадии лечения ДВС-синдрома. Гепарина натрия (гепарин♠) противодействует развитию внутрисосудистого тромбообразования, обладает антитромбопластиновым и антитромбиновым действием, тормозит переход фибриногена в фибрин, снижает агрегацию эритроцитов и, в меньшей степени, тромбоцитов.
Назначение антикоагулянтов при лечении ДВС преследует следующие цели:
• восстановление нормального гемостаза;
• профилактика дальнейшего тромбообразования;
• удаление образовавшихся тромбов и восстановление функций поражённых органов.
Гепарин - это сульфатизированный полисахарид из семейства глюкозоаминогликанов молекулярной массой 4000-30 000 Да, средняя молекулярная масса 13 000 Да. Гепарин является антикоагулянтом
прямого действия, который блокирует биосинтез тромбина, снижает агрегационную способность тромбоцитов, незначительно активирует фибринолиз. Кофактор гепарина - АТ III. При дефиците этого естественного антикоагулянта гепарин не оказывает антикоагуляционного действия. Следует иметь в виду, что гепарин обладает рядом побочных эффектов, из которых наиболее опасны:
|
|
|
• тенденция к повышенной кровоточивости, что особенно опасно в послеоперационном периоде;
• гепарининдуцированная тромбоцитопения. Через 2-10 сут лечения гепарином натрия (гепарин♠) возникает незначительная тромбоцитопения. Как правило, уровень содержания тромбоцитов при этом остаётся выше 100 000 в 1 мкл и лечение гепарином натрия (гепарин♠) может быть продолжено. Однако в ряде случаев через 6-12 сут внутривенного или подкожного введения гепарина натрия (гепарин♠) возникает тяжёлая отсроченная тромбоцитопения, очевидно, иммунного происхождения. На поверхности тромбоцитов экспрессируется гепарин-связывающий протеин PF4, к которому у некоторых пациентов вырабатываются антитела. Титр антител к протеину PF4 максимально возрастает на 7-10 сут назначения антикоагулянтов. При продолжении лечения гепарином натрия (гепарин♠) в течение нескольких часов или суток может развиться тяжёлая тромбоцитопения, которая сопровождается артериальными и/или венозными тромбозами. У всех больных, получающих лечение гепарином натрия (гепарин♠), необходимо периодически определять количество тромбоцитов. При возникновении тяжёлой тромбоцитопении препарат следует отменить. Кроме того, трансфузии тромбоконцентрата противопоказаны из-за высокого риска рикошетных артериальных тромбозов. В подобных случаях назначают антитромботические препараты нового класса - прямые ингибиторы тромбина, к которым относят рекомбинантный гирудинΨ, агратромбанΨ, бивалирудинΨ (Nutescu E., Wittkowsky A.K., 2004).
• усугубление дефицита АТ III. Комплекс АТ III + гепарин быстро выводится из циркуляторного русла. При использовании больших доз гепарина натрия (гепарин♠) запасы АТ III быстро истощаются и наступает рикошетная гиперкоагуляция;
• резистентность к гепарину. В ряде случаев, несмотря на максимальное увеличение дозы гепарина натрия (гепарин♠), терапевтический эффект отсутствует. Установлено, что причина
резистентности к гепарину - протеолитическое разрушение препарата либо инактивация его гепариннейтрализирующими белками, в том числе тромбоцитарным фактором IV. Выявление гепаринорезистентости - показание для отмены препарата и назначения прямых ингибиторов тромбина [гирудинΨ, лепирудинΨ (рефлуданΨ), десирудинΨ (реваскΨ)]. Кроме этого, гепаринорезистентность во многом обусловлена дефицитом АТ III. В подобных ситуациях для восстановления антикоагулянтного действия гепарина необходимо восполнить дефицит АТ III, а не увеличивать дозу антикоагулянта (Баркаган З.С., 2000). Назначение гепарина натрия (гепарин♠) при ДВС-синдроме необходимо начинать с малых доз - 50-100 МЕ в час в виде постоянной инфузии, затем дозу при необходимости можно постепенно увеличить. Основным способом введения гепарина натрия (гепарин♠) при лечении ДВС-синдрома является внутривенный капельный (в изотоническом растворе натрия хлорида, с плазмой); в некоторых случаях внутривенное введение можно дополнять подкожными инъекциями.
Тактика лечения гепарином натрия (гепарин♠), доза и частота введения препарата зависят от течения и фазы ДВС-синдрома. Большое значение при лечении гепарином натрия (гепарин♠) и выборе дозы антикоагулянта отводят анализу лабораторных данных, клинической ситуации, в частности таким факторам, как наличие или отсутствие у больного раневой поверхности, продолжающегося кровотечения (маточного, из послеоперационной раны, желудочнокишечного тракта, из распадающейся опухоли и т.д.). В послеоперационном периоде гепарин натрия (гепарин♠) следует применять с большой осторожностью с обязательным контролем показателей свёртывания крови. Если ДВС-синдром сопровождается кровоточивостью, гепарин натрия (гепарин♠) вообще необходимо отменить; при наличии высокого риска кровоточивости суточная доза гепарина должна быть снижена в 2-3 раза.
Доза гепарина натрия (гепарин♠) также может варьироваться в достаточно широких пределах в зависимости от формы и фазы ДВСсиндрома. В стадии гиперкоагуляции применение гепарина натрия (гепарин♠) имеет профилактическое значение, его суточная доза (при отсутствии геморрагий) может составить 35 000-50 000 ЕД/сут (500-800 ЕД/кг/сут). Первую дозу - 5000-10 000 ЕД - вводят внутривенно болюсно, а затем капельно, желательно при помощи инфузомата (Лычёв В.Г., 1998; Баркаган З.С., 1993). Далее необходимую
дозу гепарина натрия (гепарин♠) подбирают в соответствии с лабораторными показателями и обязательной отменой при наличии геморрагий. Дозу гепарина натрия (гепарин♠) подбирают индивидуально на основании лабораторных показателей с учётом различной чувствительности к препарату.
Оценить эффективность лечения гепарином натрия (гепарин♠) после внутривенного введения можно по динамике следующих лабораторных показателей:
• время свёртывания крови - удлинение в 1,2-1,8 раза по сравнению с нормальными значениями;
• АСТ-тест - удлинение до 160-170 с (N = 110-120 с);
• АЧТВ - удлинение в 1,5-2,5 раза по сравнению с нормальными показателями (N = 35-45 с). Изменение показателя АЧТВ в указанных параметрах свидетельствует о достижении терапевтической антикоагуляции. Контроль показателей гемостазиограммы проводят не реже чем через каждые 4 ч. Необходимо учитывать то обстоятельство, что для профилактики тромбозов гепарин натрия (гепарин♠) назначают в низких дозах (такое лечение называют терапией низких доз), при этом АЧТВ может удлиняться незначительно.
Наибольшие дозы гепарина натрия (гепарин♠) необходимы при наличии в крови больного белков острой фазы (при острых инфекционно-септических процессах, crush-синдроме, ожогах и пр.), которые инактивируют гепарин, препятствуя его антикоагулянтной активности. Как было сказано выше, неэффективность гепарина натрия (гепарин♠) также связана с блокадой и/или снижением содержания в плазме больного плазменного кофактора гепарина - антитромбина III.
На III стадии ДВС-синдрома - в фазе гипокоагуляции - гепарин натрия (гепарин♠) используют под прикрытием трансфузий плазмы в гораздо меньших дозах, например, в начале каждой трансфузии вводят 2500-5000 ЕД гепарина натрия (гепарин♠) внутривенно или капельно. С целью снижения дозы гепарина натрия (гепарин♠)успешно применяют следующую схему: непосредственно перед трансфузией СЗП в дозу плазмы (объём стандартной дозы плазмы, полученной способом дискретного донорского плазмафереза, составляет в среднем от 250 до 300 мл) добавляют 100-500 ЕД гепарина натрия (гепарин♠). Данная схема позволяет значительно снизить не только объём трансфузии плазмы, но и дозу гепарина натрия (гепарин♠) (Лычёв В.Г., 1998). Наличие кровотечения служит
противопоказанием для назначения антикоагулянтного лечения гепарином натрия (гепарин♠).
В результате применения гепарина натрия (гепарин♠) состояние больного улучшается: купируется полиорганная дисфункция или недостаточность, возрастает концентрация фибриногена и количество тромбоцитов, снижается содержание ПДФ. Обязателен контроль времени свёртывания крови, терапевтический эффект возможен при удлинении времени свёртывания в 1,5 раза.
Путём фракционирования и деполимеризации синтезированы препараты гепарина с низкой молекулярной массой: от 1000 до 10 000 Да (НМГ), средняя молекулярная масса 4500 Да. НМГ имеют отличный от гепарина натрия (гепарин♠) механизм действия, фармакокинетику, побочные эффекты. Препараты низкомолекулярного гепарина [надропарин кальция (фраксипарин♠), эноксапарин натрия (клексан♠), далтепарин натрия (фрагмин♠) и др.] оказывают более выраженное по сравнению с гепарином натрия (гепарин♠) антитромботическое действие благодаря выраженной активности против фактора Ха, высокой биодоступности и значительно более длительному терапевтическому эффекту. Биоусвояемость составляет 80-90%, вследствие чего колебания концентрации препаратов НМГ незначительны. Гораздо реже по сравнению с гепарином натрия (гепарин♠) отмечают гепарининдуцированную тромбоцитопению и гепаринорезистентность. Наиболее частое осложнение лечения НМГ - кровоточивость; нейтрализация препаратов НМГ введением протамина сульфата менее эффективна по сравнению с гепарином натрия (гепарин♠). При угрожающих кровотечениях, возникших у пациентов на фоне применения НМГ, проводят плазмаферез в режиме плазмообмена с замещением удалённой плазмы донорской СЗП, возможно применение активированных препаратов факторов свёртывания крови (Петч Б., Мадленер К., Сушко Е., 2006).
Молекулы НМГ массой менее 5400 Да взаимодействуют с АТ III плазмы, активируя последний. К комплексу АТ III + гепарин присоединяется фактор Ха, происходит инактивация фактора Ха. Молекулы НМГ массой более 5400 Да также активизируют АТ III, но при этом образуется комплекс с тромбином. Анти-Па активность НМГ замедляет синтез тромбина, тогда как анти-Ха активность препарата уменьшает количество уже образовавшегося тромбина (рис. 14). Исследования фармакокинетики препарата показали, что НМГ молекулярной массой более 5400 Да элиминируется быстрее,
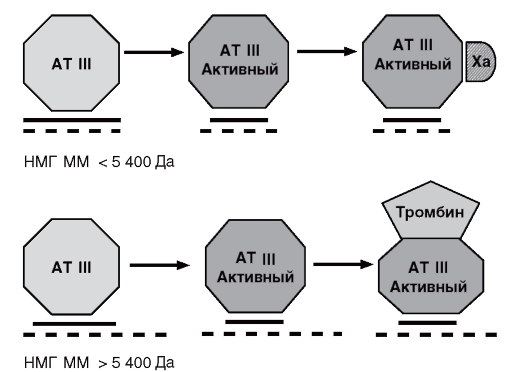
Рис. 14. Механизм действия НМГ на факторы свёртывания
чем молекулы массой менее 5400 Да. Именно эта особенность обусловливает пролонгированный анти-Ха эффект НМГ.
Помимо активации, АТ III НМГ имеют дополнительные воздействия на систему гемостаза.
Антитромбин Ш-независимые эффекты НМГ
• в меньшей степени взаимодействует с эндотелием сосудов, за счёт чего оказывает более длительный по сравнению с гепарином натрия (гепарин♠) терапевтический эффект;
• инициирует выработку ингибитора тканевого фактора (ингибитора тканевого тромбопластина), концентрация которого после введения НМГ возрастает в 3 раза;
• активизирует фибринолиз вследствие увеличения содержания активатора плазминогена;
• улучшает гемореологию, нормализует вязкость крови.
Помимо противосвёртывающего эффекта, антитромбин III оказывает выраженное противовоспалительное воздействие на сосудистый эндотелий. Этот механизм АТ III осуществляет за счёт стимуляции синтеза противовоспалительных простациклинов клетками сосудистого эндотелия, что приводит к снижению агрегации тромбоцитов и деблокаде микроциркуляции.
Препараты низкомолекулярного гепарина назначают подкожно; единая схема введения препаратов низкомолекулярного гепарина отсутствует, поскольку каждый препарат имеет различную эффективность, биодоступность, дозу. У пациентов с почечной дисфункцией или недостаточностью необходим тщательный мониторинг показателей свёртывания крови в связи с угрозой кумуляции НМГ.
Критерии эффективности лечения препаратами низкомолекулярного гепарина:
• удлинение времени свёртывания крови в 1,5-1,8 раза по сравнению с нормальными показателями;
• удлинение АСТ-теста до 140-160 с;
• удлинение АЧТВ в 1,5-2,5 раза по сравнению с нормой (в случаях длительного назначения НМГ).
НМГ в терапии ДВС-синдрома показали достаточный эффект при меньшем по сравнению с гепарином натрия (гепарин♠) риске возникновения кровотечения и меньшем потреблении АТ III (Мелкумян А.Л., 2001; Sakuragawa N., 1993).
В последние годы в зарубежной литературе появились сообщения о применении рекомбинантного гирудина [лепирудинаΨ (рефлуданΨ), десирудинΨ (реваскΨ)] - синтетического ингибитора тромбина - с хорошим эффектом. Механизм действия препаратов основан на нейтрализации тромбина посредством блокады гирудином ферментативной активности тромбина.
Эффективность данных препаратов оценивают по АЧТВ, длительность которого должна увеличиться в 1,5-2,5 раза по сравнению с исходным уровнем. Начальную дозу вводят болюсно до 0,1 мг/кг, затем переходят на постоянную инфузию в поддерживающей дозе 0,15 мг/кг/ч под контролем АЧТВ каждые 4 ч.
Основной побочный эффект при использовании вышеуказанных препаратов - резко возрастающий риск неконтролируемых кровотечений, так как специфических антидотов к этим препаратам нет (Панченко Е.П., Добровольский А.Б., 1999; Баркаган З.С., 1988). При передозировке, угрожающем жизни кровотечении проводят сеансы экстракорпоральной детоксикации - гемофильтрации, гемодиализа, плазмообмена. Довольно часто возникает необходимость проведения повторных сеансов детоксикации, поскольку снижение концентрации гирудинаΨ в крови приводит к перемещению накопленного во внесосудистом пространстве препарата в плазму по градиенту концентрации (Петч Б., Мадленер К., Сушко Е., 2006).
Заместительная терапия направлена на восстановление гемостаза, и в первую очередь дефицита АТ III и сериновых протеаз. Свежезамороженная донорская плазма (СЗП), содержащая в естественном виде достаточные концентрации всех необходимых компонентов системы гемостаза, - оптимальный препарат для восполнения их дефицита и позволяет корригировать мультифакторную коагулопатию, характерную для ДВС-синдрома.
Эффективность лечения достигают как можно более ранним струйным переливанием СЗП до 800-1600 мл/сут. Первоначальная доза - 600-800 мл, затем по 300-500 мл через каждые 3-6 ч. Таким образом, объём инфузируемой плазмы составляет 10-15 мл на 1 кг массы тела, при необходимости его увеличивают. Трансфузию плазмы осуществляют с высокой объёмной скоростью, по возможности в течение 1 ч. При этом скорость инфузии лимитирована состоянием пациента, в первую очередь наличием сердечно-сосудистой, почечной недостаточности, гиперволемии (Воробьев А.И.,2001; Баркаган З.С.,1988; Goodnight S., Hathaway W., 2001). Инфузия СЗП в объёме 15-20 мл/кг позволяет увеличить активность факторов свёртывания в среднем на 30% от исходного уровня. Кратность повторных инфузий СЗП определяют клиническая ситуация и период полужизни факторов свёртывания крови (табл. 7).
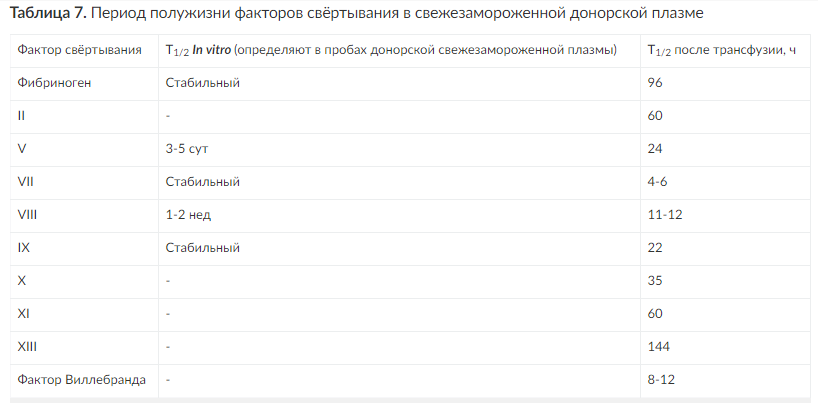
Трансфузии СЗП показаны при ДВС-синдроме, ассоциированном с кровоточивостью и позволяют:
• возместить недостаток практически всех компонентов гемостаза, в том числе АТ III и протеинов С и S, снижение содержания которых при ДВС-синдроме происходит особенно интенсивно - в несколько раз быстрее, чем всех прокоагулянтов;
• ввести полный набор естественных антипротеаз и факторов, восстанавливающих антиагрегационную активность крови и тромборезистентность эндотелия.
Трансфузии СЗП не применяют с целью профилактики ДВСсиндрома при отсутствии признаков кровоточивости и мультифакторного дефицита, так как установлено, что профилактическое использование донорской плазмы не влияет на частоту возникновения ДВС и не уменьшает потребность в дальнейшей трансфузии
(Заболотских И.Б., 2008).
Размораживание плазмы необходимо выполнять в специальных устройствах для размораживания при температуре от +37 до +40 °С (Plotz R.D., Giotola R.T., 1988), размороженные препараты плазмы нужно перелить в течение 2 ч. Трансфузию плазмы осуществляют с учётом групповой и биологической совместимости крови донора и реципиента.
Добавление небольших доз гепарина натрия (гепарин♠) (около 500 ЕД) непосредственно перед трансфузией в размороженную плазму позволяет существенно уменьшить объём переливаемой плазмы и усилить лечебный эффект трансфузии (Лычёв В.Г., 1998). Гепарин активизирует антитромбин III, вводимый с плазмой, превращая его в антикоагулянт немедленного действия. Выраженный эффект связан с быстрым прекращением внутрисосудистого свёртывания комплексом АТ III + гепарин.
Трансфузии плазмы со сниженным содержанием фибриногена и ряда других факторов свёртывания крови оказывают выраженный терапевтический эффект при лечении ряда вариантов ДВС-синдрома, характеризующихся повышением прокоагулянтной активности крови больных (Баркаган З.С., Елыкомов В.А., 1994). Так, с этой целью успешно применяют концентрат нативной плазмы (КНП) - супернатантную фракцию плазмы (получаемую после удаления криопреципитата), которая в достаточном количестве содержит плазменные белки, факторы свёртывания крови, но в ней существенно снижено содержание фибриногена. Примение КНП показа-
но в гиперкоагуляционную фазу ДВС или при ДВС хронического, рецидивирующего течения.
Применение криопреципитата, содержащего в большей концентрации по сравнении с нефракционированной СЗП факторы VIII, фибриноген, фактор Виллебранда, фактор XIII, фибронектин, показано для восполнения дефицита этих факторов в случаях ДВСсиндрома острого, молниеносного течения (табл. 8). Применение целесообразно также для профилактики объёмной перегрузки, возможной при массивной трансфузии на фоне сердечно-сосудистой недостаточности и почечной дисфункции. После размораживания компонент должен быть перелит в течение 2 ч в соответствии с групповой совместимостью через стандартные системы для переливания крови, снабжённые 160 мкм фильтрами.

Критическим уровнем содержания фибриногена при ДВС-синдроме считают 0,7-1,0 г/л; целевые показатели компонентной гемотерапии - содержание фибриногена более 1,0 г/л. Для восполнения выраженного дефицита фибриногена криопреципитат нужно вводить в терапевтической дозе: взрослым (масса тела 70 кг) - 10 доз; детям - 1 доза на 10 кг массы тела; новорождённым - 1 доза.
Для восполнения ОЦК применяют кристалоидные препараты, растворы альбумина и плазмозаменители (декстраны, препараты гидроксиэтилированного крахмала, желатина). В фазе гиперкоагуляции рекомендуют применять 400-600 мл/сут декстранов, препаратов ГЭК, что позволяет снизить спонтанную агрегацию тромбоцитов и способствует улучшению микроциркуляции в органах. На других стадиях ДВС-синдрома применение коллоидных плазмозаменителей не рекомендовано или возможно в объёме не более 400 мл/сут, поскольку введение плазмозаменителей усугубляет коагулопатию потребления и предпочтение отдают препаратам желатина (гелофузин♠) и растворам альбумина человека (альбумина♠).
Если свежезамороженная плазма (СЗП) - это обязательный компонент лечения ДВС, то трансфузию эритроцитарной массы и тромбоконцентрата нужно производить по строгим показаниям:
• минимальное допустимое содержание Нb = 70-80 г/л;
• гематокрит - 25%;
• количество эритроцитов - 2,5-3х1012/л.
Тромбоцитопения без клинических проявлений (повышенной кровоточивости) не требует заместительной терапии (Сидоркина А.Н. и др., 2001). При значительной анемизации, которая нередко сопровождает течение ДВС-синдрома, показана трансфузия эритроцитной массы минимальных (до 3 сут) сроков хранения.
Для большей эффективности заместительной гемотерапии эритроцитсодержащими препаратами крови необходимо придерживаться следующих правил:
• осуществлять трансфузии эритроцитной массы, а не цельной консервированной крови;
• гемотрансфузии осуществлять на основе индивидуального подбора реакцией Кумбса;
• все гемотрансфузии осуществлять через лейкоцитарные фильтры или переливать отмытые эритроциты (ЭМОЛТ);
• переливаемые компоненты крови необходимо подогревать до 35-37 °С;
• избегать циркуляторных перегрузок, строго учитывать объём трансфузий, кровопотери и диуреза.
Для фазы гипокоагуляции ДВС характерна нарастающая тромбоцитопения, которая требует адекватной заместительной терапии. Показания к трансфузии донорских тромбоцитов:
• тромбоцитопения <100-50х109/л;
• тромбоцитопатия - снижение агрегационных свойств тромбоцитов;
• клиническая картина повышенной кровоточивости при содержании тромбоцитов более 100-50х109/л - появление петехиальной, спонтанной кровоточивости слизистых оболочек, кровотечение из операционной раны (при ревизии раны источника хирургического кровотечения выявить не удаётся).
Концентрат тромбоцитов (ТК) переливают в дозе, равной 6-10 ЕД ТК. Расчёт необходимого количества доз тромбоконцентрата можно производить на основании массы тела больного - 1 доза ТК на 10 кг массы тела. Применение ТК противопоказано в случаях гепарин-
индуцированной тромбоцитопении, поскольку трансфузия тромбоконцентата в этих случаях приведёт к артериальным и венозным тромбозам (табл. 9).
Критерии эффективности заместительной терапии:
• количество тромбоцитов больше предтрансфузионного;
• нормализация/укорочение времени свёртывания крови;
• прекращение/уменьшение кровоточивости.
Если показано дальнейшее введение СЗП больному с высоким ЦВД (более 12-14 см вод. ст.), необходимо проведение обменного плазмафереза, который позволит осуществить трансфузию СЗП в нужном объёме, не увеличивая ОЦК и не повышая центральное венозное давление.
Концентраты антитромбина III (кубернинΨ, антитромбин III иммуноΨ, атенативΨ, тромбат III♠). Препараты получают из вирусинактивированной донорской плазмы.
Как сказано выше, СЗП является основным источником сериновых протеаз, фибриногена, АТ III. Для эффективного лечения гепарином натрия (гепарин♠) содержание АТ III следует поддерживать на уровне более 80%. Известно, что в 1 мл плазмы содержится 1 МЕ АТ III. Таким образом, для одномоментного восполнения дефицита этого естественного антикоагулянта необходима трансфузия значительных объёмов СЗП. Помимо инфекционных, аллергических осложнений, трансфузия больших объёмов СЗП чревата развитием гиперволемии и декомпенсации сердечной недостаточности, именно поэтому трансфузию СЗП желательно сочетать с препаратами АТ III. Необходимо учитывать, что при остром ДВС период полужизни АТ III укорачивается до 4 ч, что обусловливает длительное или частое введение препаратов под контролем его активности. Показание к назначению концентратов антитромбина III - снижение содержания АТ III менее 50%; целевое значение лечения препаратами АТ III - уровень содержания более 80%.
Дозу препарата рассчитывают на основании определения активности антитромбина в плазме больного до начала лечения и в процессе лечения каждые 4-6 ч.
Раствор лиофилизированного АТ III в начальной дозе 1000-1500 МЕ/сут вводят внутривенно со скоростью 50 МЕ/мин (около 60 капель в минуту); после введении 1 МЕ/кг массы тела активность антитромбина повышается на 1% от исходного значения. Поддерживающая доза вдвое меньше начальной, её вводят с интервалом от 8 до 24 ч.
При быстром введении возможно развитие коллаптоидных состояний. Снижение содержания маркёров гиперкоагуляции (комплексов тромбин-антитромбин, фибринопептида А, РКФМ) и регрессия клинических симптомов свидетельствуют об эффективности выбранного лечения. Кроме этого, необходимо учитывать факт, что применение АТ совместно с гепарином натрия (гепарин♠) усиливает антикоагуляционный эффект последнего, это нужно помнить при расчёте дозы гепарина натрия (гепарин♠), которая не должна превышать 500 ЕД.
Препараты АТ III можно применять для профилактики ДВСсиндрома у пациентов с тяжёлой полиорганной недостаточностью, особенно эффективны они в целях профилактики острого дистресссиндрома (Blauhut B.,1985). Установлено, что заместительная терапия препаратами АТ III значительно сокращает длительность заболевания и снижает смертность больных от ДВС (Vinazzer H., 1989).
Активированный протеин С (ксигрисΨ, дротрекогин-αΨ) - рекомбинантно полученный препарат, обладающий антикоагулянтным действием. Механизм действия препарата основан на блокировании синтеза тромбина за счёт инактивации факторов V и VIII; кроме этого, ксигрисΨ оказывает мощное противовоспалительное действие. Доказана эффективность препарата для профилактики и лечения ДВС-синдрома, осложняющего течение сепсиса (Петч Б., Мадленер К., 2006): после применения рекомбинантного активированного протеина СΨ смертность снизилась до 24% в сравнении со смертностью 30% в контрольной группе больных (Hack C., 2001). На основании этих данных можно сделать вывод, что ксигрисΨ станет препаратом выбора в лечении ДВС-синдрома при сепсисе.
Рекомбинантный активированный протеин С (Ксигрис, Drotrecogin) назначают внутривенно капельно в дозе 24 мкг/кг/ч в течение 96 ч. Однако необходимо учитывать то обстоятельство, что после применения препарата существенно возрастает число серьёз-
ных кровотечений, так как адекватный лабораторный контроль показателей гемостазиограммы на фоне лечения ксигрисом в настоящее время отсутствует.
Эптаког альфа [активированный] (НовоСэвен♠) - рекомбинантный концентрат активизированного фактора VIIa. Препарат НовоСэвен разработан для лечения спонтанных и связанных с операциями кровотечений у пациентов с врождённой и приобретённой (ингибиторной) гемофилией с действующими антителами против факторов свёртывания VIII или IX. В процессе клинических испытаний препарата показана его высокая эффективность в случаях неконтролируемых посттравматических, хирургических кровотечений у пациентов, не имеющих патологии гемостаза в анамнезе. Выраженный гемостатический эффект обусловлен механизмом действия НовоСэвена*, поскольку препарат инициирует гемостаз в месте травматического, хирургического повреждения за счёт формирования комплексов с ТФ, выделенным повреждённым субэндотелием. Несомненное преимущество заключается в том, что на активность НовоСэвена* не влияет наличие мультифакторной недостаточности гемостаза, характерной для массивной кровопотери, ДВС-синдрома. Кроме этого, клинические испытания препарата не подтвердили существенную системную активацию гемостаза; повторные введения препарата не оказывают влияния на содержание фибриногена и антитромбина. Тем не менее применение НовоСэвена* у больных с ДВС-синдромом в случаях жизненно опасных кровотечений требует тщательного лабораторного и клинического мониторинга на предмет исключения активация процессов свёртывания крови, особенно при наличии соответствующих факторов риска, к которым относят инфекции, септицемию, crush-синдром. Таким образом, НовоСэвен* в лечении ДВС-синдрома применяют только по жизненным показаниям, в тех случаях неконтролируемых кровотечений, при которых другие виды консервативного гемостатического лечения не оказывают эффекта.
Препарат назначают в дозе 90-120 мкг/кг массы тела с интервалом 2-8 ч; кратность введения определяется сохранением клинических проявлений профузной кровоточивости (Дементьева И.И., Ерёменко А.А., Чарная М.А., 2006). НовоСэвен* противопоказан пациентам, имеющим тромбоэмболические эпизоды в анамнезе.
Препараты протромбинового комплекса (ППСБ - БериплексΨ, ППСБ концентрат S-TIMΨ), изготовляемые из донорской плазмы,
содержат в концентрированном виде К-зависимые факторы свёртывания крови: протромбин (Р), проконвертин (Р), фактор Стюарта (S), антигемофильный глобулин В (В) - ППСБ.
Крайне нежелательный побочный эффект препаратов ППСБ - тромбогенность, поэтому применение ППСБ в лечении ДВС-синдрома возможно лишь по витальным показаниям и оправдано для купирования профузных кровотечений при отсутствии эффекта от антифибринолитиков и проводимой заместительной терапии СЗП, фибриногеном, тромбоконцентратом. С целью компенсации системной активации свёртывания крови необходимо назначение препаратов концентратов антитромбина III: пограничный уровень содержания АТ III - менее 40%.
Расчёт дозы препарата зависит от величины протромбинового времени (ПВ, показатель Квика), АЧТВ: при удлинении ПВ, АЧТВ более чем в 2 раза от нормальных показателей доза препарата составляет 25 ЕД/кг массы тела больного.
В заключение необходимо отметить, что современный подход к лечению антикоагулянтами и заместительной гемотрансфузионной терапии ДВС-синдрома постепенно видоизменяется, чему в немалой степени способствует появление препаратов концентратов натуральных антикоагулянтов (антитромбин, протеин С, ингибитор тканевого фактора), а также медикаментозных средств, обладающих выраженным гемостатическим потенциалом (НовоСэвен*, ППСБ). Применение вышеуказанных препаратов в лечении экспериментальной модели ДВС-синдрома у животных (клинические испытания находятся в разных стадиях исследования) показало большую эффективность в сравнении с лечением гепарином натрия (гепарин♠) и меньшее число геморрагических осложнений после их назначения (Levi M., Jonge E., Van der Poll T., 2001).
АНТИФИБРИНОЛИЗНЫЕ ПРЕПАРАТЫ
Антифибринолизные препараты в лечении ДВС-синдрома имеют ограниченное применение, их назначают в случаях фатальных кровотечений, развившихся вследствие системного фибринолиза в сочетании с признаками диссеминированного внутрисосудистого свёртывания крови (ДВС) при хирургических вмешательствах на органах, богатых активаторами фибринолиза (головном, спинном мозге, сердце, сосудах, поджелудочной железе), акушерских патологиях, трансплантации печени, при синдроме массивной гемотрансфузии.
Известно, что системный фибринолиз ассоциирован с чрезмерной концентрацией в циркулирующей крови фибринолитических ферментов, прежде всего плазмина и тканевого активатора плазминогена (t-PA). Системный фибринолиз может быть первичным (классическая модель первичного фибринолиза - активация фибринолиза в ответ на лечение тромболитиками) и вторичным, который носит компенсаторный характер (фибринолиз при ДВС-синдроме).
К препаратам, обладающим антифибринолизным действием, относят:
• поливалентные ингибиторы протеаз, полученные из природного сырья, - апротинин (трасилол 500 000, гордокс, контрикал) (полипептиды, выделенные из лёгких крупного рогатого скота);
• синтетические ингибиторы протеаз - аминокапроновая кислота и транексамовая кислота.
Аминокапроновая кислота (молекулярная масса 131 Да) и транексамовая кислота (молекулярная масса 157 Да) - синтетические аналоги лизина, они имеют сходный механизм действия за счёт блокирования тканевого активатора плазминогена (t-PA) и плазмина. Кроме того, аналоги лизина обладают антипротеазной, антикининовой активностью, блокируя тканевые киназы, урокиназу, стрептокиназу, трипсин, калликреин, тем самым препятствуют растворению фибрина. Возможно применение данных препаратов в дополнение к лечению антикоагулянтами, проводимому для коррекции коагулопатии потребления, характерной для ДВС-синдрома. Благодаря низкому молекулярному весу они имеют короткий период полувыведения, проникают через гематоэнцефалический барьер; высокая концентрация препаратов определяется во всех тканях организма.
Аминокапроновую кислоту назначают внутривенно капельно по 100 мл 5%-ного раствора, в течение 1 ч в дозе 4-5 г, далее до полной остановки кровотечения по 1 г/ч в течение не более 8 ч. Необходим контроль лабораторных показателей фибринолитической активности, определение концентрации фибриногена. Около 50% действующего вещества выводится в неизменном виде в течение 3 ч.
Транексамовая кислота (трансамчаΨ) применяется для лечения и профилактики кровотечений, вызванных гиперактивацией фибринолиза. Ампула препарата содержит 50 мг транексамовой кислоты. Разовая доза препарата 10-15 мг на 1 кг массы тела внутривенно;
пик концентрации при внутривенном введении наступает через 15-10 мин; повторные введения при необходимости через 8-12 ч. Максимальная суточная доза - 2 г. При нарушении выделительной функции почек применяют в меньших дозах. В сочетании с гепарином натрия (гепарин♠) и другими антикоагулянтами применяют с осторожностью, а также при тромбозах или угрозе их развития; при сочетании с гемостатиками возможна активация тромбообразования. Отличие трансамчиΨ от аминокапроновой кислоты - более низкий почечный клиренс (6-8 ч, ε-АК - менее 3 ч), вследствие чего трансамчуΨ назначают в меньших дозах и с меньшей периодичностью.
Аминометилбензойная кислотаΨ (памбаΨ) - препарат из группы производных аминокапроновой кислоты. Вводят внутривенно в дозе 1,5 мг/кг (в среднем 50-100 мг), в дальнейшем необходимость повторного введения определяют клиническая ситуация и лабораторные показатели.
Поливалентные ингибиторы протеаз [апротинин (контрикал♠, гордокс♠), антагозанΨ] изготовляют из природного сырья; применяют в гипокоагуляционную фазу ДВС-синдрома в сочетании с трансфузией СЗП.
Лекарственные препараты обладают поливалентным действием:
• подавляют процессы протеолиза;
• инактивируют лизосомальные ферменты;
• стабилизируют мембрану клеток (встраиваясь в клеточную мембрану), универсальные протекторы шока.
Определённые трудности вызывает расчёт необходимой дозы препаратов данной группы, поскольку контрикал* дозируют в антитрипсиновых единицах (АтрЕ), а остальные препараты - в калликреин инактивирующих единицах (КИЕ): 1 АтрЕ соответствует 1,33 КИЕ.
Апротинин (молекулярная масса 6512 Да): 10 мл раствора содержит 100 000 КИЕ препарата. Апротининингибирует калликреин и другие протеиназы плазмы: плазмин, кининогеназы, трипсин, химотрипсин, снижает фибринолитическую активность крови. Применяют в качестве элемента комплексного лечения различных видов шока: эндотоксического, ожогового, травматического, геморрагического
(рис. 15, 16).
Для лечения первичных гиперфибринолитических кровотечений и коагулопатий, характеризующихся вторичным гиперфиб-
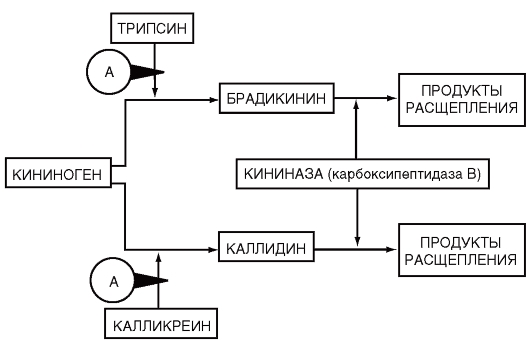
Рис. 15. Схема ингибирующего действия апротинина в кининовой системе (Чарная М.А.,1993)
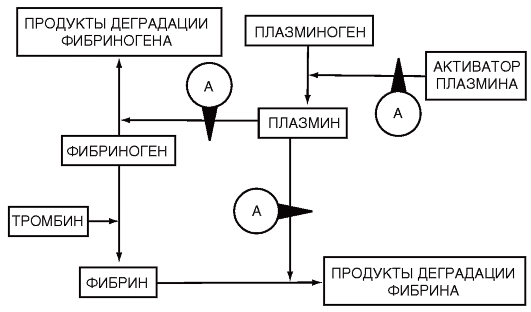
Рис. 16. Ингибирование фибринолиза и фибриногенолиза апротинином (Чарная М.А., 1993)
ринолизом, применяют в начальной дозе 500 000 КИЕ болюсно. Поддерживающая доза в виде постоянной инфузии составляет 200 000 КИЕ/ч. Для профилактических целей вводят до операции 200 000 КИЕ, далее в течение 2 сут после операции по 100 000 КИЕ каждые 6 ч внутривенно капельно.
Апротинин (контрикал♠): препарат вводят внутривенно болюсно или капельно в начальной дозе 350 000 АтрЕ, поддерживающая доза - 140 000 АтрЕ каждые 4 ч до нормализации показателей гемостаза.
В остром периоде ДВС-синдрома целесообразно сочетать ингибиторы протеаз с мини-дозами гепарина натрия (гепарин♠), возможно введение гепарина натрия (гепарин♠) в СЗП.
Основным показанием для назначения антифибринолизных препаратов больным с синдромом ДВС является угрожающее жизни кровотечение, развившееся вследствие гиперфибринолиза. Несмотря на отсутствие однозначных лабораторных показаний к их назначению, наличие заболевания-триггера, предрасполагающего к развитию гиперфибринолиза, кровотечение, снижение содержания фибриногена, повышенный уровень D-димера, патологические изменения в тромбоэластограмме становятся объективными показаниями к применению поливалентных ингибиторов протеаз (Петч Б., Мадленер К., Сушко Е., 2006).
Антифибринолизное действие препаратов снижает активность эндогенного фибринолиза, что, несомненно, приведёт к ещё большим нарушениям микроциркуляции органов-мишеней, пострадавших вследствие диссеминированного внутрисосудистого свёртывания (ДВС), и может усугубить полиорганную недостаточность. Таким образом, перед назначением антифибринолизных препаратов необходимо оценить целесообразность их применения: определить возможный терапевтический эффект на кровоточивость, степень риска тромбообразования и, соответственно, влияние на прогрессирование полиорганной недостаточности.
Дата добавления: 2018-11-24; просмотров: 598; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
