Строение атома. Периодическая система
1. Укажите элемент, которому соответствует электронная формула атома 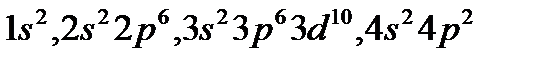
а) Ge; б) Са; в) Zn.
2. Укажите полное число электронов в атоме, у которого электронная валентная структура имеет формулу 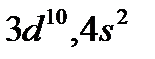 .
.
а) 30; б) 18; в) 20.
3. Для атома с массовым числом 36 а.е.м. и порядковым номером 17 в периодической системы укажите число протонов, нейтронов в ядре и число электронов в электронной оболочке нейтрального атома.
а) 17, 19, 17; б) 19, 17, 17; в) 17, 17, 17.
4. Изотопы, какого элемента имеют в ядре 14 протонов?
а) Si; б) Ni; в) Zn.
5. Сколько неспаренных электронов имеет атом марганца Mn в основном состоянии?
а) 5; б) 7; в) 2.
6. Атом какого элемента в основном состоянии содержит три свободных 4d орбиталей?
а) Zr б) Sc; в) V.
7. Атому, какого элемента, находящемуся в высшем энергетическом состоянии, соответствует электронная конфигурация 1s22s22p63s13p3?
а) Si; б) P; в) As.
8. Гидроксид какого элемента: Na, Mg, Al является более сильным основанием?
а) Na; б) Mg; в) Al.
9. Гидроксид какого элемента: Al, Si, P является более сильной кислотой?
а) P; б) Al; в) Si.
10. Значения первых потенциалов ионизации элементов I группы периодической системы соответственно равны ( в вольтах): Li (5,4); Cu (7,7); Ag (9,2). Указать у какого элемента металлические свойства выражены более сильно?
а) Li; б) Cu; в) Ag.
Химическая связь
1. Связь, осуществляемая благодаря образованию общих электронных пар, называется:
а) ковалентной; б) ионной; в) водородной.
|
|
|
2. Связь, обусловленная электростатическим притяжением ионов, называется:
а) ионной; б) ковалентной полярной; в) ковалентной неполярной,
3. Ковалентная полярная связь возникает между атомами элементов:
а) Cl и H; б) K и Cl; в) N и H.
4. Ионная связь возникает между атомами элементов:
а) Na и F; б) H и N; в) Na и Na.
5. В образовании координационной связи могут участвовать:
а) BF3 и F–; б) NH3 и H2O; в) NH3 и Zn.
6. Какие из свободных атомов совершенно лишены способности к химическому взаимодействию:
а) Ne; б) Na; в) H2.
7. Энергия химической связи наибольшая в молекуле…
а) Н2О; б) Н2S; в)H2Se.
8. Какая из молекул является неполярной:
а) СО2; б) Н2О; в) NН3.
9. Какая из связей характеризуется наибольшей степенью ионности, если электроотрицательность элементов Cl (3,0); K (0,91); Ge (2,0); P (2,2):
а) К – Cl; б) Ge – Cl; в) Р – Cl.
10. В какой молекуле химическая связь более прочная, если стандартная энтальпия образования (∆Н0298, кДж/моль) для галогенводородов имеет следующие значения: ∆Н0298(НF) = – 270,7 кДж/моль; ∆Н0298 (HCl)= – 92,3 кДж/моль; ∆Н0298(HBr)= – 36,3 кДж/моль?
а) HF; б) HCl; в) HBr.
Химическая термодинамика
1. Тепловой эффект реакции Fe2O3(к) + 3С(к) = 2Fe(к) + 3СО(г) можно рассчитать используя стандартные энтальпии образования по уравнению:
|
|
|
а) ∆Н0 = 2∆Н0(Fe) + 3∆Н0 (CO) – ∆Н0 (Fe2O3) – 3∆Н0(C);
б) ∆Н0 = 2∆Н0 (Fe)+ 3∆Н0 (CO);
в) ∆Н0 = ∆Н0 (Fe2O3) – 3∆Н0 (CO).
2. Какая из реакций является более эндотермической?
а) Fe2O3(к) + 3С(к) = 2Fe(к) + 3СО(г) ∆Н0х.р.= 490,7 кДж;
б) Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г) ∆Н0х.р.= 96,6 кДж;
в) 2FeО(к) + С(к) = 2Fe(к) + СО2(г) ∆Н0х.р.= 136,1 кДж.
3. Тепловой эффект какой реакции является стандартной энтальпией образования NO2 ?
а) NO(г) + 1/2 О2 (г) = NO2(г) ∆Н0х.р.= – 56,8 кДж;
б) 1/2N2 (г) + О2 (г) = NO2(г) ∆Н0х.р.= 33,5 кДж;
в) N2 (г) + 2О2 (г) = 2NO2(г) ∆Н0х.р.= 67 кДж.
4. Какая из реакций поставляет живому организму больше энергии?
а) С12Н22О11(к) + 12О2(г) = 12СО2(г) + 11Н2О(ж) ∆Н0х.р.= – 5648 кДж;
б) С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж) ∆Н0х.р.= – 2815,8 кДж;
в) С6Н12О6(к) = 2С2Н5ОН(ж) + 2СО2(г) ∆Н0х.р.= 30,8 кДж.
5. Определите, какая из реакций протекает самопроизвольно:
а) NO(г)+1/2О2(г)= NO2(г) ∆G0х.р.= –34,9 кДж;
б) N 2(г)+О2(г)= 2NO(г) ∆G0х.р.= 173,2 кДж;
в) N2(г)+1/2О2(г)= N2O(г) ∆G0х.р.= 104,1 кДж.
6. Дано термохимическое уравнение реакции в стандартных условиях
2Cu + O2 = 2CuO + 324 кДж. Энтальпия образования оксида меди при этом составляет…
а) -324 кДж/моль; б) -162 кДж/моль; в) +162 кДж/моль.
7. Количественной мерой неупорядоченности системы является термодинамическая функция…
|
|
|
а) Энтропия; б) Свободная энергия Гиббса; в) Энтальпия.
8. Не производя вычислений, определите, для какой из реакций энтропия будет иметь наибольшее значение
а) 2NH3(г) = N2(г) + 3Н2(г);
б) 2Н2S(г) + 3О2(г) = 2Н2О(ж) + 2SО2(г);
в) 2NH3(г) + 4О2(г) = N2О5(г) + 3Н2О(ж).
9. Какие из водородных соединений: Н2О(г), Н2S(г), Н2Sе(г), можно получить непосредственно из элементов, если энергия Гиббса образования веществ соответственно равны: –228,8 кДж/моль; –33,02 кДж/моль; 71,13 кДж/моль.
а) Н2О(г), Н2S(г); б) Н2Sе(г), Н2S(г); в) Н2Sе(г), Н2О(г).
10. Тепловой эффект реакции 2РН3(г)+ 4О2(г) = Р2О5(к) + 3Н2О(ж) можно рассчитать по уравнению:
а) ∆Н0 = ∆Н0(Р2О5) + 3∆Н0 (Н2О) – 2∆Н0 (РН3)– 4∆Н0 (О2);
б) ∆Н0 = 2∆Н0 (РН3) + 4∆Н0 (О2)+ ∆Н0(Р2О5) + ∆Н0(Н2О) ;
в) ∆Н0 = 2∆Н0(РН3) + 4∆Н0(О2)– ∆Н0(Р2О5) – 3∆Н0(Н2О).
Дата добавления: 2018-11-24; просмотров: 268; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
