Какие пары ионов могут быть использованы при составлении молекулярного уравнения, которому отвечает ионное уравнение
2H+ + CO32– ↔ H2O + CO2 ?
а) Cs+ и NO3–; б) К+ и S2-; в) Ca2+ и Cl-.
4. С каким из веществ вступит в реакцию обмена в водном растворе бромид бария?
а) CuSO4; б) HNO3; в) LiOH.
5. Какие ионы могут одновременно находиться в водном растворе:
а) Fe2+, NO3–, SO 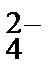 , Na+, NH4+; б) Cu2+, Br
, Na+, NH4+; б) Cu2+, Br  , S2-, Ag+ , NO3–;
, S2-, Ag+ , NO3–;
в) Zn2+, Cl  , Fe2+, Ca2+, OH
, Fe2+, Ca2+, OH  .
.
6. Какова реакция водного раствора гидрокарбоната натрия?
а) слабощелочная; б) слабокислая; в) нейтральная.
7. Какая из перечисленных солей подвергается полному гидролизу?
а) (NH4)2S; б) AlС13; в) BaС12.
8. При равных молярных концентрациях, какая соль имеет большую степень гидролиза?
а) FeCl3; б) FeС12; в) ZnС12.
9. Какое вещество можно добавить, чтобы увеличить степень гидролиза хлорида аммония?
а) Na2S; б) NH4NO3; в) HС1.
10. Приведите значение молекулярной массы соли, образующейся на первой стадии гидролиза Na2CO3.
а) 84; б) 106; в) 40.
Дисперсные и коллоидные системы
1. Дисперсными системами являются системы…
а) гетерогенные; б) гомогенные; в) однофазные.
2. Дисперсность системы характеризует…
а) меру раздробленности дисперсной фазы; б) количество компонентов в системе; в) природу дисперсионной среды.
3. Коллоидные системы относятся к системам…
а) субмикрогетерогенным; б) грубодисперсным;
в) молекулярно-дисперсным.
4. Дисперсной фазой называется фаза,…
а) которая распределяется; б) в которой идет распределение другой фазы; в) являющаяся растворимой в дисперсионной среде.
5. Агрегативная устойчивость коллоидов определяется …
|
|
|
а) дисперсностью и наличием стабилизатора в системе; б) только дисперсностью; в) только наличием стабилизатора в системе.
6. Какая техническая жидкость относится к классу эмульсий?
а) смазочно-охлаждающая жидкость; б) бензин; в) дизельное топливо.
7. Какой по знаку несут заряд частицы природного коллоида, имеющего формулу мицеллы {[mSiO2]∙nHSiO3–∙xH+}∙(n-x)H+ ?
а) отрицательный; б) положительный; в) нулевой.
8. Какое вещество с увеличением концентрации будет уменьшать поверхностное натяжение водного раствора?
а) любое моющее средство; б) сахароза; в) азотная кислота.
9. Какая формула соответствует строению мицеллы золя 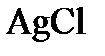 , стабилизированного хлористым натрием?
, стабилизированного хлористым натрием?
а) 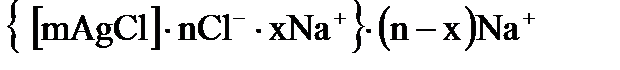 ;
;
б) 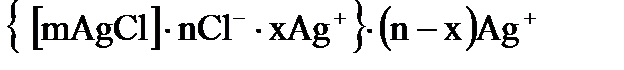 ;
;
в) 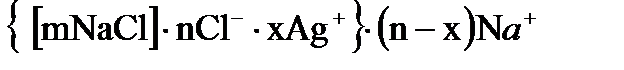 .
.
10. Какой ион будет обладать наибольшей коагулирующей силой для природной коллоидной системы, имеющей формулу мицеллы {[mAl2O3]∙nAlO2–∙xH+}∙(n-x)H+ ?
а)Al3+; б)SO42-; в)PO43-.
Окислительно-восстановительные процессы
1. Укажите, какая из предложенных частиц: NH3, I2, F2 проявляет свойства только окислителя.
а)F2; б) NH3; в) I2.
2. Определите, к какому типу окислительно-восстановительных процессов относится реакция: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
а) реакция межмолекулярного окисления-восстановления;
|
|
|
б) реакция диспропорционирования;
в) реакция внутримолекулярного окисления-восстановления.
3. Укажите, какая из предложенных частиц: 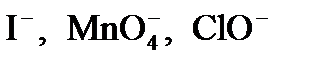 проявляет только свойства восстановителя.
проявляет только свойства восстановителя.
а) 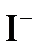 ; б)
; б) 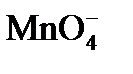 ; в)
; в) 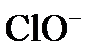 .
.
4. Определите, атомы какого элемента подвергаются окислительно-восстановительному диспропорционированию в реакции: 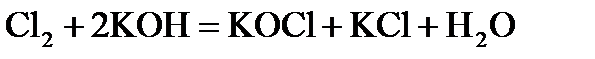 .
.
а) Cl; б)  ; в) K.
; в) K.
5. До каких продуктов может быть окислена вода?
а) до 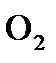 и
и  ; б) до
; б) до 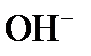 и
и  ; в) до
; в) до 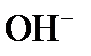 и
и 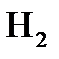 .
.
6. Укажите, какая ионно-электронная схема процесса восстановления будет справедлива для самопроизвольно протекающей реакции: 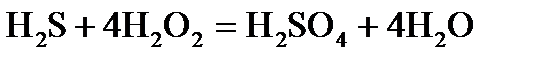 .
.
а)  ; б)
; б) 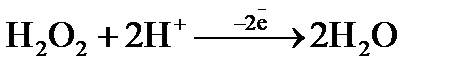 ;
;
в) 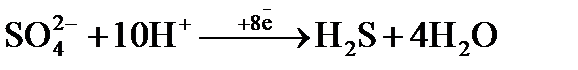 .
.
7. Количественным критерием самопроизвольного протекания любого окислительно -восстановительного процесса является…
а) отрицательное значение изменения изобарно-изотермическогопотенциала системы (ΔG<0); б) положительное значение ΔG˃0; в) ΔG=0.
8. Укажите, какая ионно-электронная схема процесса окисления будет справедлива для самопроизвольно протекающей реакции: 
 .
.
а)  ; б)
; б)  ;
;
в)  .
.
9. Редокс-потенциал (φ, В) любой окислительно-восстановительной системы в стандартных условиях можно рассчитать по уравнению Нернста, которое имеет вид …
а) φox/red = φ0ox/red + 0,059/n∙lg([ox]/[red]); б) φox/red = φ0ox/red + 0,059/n∙lg([red]/[ox]);
|
|
|
в) φox/red = φ0ox/red + lg([ox]/[red]).
10. Для какой системы с данным значением стандартного потенциала: 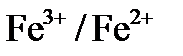
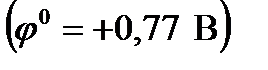 ,
, 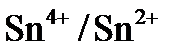
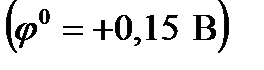 ,
, 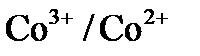
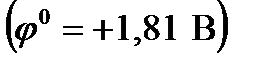 , бром
, бром 
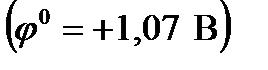 не является окислителем?
не является окислителем?
а) 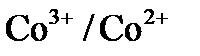 ; б)
; б) 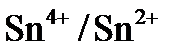 ; в)
; в) 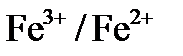 .
.
Электрохимические процессы
1. Гальваническим элементом называется устройство, в котором…
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходит преобразование тепловой энергии в механическую работу: в) происходит преобразование химической энергии окислительно-восстановительного процесса в тепловую энергию.
2. Каким типом проводимости должен обладать материал электрода в гальваническом элементе и при электролизере?
а) электронной проводимостью; б) дырочной проводимостью;
в) ионной проводимостью.
3. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция
Zn + 2AgNO3 → Zn(NO3)2 + 2 Ag ?
а) (-) Zn│Zn(NO3)2║ AgNO3│ Ag (+);
б) (+)Zn│Zn(NO3)2║ AgNO3│ Ag (-);
в) (-)Zn│ AgNO3 ║ Zn(NO3)2│ Ag (+).
4. Чем является платина в гальваническом элементе
(-) Pt, H2 │HCl║ AgNO3│ Ag (+) ?
а) токопроводящим материалом; б) окислителем; в) восстановителем.
5. Уравнение Нернста для стандартных расчетов потенциала электрода имеет вид:
|
|
|
а) 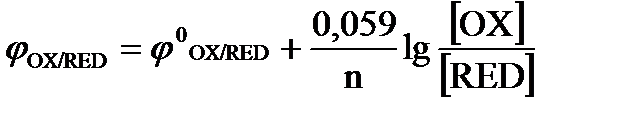 ; б)
; б) 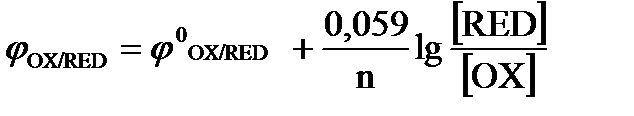 ;
;
в) 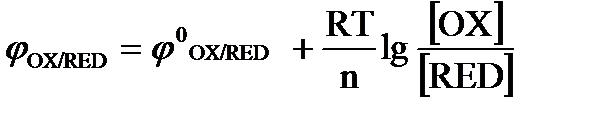 .
.
6. Электродвижущая сила гальванического элемента определяется…
а) максимальной разностью потенциалов катода и анода;
б) максимальной разностью потенциалов анода и катода;
в) минимальной разностью потенциалов электродов.
7. Изменение стандартного изобарно-изотермического потенциала (∆G0298) системы связано со стандартным значением электродвижущей силы (Е0) гальванической цепи соотношением:
а) ∆G0298= - nFE0; б) ∆G0298= - RTlgKp;в) ∆G0298=∆H - T∆S.
8. Какой процесс протекает на аноде в гальваническом элементе
Ni │Ni^2+ (1М)║Н^+ (1М)│Н2, Pt ?
а) 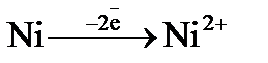 ; б)
; б) 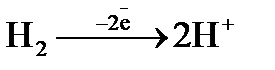 ; в)
; в) 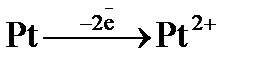 .
.
9. Какое значение имеет стандартная электродвижущая сила (Е0) в гальваническом элементе Ni │Ni2+ (1М)║Н+ (1М)│Н2, Pt , если: φo(Ni2+/Ni) = - 0,24 В; φo(2H+/H2) = 0,00 В ?
а) + 0,24 В; б) + 1,43 В; в) - 0,24 В.
10. Электролизом называется:
а) Как называется совокупность окислительно-восстановительных процессов на электродах при прохождении электрического тока от внешнего источника через раствор или расплав электролитов?
б) процессы окисления и восстановления в растворах электролитов;
в) преобразование энергии окислительно-восстановительных процессов в электрическую энергию.
11. Правило катодного восстановления при электролизе формулируется следующим образом…
а) в первую очередь на катоде восстанавливается система с максимальным значением потенциала;
б) в первую очередь на катоде восстанавливается система с минимальным значением потенциал;
в) в первую очередь на катоде окисляется система с наибольшим значением потенциала.
12. Правило анодного окисления при электролизе формулируется следующим образом…
а) в первую очередь на аноде окисляется система с наименьшим значением потенциала;
б) в первую очередь на аноде восстанавливается система с максимальным значением потенциал;
в) в первую очередь на аноде окисляется система с наибольшим значением потенциала.
13. При электролизе водного раствора сульфата натрия на катоде протекает процесс…
а)Na++ 1ē → Na (φо(Na+/Na)= – 2,71 В);
б)2H+ + 2ē → H2 (φo(2H+/H2) = 0,00 В);
в) 2H2O +2ē → H2 + 2OH– (φo(2H2O/H2,2OH–) = – 0,41 В).
14. При электролизе водного раствора соли KI на аноде протекает процесс…
а) 2I– – 2ē → I2 (φо(I2/2I–)= +0,54 В);
б) 2H2O – 4ē→O2+4H+ (φо(O2,4H+/2H2O) = 1,5 В);
в) 2H2O +2ē → H2 + 2OH– (φo(2H2O/H2,2OH–) = – 0,41 В).
15. Какой процесс протекает на медном аноде при электролизе водного раствора серной кислоты…
а) Cu – 2ē → Cu2+ (φо(Cu2+/Cu)= +0,34 B);
б) ) Cu2+ + 2ē → Cu (φо(Cu2+/Cu)= +0,34 B);
в) 2H+ + 2ē → H2 (φo(2H+/H2) = 0,00 В)
16. Чем определяется ЭДС гальванического элемента
(-) Pt,H2│H+(1 М)║Cu2+(1 M)│Cu(+) в стандартных условиях?
а) разностью стандартных потенциалов катода и анода ;
б) суммой потенциалов катода и анода;
в) разностью потенциалов анода и катода.
17. Какова теоретическая последовательность осаждения металлов находящихся в растворе в виде ионов: Na+,K+,Al3+,Fe3+,Cd2+,Au3+, Ag+, Cu2+, если концентрация каждого иона равна 1 М, а потенциал катода 3 В.
а) Au3+, Ag+, Fe3+,Cu2+,Cd2+, остальные осаждаться не будут;
б) Cd2+,Cu2+,Fe3+,Ag+,Au3+, далее процесс электролиза воды;
в)Na+,K+,Al3+,Fe3+,Cd2+.
18. В каком случае выделяется больше серебра: при электролизе расплава или водного раствора AgNO3 (время электролиза и сила тока одинаковы):
а) одинаковое количество; б) в случае электролиза расплава;
в) в случае электролиза водного раствора.
19. Какой металл серебро, медь или висмут, находящийся в растворе своей соли в стандартных условиях, приобретает больший положительный заряд ( 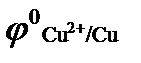 = + 0,34 В,
= + 0,34 В, 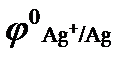 = + 0,8 В,
= + 0,8 В, 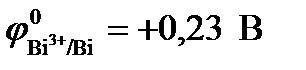 ):
):
а) серебро; б) медь; в) висмут.
20. Почему суммарные окислительно-восстановительные реакции электролиза протекают в направлении увеличения энергии Гиббса:
а) процесс является принудительным;
б) процесс является самопроизвольным;
в) система находится в состоянии равновесия .
Коррозия
1. Укажите тип коррозионного процесса бронзовых деталей (сплав медь-олово) во влажной атмосфере…
а) электрохимическая; б) химическая; в) биохимическая.
2. Какой вид коррозии стали вызывает горение жидкого топлива, содержащего примеси серы?
а) химическую; б) электрохимическую; в) биохимическую.
3. Почему активный металл Al не коррозирует на воздухе? Назовите другие металлы с аналогичными свойствами.
а) из-за гидроксидной пленки на поверхности; Zn, Mg, Cr, Ti;
б) из-за низкого потенциала; Mg, Cr, K;
в) из-за пассивации металла; Zn, Cr, Fe.
4. Какое значение рН должна иметь среда при эксплуатации латуни (сплав цинк-медь)? В чем причина?
а) рН=7, т.к. образуется на поверхности гидроксид цинка, устойчивый в нейтральной среде;
б) рН>7; образуется гидроксид цинка, устойчивый в щелочной среде;
в) рН<7; образуется гидроксид цинка, устойчивый в кислой среде.
5. Термодинамическим условием возможности протекания коррозии является:
а) ∆G<0; б) ∆G=0; в) ∆G>0.
6. Определите термодинамическую возможность газовой коррозии изделия из углеродистой стали при 900 0С, протекающей по реакции:
Fe(т) + Н2О(г)↔FeO(т) + Н2(г)
а) не протекает, т.к. ΔG0x.p.= 9,4 кДж/моль
б) протекает, т.к. ΔG0x.p.= - 9,4 кДж/моль;
в) протекает, т.к. ΔG0x.p = - 15,7 кДж/моль;
г) не протекает, т.к. 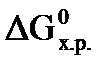 = - 9,4 кДж/моль.
= - 9,4 кДж/моль.
7. Какую газовую атмосферу наиболее целесообразно выбрать для обработки титанового изделия при 800 градусов Цельсия? Ответ подтвердите расчетом ΔG0x.p.
а) аргон; ΔG0x.p = 0 кДж/моль; б) кислород; ΔG0x.p = - 882,8 кДж/моль;
в) азот; ΔG0x.p = - 229,5 кДж/моль;
8. При коррозии сплава, содержащего свинец и олово, на влажном воздухе при рН=2 будет протекать катодная реакция…
а) О2 + 4Н+ + 4е →2Н2О; б) 2Н+ + 2е → Н2; в) О2 + 2Н2О +4е → 4ОН-.
9. Какой металл будет разрушаться при нарушении целостности свинцового покрытия на железе во влажном воздухе при рН=7, если φо(Sn2+/Sn)= – 0,14 В; φо(Fe2+/Fe) = – 0,44 В;)?
а) Fe0 – 2e → Fe2+; б) Sn2+ + 2е → Sn0; в) Sn0 – 2е → Sn2+.
10. С каким из металлов конструкционный контакт стальной детали является наиболее опасным, если φо(Fe2+/Fe) = – 0,44 В; φо(Sn2+/Sn) = – 0,14, В; φо(Ag+/Ag) = 0,80, В; φо(Zn2+/Zn) = – 0,76, В ?
а) с серебром; б) с цинком; в) с оловом.
11. Укажите металлы, которые могут коррозировать с выделением водорода в растворах при рН=2…
а) цинк; б) медь; в) серебро.
12. Какие продукты коррозии образуются при нарушении никелевого покрытия на стали во влажном воздухе, если φо(Fe2+/Fe) = – 0,44 В; φо(Ni2+/Ni) = – 0,25, В ?
а) Fe(OH)2; б) Ni(OH)2; в) Fe(OH)3 .
13. Какое железо коррозирует в кислой почве быстрее – находящееся в контакте с оловом или медью, если 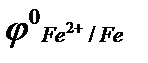 = – 0,44, В;
= – 0,44, В; 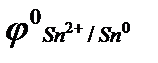 = – 0,12, В;
= – 0,12, В; 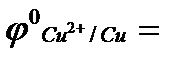 + 0,34, В?
+ 0,34, В?
а) с медью; б) с оловом; в) не коррозирует.
14. При нарушении оловянного покрытия на стальном изделии в морской воде (рН=8) на катоде протекает реакция…
а) О2 + 2Н2О +4е → 4ОН- ; б) О2 + 4Н+ + 4е →2Н2О; в) 2Н+ + 2е → Н2.
15. Присадки какого металла не вызывают коррозии алюминия в нейтральной среде? Ответы подтвердите схемой возникающего гальванического элемента (  – 1,67, В;
– 1,67, В; 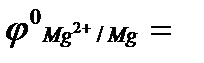 – 2,17, В;
– 2,17, В; 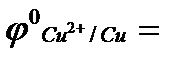 + 0,34, В;
+ 0,34, В; 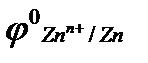 = – 0, 76, В).
= – 0, 76, В).
а) магния; Mg | 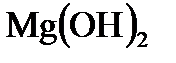 , O2, H2O| Al;
, O2, H2O| Al;
б) меди; Al | 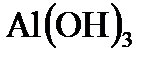 , O2, H2O | Cu;
, O2, H2O | Cu;
в) цинка; Al | 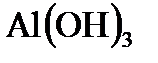 , O2, H2O | Zn.
, O2, H2O | Zn.
16. Какие из указанных металлов могут служить протектором для защиты стальных изделий от коррозии в морской воде, если 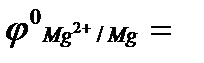 ‒ 2,17, В;
‒ 2,17, В; 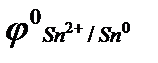 = – 0,14, В;
= – 0,14, В; 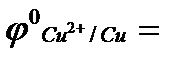 + 0,34, В;
+ 0,34, В; 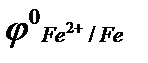 = – 0,44, В;
= – 0,44, В; 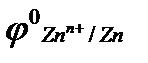 = ‒0,76, В)?
= ‒0,76, В)?
а) цинк и магний; б) олово; в) медь.
17. Для защиты медных изделий от коррозии во влажном воздухе в качестве катодного покрытия используется металл… ( 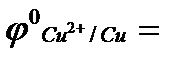 +0,34, В;
+0,34, В; 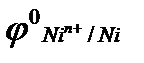 = ‒ 0,25, В;
= ‒ 0,25, В; 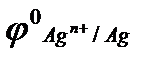 = 0,80, В;
= 0,80, В; 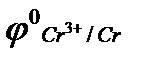 = - 0,71, В):
= - 0,71, В):
а) серебро; б) хром; в) никель.
18. Для защиты стальных изделий в качестве анодного покрытия используются металлы… ( 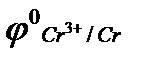 = ‒ 0,71, В;
= ‒ 0,71, В; 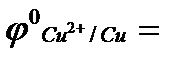 + 0,34, В;
+ 0,34, В; 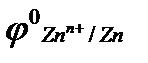 = ‒ 0,76, В;
= ‒ 0,76, В; 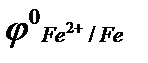 = – 0,44, В)
= – 0,44, В)
а) хром и цинк; б) медь и цинк; в) хром и медь.
19. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах (φо(Zn2+/Zn) = – 0,76, В; φо(Fe2+/Fe) = – 0,44 В)…
а) протекторная защита; Zn – протектор; б) покрытие из цинка;
в) катодная защита.
С учебными материалами учебно-методического комплекса дисциплины, с рабочей учебной программой и индивидуальными домашними заданиями можно ознакомиться на сайте: nacl. ucoz. ru
Приводятся типовые оценочные средства для текущей аттестации и критерии оценки к ним (по каждому виду оценочных средств) в соответствии с Положением о фондах оценочных средств образовательных программ высшего образования – программ бакалавриата, специалитета, магитратуры ДВФУ, утвержденным приказом ректора от 12.05.2015 №12-13-850.
Дата добавления: 2018-11-24; просмотров: 466; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
