Химическая кинетика и равновесие
1. Во сколько раз следует увеличить давление, чтобы начальная скорость образования NO2 по реакции: 2NO(г) + О2(г) → 2NO2(г) возросла в 8 раз?
а) увеличить в 2 раза; б) увеличить в 4 раза; в) увеличить в 8 раз.
2. Как влияет катализатор на скорость прямой и обратной реакции: H2(г) + I2(г) ↔ 2HI(г)
а) не влияет на равновесие;
б) уменьшает скорость обратной реакции;
в) увеличивает скорость прямой реакции.
3. Какое значение имеет температурный коэффициент скорости, если повышение температуры на 50 оС увеличивает скорость этой реакции в 1024 раза?
а) 4; б) 3; в) 2.
4. Кинетическое уравнение прямого направления процесса
N2(Г) + O2(Г) ↔ 2NO(Г) имеет вид…
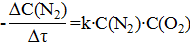
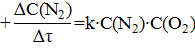
– ΔС(N2)/  = k∙C2 (NO)
= k∙C2 (NO)
5. Какое значение имеет энергия активации реакции, если при повышении температуры от 20 до 30 оС, скорость ее возрастает в 3 раза?
а) 81 кДж ⁄ моль; б) 53,6 кДж ⁄ моль; в) 162,5 кДж ⁄ моль.
6. Что характеризует энергия активации?
а) среднюю энергию переходного состояния; б) энергетический барьер;
в) энергию разрыва химических связей.
7. Константа равновесия реакции 3Fe(К)+4H2O(Г)=Fe3O4(К)+4H2(Г), выраженная через равновесные концентрации веществ в системе, имеет вид…
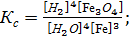
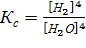 ;
; 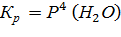 .
.
8. С ростом температуры значение константы равновесия реакции
Н2О(г) ↔ Н2(г) + 1/2О2(г) возрастает. Каков знак ΔН0298 прямого направления этой реакции?
|
|
|
ΔН0298>0
ΔН0298<0
по данным задания нельзя определить
9. Равновесная смесь, состоящая при 570 0C из FeO и продуктов его распада - железа Fe и магнетит Fe3O4 состоит из:
а) трех фаз; б) одной фазы; в) двух фаз.
10. Определить направление реакции H2(г) + I2(г) → 2HI(г) при 298 К при следующих концентрациях: С(H2) = C(I2) = 0,01 моль/дм3, С(HI) = 1,0 моль/дм3
а) в обратном направлении; б) в прямом направлении;
в) установилось равновесие.
Растворы неэлектролитов
1. Какую массу метанола (СН3ОН) должен содержать раствор с концентрацией 0,1 моль/л, если объем раствора составляет 0,5 литра?
а) 1,6 г; б) 32 г; в) 3,2 г.
2. Какую массу этанола (С2Н5ОН) должен содержать раствор с концентрацией 1 моль/кг, если масса растворителя составляет 0,25 кг?
а) 11,5 г; б) 46 г; в) 23 г.
3. При растворении 98 г Н2SО4 в 800 г воды температура повысилась на 22,4 К. Определить энтальпию растворения Н2SО4, если удельная теплоемкость составляет 3,76 Дж/(г·К).
а) – 75,6 кДж/моль; б) – 37,8 кДж/моль; в) + 37,8 кДж/моль.
4. Изотоническими называются растворы…
а) с одинаковым осмотическим давлением; б) с одинаковым давлением пара; в) с одинаковой молярной концентрацией.
5. Для повышения температуры кипения раствора следует…
а) увеличить моляльную концентрацию; б) понизить внешнее давление; в) разбавить раствор.
|
|
|
6. Чему равно отношение масс формалина (НСОН) и глюкозы (С6Н12О6) в растворах с равными объемами при одинаковой температуре и с одинаковым осмотическим давлением?
а) 1:6; б) 1:1; в) 2:1.
7. Раствор, содержащий 133,5 г AlCl3 в 500 г воды, закипает при t = 103,64 оС. Определить кажущуюся степень диссоциации (α).
а) 0,88; б) 0,95; в) 0,70.
8. В 180 г воды содержится 34,2 г сахарозы (С12Н22О11). Найти давление насыщенного пара над раствором при 1000С, если Р0(Н2О) составляет 101,3 кПа.
а) 100,297 кПа; б) 10,13 кПа; в) 90,3 кПа.
9. Водный раствор неэлектролита закипает при температуре 373,52 К. Какова моляльная концентрация этого раствора?
а) 1 моль/кг; б) 0,1 моль/кг; в) 0,01 моль/л.
10. Водный раствор неэлектролита закипает при температуре 101,04 К. Какова моляльная концентрация этого раствора?
а) 2 моль/кг; б) 0,1 моль/кг; в) 0,01 моль/кг.
Растворы электролитов
1. Чему равна концентрация ионов калия в 0,1 М растворе сульфита калия, если степень диссоциации соли равна 0,75?
а) 0,15 М; б) 1,5 М; в) 0,75 М.
2. Какова концентрация ионов водорода в 0,1 М растворе HCN, если константа диссоциации кислоты равна 7,2∙10-10?
а) 8,5∙10-6 М; б) 8,5∙10-5 М ; в) 8,5∙10-8 М.
3. Рассчитать степень диссоциации и константу диссоциации в 0,06 М растворе слабого бинарного электролита, если 0,055 М молекул остались недиссоциированными.
|
|
|
а) 8,3 %; 4,1∙10-4 ; б) 9 %; 4,9∙10-4 ; в) 92 %; 5,1∙10-2 .
4. Что такое pH раствора?
а) pH = - lg [Н+]; б) pH = lg [Н+]; в) pH = - lg [ОH–].
5. Если pH изменится на две единицы, во сколько раз изменится концентрация ионов водорода?
а) в 102 раз; б) в два раза; в) в 0,5 раза.
6. У какого из растворов наибольшее значение pH?
а) [ОH–] = 10-4 М; б) [Н+] = 10-7 М; в) [ОH–] = 10-7 М.
7. Чему равна концентрация ионов водорода, если в растворе рН = 10?
а) 10-10 М; б) 10-7 М; в) 10-4 М.
8. Чему равен гидроксильный показатель (рОН) в 5∙10-4 М растворе Н2SO4 ?
а) 11; б) 3; в) 7.
9. Определить степень диссоциации NaOH в 0,01 М растворе, если рН раствора равен 11,97.
а) 0,93; б) 0,95; в) 0,98.
10. Чему окажется равен pH, если смешать равные объемы 0,005 М раствора гидроксида натрия и 0,01 М раствора азотной кислоты?
а) 2,6; б) 2,85; в) 9,7.
Ионообменные реакции
1. Закончите уравнение, указав в ответе значение молекулярной массы газообразного продукта реакции: HNO3 + K2CO3 ®
а) 44; б) 101; в) 18.
2. Закончите уравнение, указав в ответе значение молекулярной массы малорастворимого продукта реакции: AgNO3 + CaCl2 ®
а) 143,5; б) 170; в) 164.
Дата добавления: 2018-11-24; просмотров: 714; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
