Коллигативные свойства растворов
Свойства растворов, которые не зависят от природы растворенных частиц, а зависят только от их концентрации, называются коллигативными.
Закон Рауля - основной закон, определяющий коллигативные свойства. Он устанавливает, что относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
 = N или
= N или  =
=  ,
,
 где Р
где Р  – давление насыщенного пара над чистым растворителем;
– давление насыщенного пара над чистым растворителем;
Р – давление насыщенного пара над раствором;
N - мольная доля растворенного вещества;
ν  , ν
, ν  – количество моль растворенного вещества и растворителя.
– количество моль растворенного вещества и растворителя.
Закон Рауля имеет ряд важных следствий:
I. Понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя прямо пропорционально моляльной концентрации растворенного вещества.
 Т
Т  = К
= К  С
С  = К
= К 
 ,
,
где  Т
Т  = Т
= Т 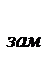 (растворителя) – Т
(растворителя) – Т  (раствора), С
(раствора), С  - моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,
- моляльная концентрация, моль/кг, m (X) – масса растворенного вещества Х, г,  - масса растворителя, г, К
- масса растворителя, г, К  - криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя.
- криоскопическая постоянная растворителя, которая показывает на сколько градусов ниже замерзает раствор, содержащий 1моль растворенного вещества на 1000 г растворителя по сравнению с температурой замерзания чистого растворителя.
Анализ уравнения показывает, что:
а) водные растворы с одинаковой моляльностью разных нелетучих неэлектролитов замерзают при одинаковой температуре;
|
|
|
б) понижение температуры замерзания растворов с одинаковой моляльностью одного и того же нелетучего неэлектролита в разных растворителях зависит только от химической природы этого растворителя.
II. Повышение температуры кипения раствора по сравнению с температурой кипения растворителя прямо пропорционально моляльной концентрации раствора.
 Т
Т  = Е
= Е 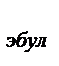 С
С  = Е
= Е 
 ,
,
где  Т
Т  = Т
= Т  (раствора) – Т
(раствора) – Т  (растворителя), Е
(растворителя), Е  - эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя.
- эбулиоскопическая постоянная растворителя, которая показывает на сколько градусов выше кипел бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя по сравнению с температурой кипения чистого растворителя.
Закон Вант-Гоффа. Осмотическое давление в разбавленных растворах неэлектролитов прямо пропорционально молярной концентрации раствора и абсолютной температуре.
Р  = С(Х)RT,
= С(Х)RT,
где С(Х) – молярная концентрация вещества Х, моль/л, R – универсальная газовая постоянная (8,314 кПа∙л/моль∙К), Т – температура, К.
Законы Рауля и Вант-Гоффа можно использовать для количественного описания свойств электролитов, если в их выражение ввести поправочный коэффициент i (изотонический коэффициент).
 Т
Т  = i К
= i К  С
С  ;
;  Т
Т  = i Е
= i Е 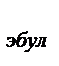 С
С  ; Р
; Р  = i С(Х)RT.
= i С(Х)RT.
Изотонический коэффициент( i) показывает, во сколько раз число частиц в растворе электролита больше общего числа растворенных молекул. Зная изотонический коэффициент i, можно для данного раствора электролита установить относительную долю молекул, распавшихся на ионы, т.е. степень диссоциации электролитa (α):i = 1 +  (n-1),
(n-1),  =
= 
 ,
,
|
|
|
где n – число ионов, образующих молекулу электролита.
Пример 1. Вычислить осмотическое давление при 27  С раствора, в 500 мл которого содержится 20 г сахара.
С раствора, в 500 мл которого содержится 20 г сахара.
Решение: Сахароза С  Н
Н  О
О  – неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению:
– неэлектролит, поэтому осмотическое давление раствора сахарозы рассчитываем по уравнению:
Р  = С(С
= С(С  Н
Н  О
О  )RT,
)RT,
C(C  H
H  O
O  ) =
) =  =
=  = 0,117 моль/л
= 0,117 моль/л
R = 8,314  , T = 27+273 = 300 K
, T = 27+273 = 300 K
P  = 0,117
= 0,117  ∙8,314
∙8,314  ∙300 = 291,8 кПа
∙300 = 291,8 кПа 
Ответ: P  = 291,8 кПа
= 291,8 кПа
Пример 2. Давление пара воды 23,8 мм.рт.ст. при 25  С. Какое будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре?
С. Какое будет давление пара над раствором, содержащим 17,1 г сахара в 90 г воды при той же температуре?
Решение: Находим количество моль сахара и воды.
М(Н  О) = 18 г/моль: n(H
О) = 18 г/моль: n(H  O) =
O) =  =
=  = 5 моль
= 5 моль
М(С  Н
Н  О
О  )=342 г/моль: n(C
)=342 г/моль: n(C  H
H  O
O  ) =
) =  =
=  = 0,05 моль
= 0,05 моль
Используя закон Рауля, находим давление насыщенного пара над чистым растворителем:
P = P 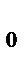 (1 -
(1 -  ) = 23,8 (1-
) = 23,8 (1-  ) = 23,56 ( мм. рт. ст.)
) = 23,56 ( мм. рт. ст.)
Ответ: Р = 23,56 мм. рт.ст.
|
|
|
Пример 3. Определить молярную массу глицерина, если 4,4 % раствор его в воде кипит на 0,26  C выше, чем чистая вода.
C выше, чем чистая вода.
Решение: Глицерин является неэлектролитом, поэтому молярную массу находим из формулы  Т
Т  = Е
= Е 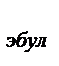 С
С  = Е
= Е 
 . Откуда,
. Откуда,
М(глицерина) =  =
=  = 92 г/моль.
= 92 г/моль.
Ответ: М (глицерина) = 92г/моль
Пример 4. Раствор, содержащий 25,5 г BaCl  в 750 мл воды, замерзает при - 0,756
в 750 мл воды, замерзает при - 0,756  С. Вычислить кажущуюся степень диссоциации соли.
С. Вычислить кажущуюся степень диссоциации соли.
Решение: BaCl2  Ba
Ba  + 2Cl
+ 2Cl  - cильный электролит.
- cильный электролит.
Вычисляем понижение температуры замерзания без учета ионизации соли.
 Т
Т  = К
= К  С
С  = К
= К 
 ,
,
M (BaCl  ) = 137+35,5∙2 = 208 г/моль
) = 137+35,5∙2 = 208 г/моль
m (H  O) = V(H
O) = V(H  O)
O)  (H
(H  O) = 750 мл ∙1 г/мл = 750 г
O) = 750 мл ∙1 г/мл = 750 г
К  (Н
(Н  О) = 1,86 К∙кг/моль.
О) = 1,86 К∙кг/моль.
 Т
Т  =
=  = 0,3 К , i =
= 0,3 К , i =  =
= 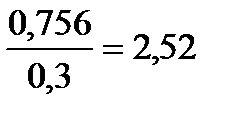 .
.
Из формулы i =1+  (n-1) выражаем
(n-1) выражаем  ,
,  =
=  .
.
Ответ:  =0,76 или 76%
=0,76 или 76%
Задания для самостоятельного решения:
1. Сколько граммов воды нужно взять для растворения 1 кг сахара, чтобы получить его 5 % раствор?
2. Определить молярную концентрацию эквивалента 8 % раствора серной кислоты (плотность раствора равна 1,06 г/мл).
3. Плотность 30 % раствора хлорида натрия равна 1,18 г/мл. Выразить состав раствора в мольных долях и в молях на 1 л раствора.
|
|
|
4. Плотность 2,3 % раствора аммиака равна 0,99 г/мл. Рассчитать молярную и моляльную концентрации раствора.
5. Сколько хлороводорода растворено в 50 мл 10 % раствора соляной кислоты (плотность раствора равна 1,05 г/мл)? Найти молярную концентрацию эквивалента соляной кислоты.
6. Сколько мл 70 % раствора нитрата калия (плотность раствора равна 1,6 г/мл) нужно взять, чтобы приготовить 500 мл раствора нитрата калия с молярной концентрацией 0,2 моль/л?
7. Вычислить массовую долю гидроксида калия в растворе с молярной концентрацией эквивалента 4,2 моль/л и плотностью 1,176 г/мл.
8. В каком объеме 0,2 Н раствора содержится 16 г сульфата меди (II)?
9. Смешали 100 мл 20 % раствора (плотность равна 1,1г/мл) и 200 мл 10 % раствора соляной кислоты (плотность равна 1,06 г/мл). Вычислить массовую долю и молярную концентрацию полученного раствора соляной кислоты.
10. Какова массовая доля азотной кислоты в растворе с молярной концентрацией 14,8 моль/л и плотностью 1,4 г/мл?
11. К 40 г фосфата натрия прилили 500 г 5 % раствора этого вещества. Вычислить массовую долю фосфата натрия в полученном растворе.
12. Рассчитать молярную концентрацию эквивалента 30 % раствора фосфорной кислоты (плотность раствора равна 1,18 г/мл).
Дата добавления: 2018-11-24; просмотров: 271; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
