Задачи для самостоятельного решения
1. Для реакции 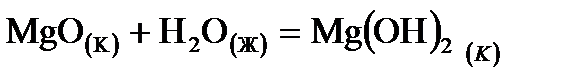 указать условие (Р-const или V- const), при котором тепловой эффект реакции будет большим. Возможен ли этот процесс в стандартных условиях? Ответ подтвердить расчетом.
указать условие (Р-const или V- const), при котором тепловой эффект реакции будет большим. Возможен ли этот процесс в стандартных условиях? Ответ подтвердить расчетом.
2. Определите изменение внутренней энергии при испарении 250 г воды при 290 К, допуская, что пары воды подчиняются законам идеальных газов. Удельная теплота парообразования при данной температуре составляет 2451 Дж/г.
3. Определите изменение энтропии при плавлении 82 г NaF (фтористый натрий), если энтальпия плавления равна 33,45 кДж/моль, а температура плавления 996 0С.
4. Возможно ли устойчивое существование оксида меди (II) в атмосфере водорода? Ответ подтвердить термодинамическим расчетом.
5. При взаимодействии метана и сероводорода образуются газообразный водород и жидкий сероуглерод ( 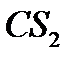 ). Вычислить изменение энтальпии и энтропии процесса в стандартных условиях. Определить ориентировочную температуру начала прямой реакции.
). Вычислить изменение энтальпии и энтропии процесса в стандартных условиях. Определить ориентировочную температуру начала прямой реакции.
6. Вычислить изменение внутренней энергии при испарении 32 г метанола при температуре кипения 65,7 0С , если удельная теплота испарения составляет 1,104 кДж/г.
7. Возможно ли восстановление в стандартных условиях оксида алюминия водородом? При какой температуре эта реакция теоретически становится возможной?
8. Какая степень окисления для свинца наиболее устойчивая при стандартных условиях в системе: 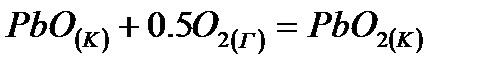 . Доказать расчетом.
. Доказать расчетом.
9. Возможно ли существование в природных условиях Земли свободного металлического натрия? Ответ подтвердить термодинамическим расчетом.
|
|
|
10. Какое количество тепла поглощается или выделяется в час на обогатительной фабрике при обжиге сульфидной руды цинка (ZnS) до получения оксида цинка, если производительность фабрики составляет 100 кг руды в час?
11. Рассчитайте изменение внутренней энергии при испарении 1 кг воды при 423 К, если теплота испарения при этой температуре равна 2110 кДж/кг. Считать пар идеальным газом.
12. При какой температуре начинается процесс разложения карбоната кальция на оксид кальция и углекислый газ? Возможен ли этот процесс при стандартной температуре
Контрольные вопросы:
1. Какие из следующих термодинамических функций относятся к функциям состояния: теплота, энтропия, свободная энергия Гиббса, работа расширения газа, энтальпия, изохорно-изотермический потенциал?
2. Какой смысл имеют знаки ’’плюс” или ”минус” перед термодинамическими функциями: теплотой, энтальпией, свободной энергией Гиббса?
3. Какие выводы можно сделать о конкретной химической реакции, если изменение следующих термодинамических функций отрицательно: а) энтальпии; б) энтропии; в) свободной энергии Гиббса?
4. В каком случае для оценки теплового эффекта реакции используется: а) первое следствие закона Гесса; б) второе следствие закона Гесса?
|
|
|
5. Как связаны между собой тепловой эффект и изменение энтальпии процесса? Укажите знак ΔH для экзо- и эндотермической реакции.
6. Подтвердите физический смысл энтропии математическими формулами и примерами.
7. Каким образом производят расчет свободной энергии Гиббса: а) по величинам свободных энергий образования веществ; б) по энтальпийному и энтропийному факторам; в) по величине электродвижущей силы процесса; г) по константе химического равновесия при заданной температуре?
8. Почему введены три критерия направления самопроизвольных процессов ΔS, ΔG, ΔF?
Химическая кинетика
Выучить понятия:
1. скорость химической реакции: истинная и средняя
2. константа скорости химической реакции
3. порядок и молекулярность реакции
4. температурный коэффициент скорости реакции
5. энергия активации
Необходимо знать:
1. кинетические уравнения химических реакций разного порядка
2. зависимость константы скорости химической реакции от различных факторов
3. правило Вант-Гоффа
4. уравнение Аррениуса
5. связь между энтальпией реакции и энергией активации прямой и обратной реакций.
|
|
|
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени (τ, с).
Для гомогенной реакции v = 
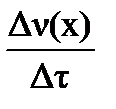 [
[ 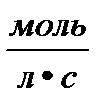 ]
]
Для гетерогенной реакции v = 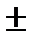
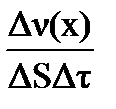 [
[ 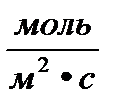 ]
]
Важнейшие факторы, влияющие на скорость химических реакций: природа и концентрация реагирующих веществ, температура процесса, наличие катализатора.
Зависимость скорости химической реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна действующим массам – молярным концентрациям реагирующих веществ, взятым в степени соответствующих стехиометрических коэффициентов (для простых реакций) или в степени определяемой опытным путем (для сложных реакций).
Например, для простой реакции aA + bB = cC + dD
v = kC  C
C 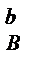 , n
, n  = a + b
= a + b
для сложной реакции aA +bB = cC + dD
v = kC 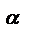 C
C 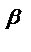 , n
, n 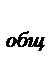 =
= 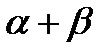
Cумма показателей степеней в кинетическом уравнении называется общим порядком реакции (n).
Частный порядок или порядок по данному веществу определяется как показатель степени концентрации этого вещества:
для простой реакции n  = a, n
= a, n  = b
= b
|
|
|
для сложной реакции n  =
= 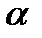 , n
, n 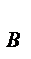 =
= 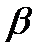
Порядок – эмпирический параметр, показывающий зависимость скорости реакции от концентрации реагентов. Он может принимать любые значения (целые, дробные, ноль, положительные, отрицательные).
Молекулярность реакции – число молекул одновременно участвующих в элементарном акте реакции. Принимает значения 1,2, 3. Определяется по самой медленной стадии процесса, без знания механизма реакции молекулярность определить невозможно.
В случае гетерогенных процессов в выражение закона действия масс не входит концентрация веществ, находящихся в конденсированной фазе, поскольку реакция протекает лишь на их поверхности.
Константа скорости реакции k – фундаментальный кинетический параметр, не зависящий от концентраций реагентов, а потому остающийся неизменным в течение реакции.
Константа скорости численно равна скорости химической реакции при концентрациях всех реагирующих веществ равных 1 моль/л.
Константа скорости зависит от природы реагирующих веществ, температуры, наличия в реакционной среде катализатора. 
Зависимость скорости химической реакции от температуры выражается уравнением Вант-Гоффа: v 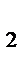 = v∙
= v∙ 
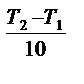
 ,
,
где v 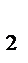 - cкорость реакции при температуре Т
- cкорость реакции при температуре Т 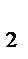 ;
;
v 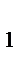 - cкорость реакции при температуре Т
- cкорость реакции при температуре Т 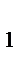 ;
;
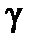 - температурный коэффициент скорости реакции, равный для
- температурный коэффициент скорости реакции, равный для
большинства гомогенных процессов 2 ~ 4.
Уравнение Вант-Гоффа показывает, что при повышении температуры на каждые 10  С скорость химической реакции возрастает в 2 ~ 4 раза.
С скорость химической реакции возрастает в 2 ~ 4 раза.
Более точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса: k = k 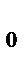 e
e 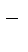
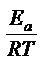 ,
,
где k – константа скорости реакции при температуре Т; k 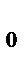 - предэкспоненциальный множитель, пропорциональный числу столкновений реагирующих частиц; Е
- предэкспоненциальный множитель, пропорциональный числу столкновений реагирующих частиц; Е  - энергия активации (кДж/моль) реакции, то избыточное количество энергии которым должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию; R – универсальная газовая постоянная, ее значение 8,314 ∙10-3
- энергия активации (кДж/моль) реакции, то избыточное количество энергии которым должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию; R – универсальная газовая постоянная, ее значение 8,314 ∙10-3 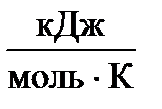 .
.
Уравнение Аррениуса для температурного интервала от 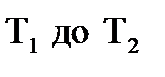 имеет следующий вид:
имеет следующий вид:
ln 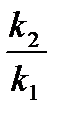 =
= 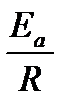 (
( 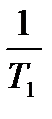 ―
― 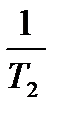 ) или lg
) или lg 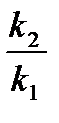 =
= 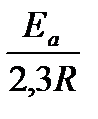 (
( 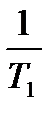 ―
―  ),
),
где k  - константа скорости реакции при температуре Т
- константа скорости реакции при температуре Т 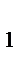 ; k
; k 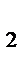 - константа скорости реакции при температуре Т
- константа скорости реакции при температуре Т 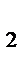 .
.
На скорость химических реакций существенное влияние оказывают катализаторы – вещества, ускоряющие данную реакцию за счет образования промежуточных соединений с реагентами и выходящие из химического процесса без изменения. Уравнение Аррениуса для каталитического процесса имеет вид 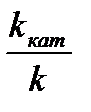 =
= 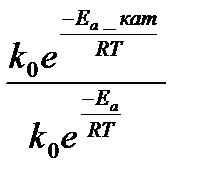 = е
= е 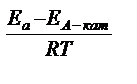 ,
,
где k  - константа скорости каталитической реакции с энергией активации Е
- константа скорости каталитической реакции с энергией активации Е  ; k – константа скорости некаталитической реакции с энергией активации Е
; k – константа скорости некаталитической реакции с энергией активации Е 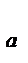 .
.
Дата добавления: 2018-11-24; просмотров: 502; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
