Задания для самостоятельного решения и примеры решения задач
Раздел 1. Атомно-молекулярный уровень организации вещества
Основы атомно-молекулярного учения
При рассмотрении этой темы основное внимание уделить разделам:
1. Газовые законы;
2. Закон эквивалентов.
Усвоить основные понятия: моль, молярная масса, молярный объем газа, эквивалент, молярная масса эквивалента, молярный объем эквивалента вещества.
1. Состояние газа характеризуется его температурой T, давлением P и объемом V. Нормальные условия для газов P 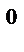 = 101,3 кПa = 1 атм = 760 мм. рт.ст., T
= 101,3 кПa = 1 атм = 760 мм. рт.ст., T 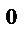 = 00С = 273 K.
= 00С = 273 K.
Закон Авогадро: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
I. Одинаковое число молекул различных газов при одинаковых физических условиях (T, P) занимает одинаковый объем.
Если число молекул равно числу Авогадро N 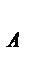 = 6,02∙10
= 6,02∙10  (1 моль газа), то при нормальных условиях они занимают объем 22,4 л (
(1 моль газа), то при нормальных условиях они занимают объем 22,4 л ( 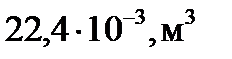 )
)
V  = 22,4 л/моль.
= 22,4 л/моль.
Плотность любого газа можно рассчитать по формуле 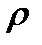 =
= 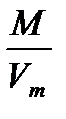 ,
,
где М - молярная масса газа (г/моль);
V  - молярный объем газа (л/моль).
- молярный объем газа (л/моль).
II. Относительная плотность одного газа (1) по другому (2) равна отношению их молярных масс при заданном давлении и температуре:
D 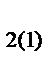 =
= 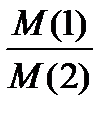
Относительная плотность газа по водороду D 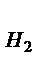 (Х) =
(Х) = 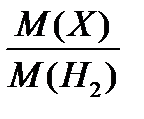 .
.
М (Х) = D 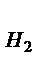 (Х) ∙ М (Н
(Х) ∙ М (Н 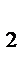 ) =
) = 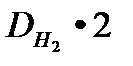
Относительная плотность газа по воздуху D воздух (Х) = 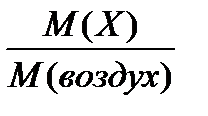 .
.
М (Х) = D 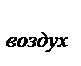 (Х)∙М (воздуха) = D воздух∙29
(Х)∙М (воздуха) = D воздух∙29
При низких температурах и высоких давлениях газы неидеальны и не подчиняются закону Авогадро.
|
|
|
Объединенный газовый закон: Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная. 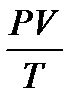 = const или
= const или 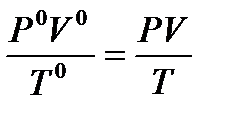
P0, V0, T0- соответственно давление, объем и температура данной массы газа при н. у.
Уравнение Менделеева – Клапейрона: PV = 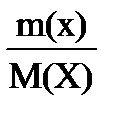 RT
RT
P- давление газа; T- температура (К); V- объем газа; М(Х)- молярная масса газа (г/моль); m(х)- масса газа (г); R- универсальная газовая постоянная = 8,314 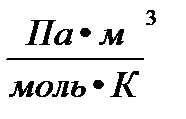 = 8,314
= 8,314 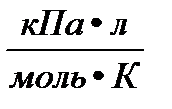 = 8,314
= 8,314 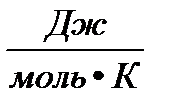 = 8,314 ∙10
= 8,314 ∙10 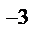
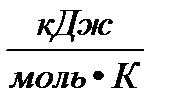 = 0,082
= 0,082 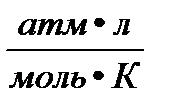 = 62,36
= 62,36 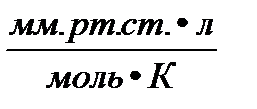 = 1,986
= 1,986 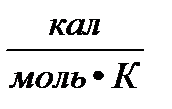 .
.
Закон Дальтона: Общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме давлений газов, составляющих смесь: P = p 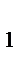 + p
+ p 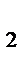 + p
+ p 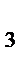 +… + p n,
+… + p n,
где P- общее давление; p 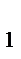 ,p
,p 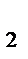 ,p
,p 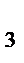 ,…,p n- парциальные давления газов 1,2,3,…,n.
,…,p n- парциальные давления газов 1,2,3,…,n.
Парциальным давлением газа в смеси называется давление, которое производил бы данный газ, если бы он один занимал весь объем, занимаемый смесью газов, при данной температуре.
Закон эквивалентов
Эквивалент f 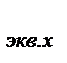 Х - некая реальная или условная частица вещества Х, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях.
Х - некая реальная или условная частица вещества Х, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях.
|
|
|
Фактор эквивалентности f 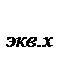 - число, показывающее какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
- число, показывающее какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
f 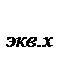 =
= 
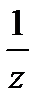 , где z- либо число ионов водорода, участвующих в реакции (для кислот); - либо число гидроксогрупп, участвующих в реакции (для оснований); - либо число ионов водорода, способных заместиться катионами, входящими в состав соли (для солей); - либо число, принятых или отданных электронов в окислительно-восстановительной реакции.
, где z- либо число ионов водорода, участвующих в реакции (для кислот); - либо число гидроксогрупп, участвующих в реакции (для оснований); - либо число ионов водорода, способных заместиться катионами, входящими в состав соли (для солей); - либо число, принятых или отданных электронов в окислительно-восстановительной реакции.
Эквивалент и фактор эквивалентности зависят от реакции, в которой участвует соединение.
H 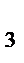 PO
PO 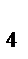 +3NaOH = Nа3PO
+3NaOH = Nа3PO 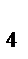 +3H
+3H 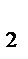 O – кислотно-основная реакция
O – кислотно-основная реакция
f 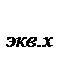 : 1/3 1/1 1/3 1/2;
: 1/3 1/1 1/3 1/2;
H 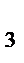 PO
PO 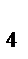 +2NaOH = Na
+2NaOH = Na 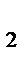 HPO
HPO 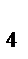 +2H
+2H 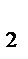 O – кислотно-основная реакция
O – кислотно-основная реакция
f 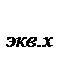 : 1/2 1/1 1/2 1/2;
: 1/2 1/1 1/2 1/2;
H 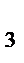 PO
PO 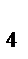 +NaOH = NaН2PO
+NaOH = NaН2PO 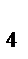 +H2O – кислотно-основная реакция
+H2O – кислотно-основная реакция
f 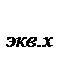 : 1/1 1/1 1/1 1/2;
: 1/1 1/1 1/1 1/2;
Zn + 2HCl = ZnCl2 + H2 - окислительно-восстановительная реакция
f 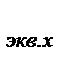 : 1/2 1/1 1/2 1/2
: 1/2 1/1 1/2 1/2
Zn – 2e =Zn  - окисление, Zn -восстановитель
- окисление, Zn -восстановитель
2H+1 +2e = H2 – восстановление, 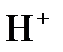 - окислитель;
- окислитель;
S + O2 = SO2 - окислительно-восстановительная реакция
f 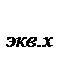 : 1/4 1/4 1/4
: 1/4 1/4 1/4
|
|
|
S – 4e = S 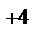 - окисление, S - восстановитель
- окисление, S - восстановитель
O2+ 4e = 2O 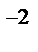 - восстановление,
- восстановление, 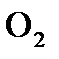 - окислитель.
- окислитель.
Молярный объем эквивалента вещества Х: V  (
( 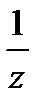 Х) – это объем одного моль эквивалента газообразного вещества Х: V
Х) – это объем одного моль эквивалента газообразного вещества Х: V  (
( 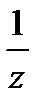 Х) =
Х) = 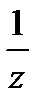 V
V  (Х).
(Х).
Молярная масса эквивалента вещества Х: М ( 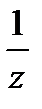 Х) – это масса одного моль эквивалента вещества Х, равная произведению фактора эквивалентности
Х) – это масса одного моль эквивалента вещества Х, равная произведению фактора эквивалентности 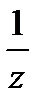 на молярную массу этого вещества: М (
на молярную массу этого вещества: М ( 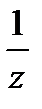 Х) =
Х) = 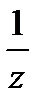 М (Х).
М (Х).
Количество вещества эквивалента n ( 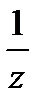 Х) – это число моль вещества эквивалента: n (
Х) – это число моль вещества эквивалента: n ( 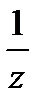 Х) =
Х) = 
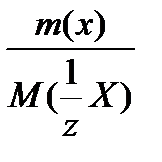 .
.
Закон эквивалентов: Вещества взаимодействуют друг с другом в строго эквивалентных количествах. n ( 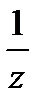 Х) = n (
Х) = n ( 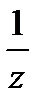 У)
У)
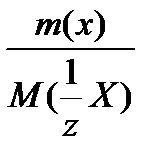 =
= 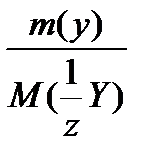 или
или 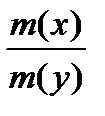 =
= 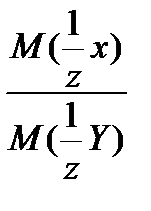 ,
,
где m(х), m(y) – массы взаимодействующих без остатка веществ;
M ( 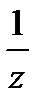 Х), M(
Х), M( 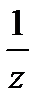 Y) –соответствующие молярные массы эквивалентов.
Y) –соответствующие молярные массы эквивалентов.
Для веществ, взаимодействующих в растворе, закон эквивалентов может иметь вид С ( 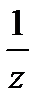 Х) ∙V(Х) = С (
Х) ∙V(Х) = С ( 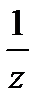 Y) ∙V( Y),
Y) ∙V( Y),
где: С( 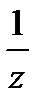 Х) – молярная концентрация эквивалента вещества Х; C(
Х) – молярная концентрация эквивалента вещества Х; C( 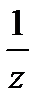 Y) – молярная концентрация эквивалента вещества Y; V(X), V(Y) – объемы соответствующих растворов.
Y) – молярная концентрация эквивалента вещества Y; V(X), V(Y) – объемы соответствующих растворов.
Дата добавления: 2018-11-24; просмотров: 267; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
