Примеры решения задач и задания для самостоятельного решения
Основы атомно-молекулярного учения
Пример 1. Какой объем при н.у. занимают: а) 0,5 моль водорода; б) 32 г оксида азота (II)?
Дано:
n(H 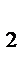 )= 0,5 моль;
m(NO)= 32 г;
н.у., V0 (m) = 22,4 л/моль )= 0,5 моль;
m(NO)= 32 г;
н.у., V0 (m) = 22,4 л/моль
| Решение На основании закона Авогадро (I следствие) а) V0 (H V0 (Н б) n (NO) =
V0 (NO) = V0 (NO) =
Ответ: V0(H2) = 11,2 л; V0(NO) = 23,9 л |
Найти:
V0 (H 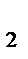 )}?
V0 (NO)}? )}?
V0 (NO)}?
|
Пример 2. Вычислить объем, занимаемый 7 г оксида углерода (II) при 70C и 103974 Па.
| Дано: m(СO)= 7 г; t = 70C = (7+273) =280К; Т=280К; Р(СО) = 103974 Па; М(СО) = 28 г/моль | Решение На основании уравнения Менделеева – Клапейрона P(СО)∙ V(СО) = V(СО)= = 5,6 л
Ответ: V(СО) = 5,6 л.
|
| Найти: V(CO) }? |
Пример 3. Определить парциальные давления азота и кислорода в смеси объемом 7л, если общее давление в смеси равно 8,2МПа, а объемы смешиваемых газов равны 2л и 5л соответственно.
| Дано: Vсмеси (N2+O2) = 7 л; Робщ. = 8,2 МПа; V(N2) = 2 л; V(О2) = 5 л | Решение На основании закона Дальтона а)объемные доли газовых компонентов Nоб = Vi/ Vобщ: Nоб(N2)= 2/7, Nоб(О2)= 5/7; б) парциальные давления газов Рi = Nоб(i)∙ Робщ Р(N2) = (2/7)∙8,2 = 2,34 МПа, Р(О2) = (5/7)∙8,2 = 5,86 МПа.
Ответ: P (N2) = 2,34 MПа, P (O2) = 5,86 МПа. |
| Найти парциальные давления: Р(N2)}? Р(О2)}? |
Пример 4. Двухвалентный металл массой 0,604 г вытеснил из кислоты 581 мл водорода, собранного над водой при 18 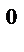 С и давлении 105,6 кПа. Давление насыщенного водяного пара при 18
С и давлении 105,6 кПа. Давление насыщенного водяного пара при 18 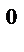 С составляет 2,1 кПа. Найдите молярную массу эквивалента металла, укажите металл.
С составляет 2,1 кПа. Найдите молярную массу эквивалента металла, укажите металл.
|
|
|
Дано:
m(Me) = 0,604 г
В = 2
V(H2) = 581 мл = 0,581 л
t = 18 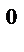 С
Т = (273+18)К
h = 2,1 кПа
Р = 105,6 кПа
н. у., на основании
закона Авогадро
VЭ(H2)=11,2 л
Т0 = 273К
Р0 = 101,3 кПа С
Т = (273+18)К
h = 2,1 кПа
Р = 105,6 кПа
н. у., на основании
закона Авогадро
VЭ(H2)=11,2 л
Т0 = 273К
Р0 = 101,3 кПа
| Решение Схема процесса: Ме +2HCl → MeCl2+ H2 На основании объединенного газового закона с поправкой на давление водяного пара находим объем выделившегося водорода при н.у. V0 ( H Согласно закону эквивалентов МЭ(Ме)= =12,15 г/моль. Молярная (атомная, А) масса металла определяется: А(Ме) = В∙ МЭ(Ме)= 2∙12,15 = 24,3 г/моль.
Ответ: искомый металл – магний Mg |
| Найти: МЭ(Ме) - ? А(Ме) -? |
Пример 5. При сжигании 1,635г цинка в струе кислорода получено 2,035г оксида цинка. Вычислите молярную массу эквивалента цинка.
| Дано: m(Zn) = 1,635 г m(ZnО) = 2,035 г МЭ(О2) = 8 г/моль | Решение Уравнение процесса: 2Zn + О2 = 2 ZnО, Находим массу присоединенного кислорода (закон сохранения массы) m(O) = m(ZnO) – m(Zn) = 2,035г – 1,635г = 0,400 г. Согласно закону эквивалентов МЭ(Zn) =
Ответ: МЭ(Zn) = 32,7 г/моль |
| Найти: МЭ(Zn) -? |
Задания для самостоятельного решения:
1. Что такое явление аллотропии и чем оно вызвано?
2. Какое количество атомарного кислорода (O) содержится в угольной кислоте (H2CO3) количеством 1 моль?
|
|
|
3. Руда содержит 90% FeS2 и 10% FeAsS. Найдите массу серы (S), содержащейся в 1 тонне руды.
4. Какой объём газа, измеренный при нормальных условиях, выделится при растворении алюминия массой 10,8 г в избытке раствора соляной (HCI) кислоты?
5. Выведите формулу кристаллогидрата хлорида бария, если известно, что при прокаливании 36,6г соли потеря в массе составляет 5,4г.
6. Одинаковое ли число молекул в 0,5г азота(N2) и 0,5г метана (CH4)?
7. Выведите формулу кристаллогидрата фосфата натрия, если известно, что массовая доля соли в нём составляет 84,2% ?
8. Определите плотность по водороду газовой смеси, состоящей из 56л аргона (Ar) и 28л азота (N2).
9. Какие массы алюминия (AI) и оксида железа (Fe2O3) следует взять для получения железа массой 140г ?
10. Оксид углерода (IV) (CO2), полученный при сжигании угля массой 50г, пропустили через раствор гидроксида бария (Ba(OH)2). Какая масса осадка образовалась, если массовая доля углерода в угле составляет 90%?
11. Что называется относительной атомной массой? Укажите относительные атомные массы азота (N2), хрома (Cr) и железа ( Fe).
12. Какое количество атомарного бора содержится в 2 моль тетрабората натрия (Na2B4O7)?
|
|
|
13. Определите плотность по водороду аммиака.
14. Какой объём водорода может быть получен при действии на 20г цинка (Zn) 100мл 30% раствора соляной кислоты (HCI)?
15. Выведите истинную формулу углеводорода, плотность которого по водороду составляет 15, а массовое соотношение углерода к водороду составляет 4:1.
16. Дайте определение понятию моль. Сколько частиц содержит:
а)1 моль атомов водорода; б)1 моль молекул кислорода; в)1 моль ионов хлора?
17.Определите плотность по водороду паров гексана (C6H14).
18. Выведите истинную формулу вещества, содержащего 93,75% углерода (C) и 6,25% водорода (H), если плотность его по воздуху составляет 4,41.
19. Какую массу оксида кальция (CaO), можно получить при прокаливании 1тонны известняка, содержащего 80% карбоната кальция (CaCO3)?
20. Сплав содержит 85% магния (Mg) и 15% меди(Cu). Навеску сплава массой 8,52г обработали избытком соляной кислоты(HCI). Вычислите объём (при н.у.) выделившегося газа.
Контрольные вопросы :
1. Какие величины характеризуют газовое состояние вещества?
2. Каковы единицы измерения массы, объема, давления и температуры?
3. Что называется парциальным давлением газа? Как формулируется закон парциальных давлений Дальтона?
4. Что называется идеальным газом? При каких условиях газовые законы, выведенные для идеальных газов, могут быть без большой погрешности применены к реальным газам?
|
|
|
5. Если масса газа остается постоянной, какая зависимость существует между объемом, занимаемым данной массой газа, температурой и давлением?
6. Что называется универсальной газовой постоянной? Каков ее физический смысл? В каких единицах она измеряется?
7. Что называется абсолютной и относительной плотностью газа?
8. Какова зависимость между молекулярной массой газа и его относительной плотностью по водороду?
9. Что называется эквивалентом вещества? Что называется фактором эквивалентности вещества?
10. Является ли эквивалент постоянной характеристикой элемента?
12. Что называется моль вещества?
13. Перечислите методы определения молярной массы эквивалента.
14. Как вычислить молярную массу эквивалента сложного вещества (кислоты, основания, соли, оксида) в кислотно-основных реакциях?
15. Как вычислить фактор эквивалентности вещества, участвующего в окислительно-восстановительной реакции?
16. Дать формулировку закона эквивалентов и привести его математическое выражение.
Дата добавления: 2018-11-24; просмотров: 345; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

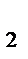 ) = 0,5 моль∙22,4 л/моль = 11,2 л
) = 0,5 моль∙22,4 л/моль = 11,2 л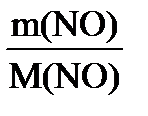 ; n (NO) =
; n (NO) = 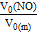
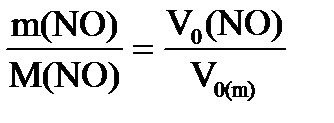 ; M (NO) = 30 г/моль;
; M (NO) = 30 г/моль;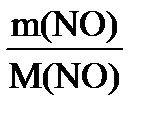 ∙ V0 (m) ;
∙ V0 (m) ;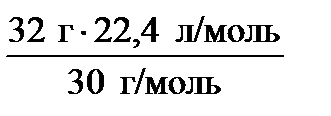 = 23,9 л.
= 23,9 л.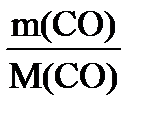 RT,
RT, =
= 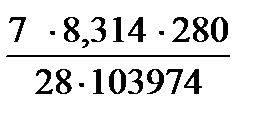 =0,0056 м
=0,0056 м 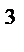
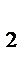 ) =
) = 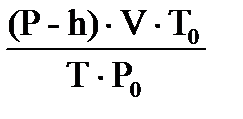 =
= 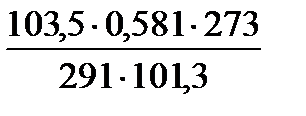 =0,557л.
=0,557л.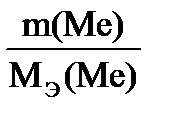 =
= 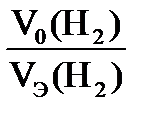
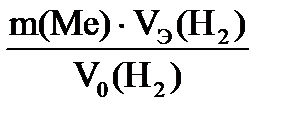 =
= 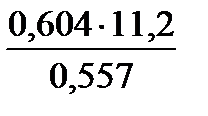 =
=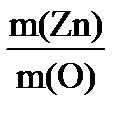 =
= 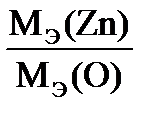
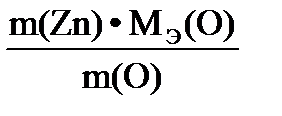 =
= 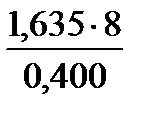 = 32,700 г/моль.
= 32,700 г/моль.