Примеры решения задач и задания для самостоятельного решения
Пример 1. Определить, как изменится скорость прямой реакции
2СО 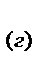 +О
+О 
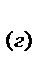 = 2СО
= 2СО 
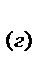 , если общее давление в системе увеличить в 4 раза.
, если общее давление в системе увеличить в 4 раза.
| Дано: 2СО(Г)+О2(Г)= 2СО2(Г) Р2 = 4Р1 | Решение:
Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрации реагирующих веществ возрастут в 4 раза. Согласно закону действия масс для гомогенных реакций начальная скорость реакции равна v  = k∙C = k∙C  ∙C ∙C 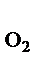 . После увеличения давления: v . После увеличения давления: v 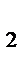 = k∙ (4C = k∙ (4C 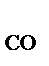 ) ) 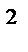 ∙4C ∙4C 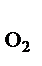 = k∙ 4 = k∙ 4 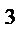 ∙C ∙C 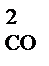 ∙C ∙C 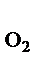 = = 64 k ∙C = = 64 k ∙C 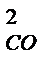 ∙C ∙C 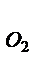 . . 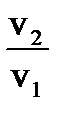 = = 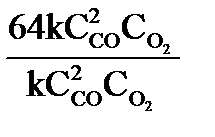 = 64. = 64.
|
Найти:
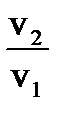 -? -?
| Ответ: после увеличения давления в 4 раза скорость реакции возросла в 64 раза |
Пример 2. При 1500 С некоторая реакция заканчивается за 16 мин. Температурный коэффициент реакции равен 2,5. Через какое время закончится эта реакция при 80  С? Как изменится скорость реакции?
С? Как изменится скорость реакции?
Дано:
t1 = 80  С
t2 = 1500 С
τ2 = 16 мин
γ = 2,5 С
t2 = 1500 С
τ2 = 16 мин
γ = 2,5
| Решение:
Согласно правилу Вант Гоффа: 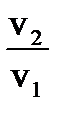 = = 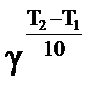 ; ;
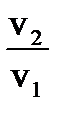 = 2,5 = 2,5 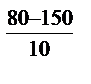 = 2,57 = 610,35. Скорость реакции при температуре 1500 С в 610,35 раз выше, чем при 80 = 2,57 = 610,35. Скорость реакции при температуре 1500 С в 610,35 раз выше, чем при 80  С. Зная, что скорость реакции и время её протекания обратно пропорциональны, заменяем соотношение скоростей соотношением времен С. Зная, что скорость реакции и время её протекания обратно пропорциональны, заменяем соотношение скоростей соотношением времен 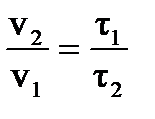 .
Следует: τ 1 = .
Следует: τ 1 = 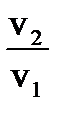 ∙ τ2 , τ 1 = 610,35 ∙16 = 9765,6 мин = 162,76 ч = 6,78 сут. ∙ τ2 , τ 1 = 610,35 ∙16 = 9765,6 мин = 162,76 ч = 6,78 сут.
|
| Найти: τ 1- ? | Ответ: при 80  С реакция закончится через 6,78 суток; скорость реакции уменьшится в 610,35 раз. С реакция закончится через 6,78 суток; скорость реакции уменьшится в 610,35 раз.
|
Пример 3. Определите энергию активации реакции
 ,
,
если константа скорости с температурой меняется следующим образом:
|
|
|
Т, К…………………..293,2 313,2 333,2
 …….9,60 18,16 39,96.
…….9,60 18,16 39,96.
| Дано: Т1 = 293,2К Т2 = 313,2К Т3 = 333,2К k1 = 9,60∙10-3 k2 =18,16∙10-3 k3 = 39,96∙10-3 | Решение:
Используя уравнение Аррениуса для различных температурных интервалов 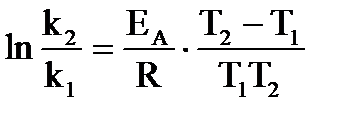 , находим:
1) для температурного интервала от 293,2 до 313,2 К , находим:
1) для температурного интервала от 293,2 до 313,2 К
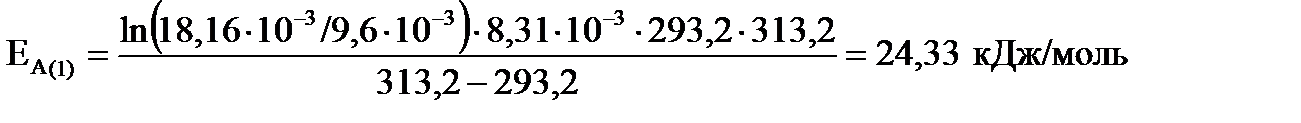 ;
2) для интервала температур от 313,2 до 333,2 К ;
2) для интервала температур от 313,2 до 333,2 К
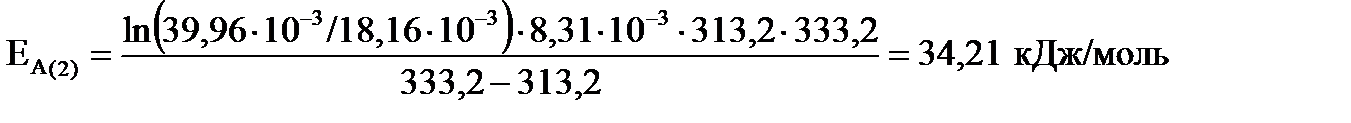 3) для интервала температур от 293,2 до 333,2 К
3) для интервала температур от 293,2 до 333,2 К
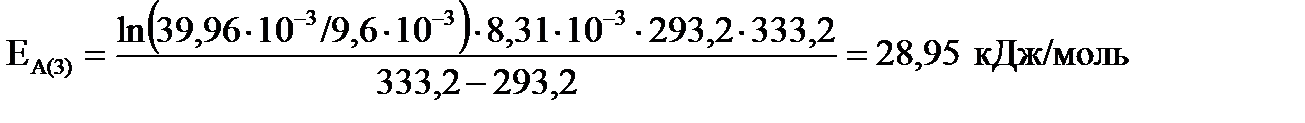 ; ;
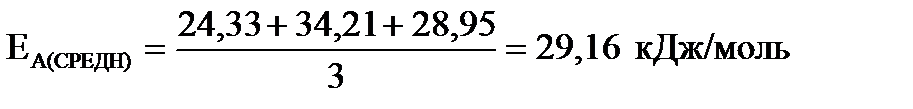
|
| Найти: ЕА (средн.) -? | Ответ: 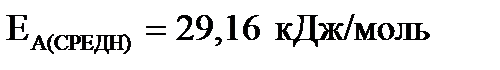
|
.
Задания для самостоятельного решения:
1. Записать выражение закона действия масс для данной реакции, указать общий порядок реакции и порядок по каждому, из участвующих в реакции, веществ. Как изменится скорость реакции при условии: а); б).
| уравнение реакции | а | б | |
| 1 | 2NO(г)+ Сl2(г) = 2NOCl(г) | повысить P в 4 раза | понизить CNO в 50 раз |
| 2 | 2CO(г) = CO2(г)+C(к) | понизить P в 5 раз | повысить C в 4 раза |
| 3 | N2O4(г) = 2NО2(г) | повысить P в 8 раз | понизить C в 7 раз |
| 4 | NO2(г)+CO(г) = NO(г)+CO2(г) | понизить P в 4 раза | повысить C в 80 раз |
| 5 | Н2(г)+Cl(г) = HCl(г)+H(г) | повысить P в 2 раза | понизить C в 20 раз |
| 6 | Cl2(г)+H(г) = HCl(г)+Cl(г) | понизить P в 7 раз | повысить C в 55 раз |
| 7 | 2NO2(г) = N2O4(г) | повысить P в 10 раз | понизить C в 99 раз |
| 8 | CaO(к)+СO2(г) = CаCO3(к) | понизить P в 6 раз | повысить C в 4 раза |
| 9 | HCl(г) = Н(г)+Cl(г) | повысить P в 8 раз | понизить C в 12 раз |
| 10 | NO(г)+О(г )= NO2(г) | понизить P в 9 раз | повысить C в 56 раз |
| 11 | (CH3)2CO(г) = C2H6(г)+CO(г) | повысить P в 2 раза | понизить C в 98 раз |
| 12 | 2H2O2(г)= 2H2O(г)+O2(г) | понизить P в 5 раз | повысить C в 65 раз |
*Р - давление в системе; С – концентрация вещества
|
|
|
2. Температурный коэффициент скорости реакции равен 3,2. Как изменится
скорость реакции, если повысить температуру на 400?
3. Как следует изменить температуру, чтобы скорость реакции увеличилась в 8 раз ( 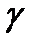 =2)?
=2)?
4. За какое время пройдет реакция при 600 С, если при 200 С она заканчивается за 40 с, а температурный коэффициент равен 2,3?
5. Вычислить температурный коэффициент скорости реакции, если понижение температуры на 40 К вызывает уменьшение скорости реакции в 140 раз.
6. При 1400 С реакция заканчивается за 30 с. Сколько времени потребуется для данной реакции при 200 С, если 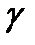 =2?
=2?
7. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции при уменьшении температуры с 1250 до 550 С?
8. При повышении температуры на 200 С скорость реакции возросла в 9 раз. Чему равен температурный коэффициент этой реакции и во сколько раз увеличится ее скорость при повышении температуры с 200 до 1000 С?
|
|
|
9. Температурный коэффициент скорости реакции равен 2,5. Как изменится ее скорость: а) при охлаждении реакционной смеси от 500 до 300 С; б) при повышении температуры на 600 С?
10. При повышении температуры от 200 до 400 С скорость реакции увеличилась в 6 раз. Вычислить температурный коэффициент и энергию активации реакции.
11. Вычислить температурный коэффициент скорости реакции гидролиза сахарозы в кислом водном растворе (100-500 С), Еа = 107 кДж/моль.
12. Как изменится скорость реакции при повышении температуры с 600 до 650 К, если энергия активации равна 26,6 кДж/моль?
13. Как изменится скорость реакции при повышении температуру до 500С, если энергия активации равна 125,5 кДж/моль?
14. После удаления катализатора из системы, энергия активации реакции возросла на 40 кДж/моль при температуре 370С. Как изменилась скорость реакции?
15. Реакция при 20 0С завершается за 60 с. Сколько для этого потребуется времени при 400С, если энергия активации равна 33,4 кДж/моль?
Контрольные вопросы:
1. Что называют скоростью химической реакции? В чем отличие понятий средней и истинной скоростей реакции? Какова размерность скорости химической реакции?
|
|
|
2. Какова формулировка основного закона химической кинетики – закона действия масс?
3. Какие факторы влияют на скорость химической реакции? В чем заключается различие кинетики гомогенных и гетерогенных химических реакций?
4. Что такое константа скорости химической реакции, от каких факторов она зависит?
5. Что такое порядок и молекулярность химической реакции? Как на основе этих понятий классифицируются химические реакции? Что называется общим и частным порядком реакции?
6. Что отражает кинетическое уравнение реакции? Написать уравнения реакции I, II, III порядков.
7. Какова зависимость скорости реакции от температуры? Что такое температурный коэффициент скорости реакции, в каких пределах он изменяется?
8. Что такое энергия активации реакции? Написать выражение зависимости скорости реакции от температуры и энергии активации (уравнение Аррениуса).
Что такое катализ? Каковы представления о механизме катализа? Влияет ли на энергию активации процесса введение катализатора?
Раздел 4. Растворы
Дата добавления: 2018-11-24; просмотров: 444; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
