ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА КРОВИ
Функции крови во многом определяются ее физико-химическими свойствами, к которым относятся: цвет, относительная плотность, вязкость, осмотическое и онкотическое давление, коллоидная стабильность, суспензионная устойчивость, рН, температура.
Цвет крови. Определяется наличием в эритроцитах соединений гемоглобина. Артериальная кровь имеет ярко-красную окраску, что зависит от содержания в ней оксигемоглобина. Венозная кровь темно-красная с синеватым оттенком, что объясняется наличием в ней не только окисленного, но и восстановленного гемоглобина и карбогемоглобина. Чем активнее орган и чем больше отдал кислорода тканям гемоглобин, тем более темной выглядит венозная кровь.
Относительная плотность крови колеблется от 1050 до 1060г/л и зависит от количества эритроцитов, содержания в них гемоглобина, состава плазмы. У мужчин за счет большего числа эритроцитов этот показатель выше, чем у женщин. Относительная плотность плазмы равна 1025-1034 г/л, эритроцитов – 1090 г/л.
Вязкость крови – это способность оказывать сопротивление течению жидкости при перемещениях одних частиц относительно других за счет внутреннего трения. В связи с этим, вязкость крови – это сложный эффект взаимоотношений между водой и макромолекулами коллоидов с одной стороны, плазмой и форменными элементами – с другой. Поэтому вязкость плазмы в 1,7-2,2 раза, а крови – в 4-5 раз выше, чем воды. Чем больше в плазме крупномолекулярных белков ( фибриногена), липопротеинов, тем ее вязкость больше. Вязкость крови возрастает при увеличении гематокритного числа. Повышению вязкости способствует снижение суспензионных свойств крови, когда эритроциты начинают образовывать агрегаты. При этом отмечается положительная обратная связь – повышение вязкости, в свою очередь, усиливает агрегацию эритроцитов. Поскольку кровь – неоднородная среда и относится к неньютоновским жидкостям, для которых свойственна структурная вязкость, постольку снижение давления потока, например, артериального, увеличивает вязкость крови, а при повышении давления крови из-за разрушения ее структурированности вязкость падает.
|
|
|
Вязкость крови зависит от диаметра капилляров. При его уменьшении менее 150 мк вязкость крови начинает снижаться, что облегчает ее движение в капиллярах. Механизм этого эффекта связан с образованием пристеночного слоя плазмы, вязкость которого ниже, чем у цельной крови, и миграцией эритроцитов в осевой ток. С уменьшением диаметра сосудов толщина пристеночного слоя не меняется. Эритроцитов в движущейся по узким сосудам крови становится по отношению к слою плазмы меньше, т.к. часть из них задерживается при вхождении крови в узкие сосуды, а находящиеся в своем токе эритроциты двигаются быстрее и время их пребывания в узком сосуде уменьшается.
|
|
|
Вязкость венозной крови больше, чем артериальной, что обусловлено поступлением в эритроциты углекислого газа и воды, благодаря чему их размер незначительно увеличивается. Вязкость крови возрастает при раздепонировании крови, т.к. в депо содержание эритроцитов выше. Повышается вязкость плазмы и крови при обильном белковом питании.
Вязкость крови влияет на периферическое сосудистое сопротивление, прямо пропорционально повышая его, а значит, и давление крови.
Осмотическое давление крови – это сила, которая заставляет переходить растворитель (вода для крови) через полупроницаемую мембрану из менее в более концентрированный раствор. Оно определяется криоскопически (по температуре замерзания). У человека кровь замерзает при температуре ниже О на 0,56-0,58о С. При такой температуре замерзает раствор с осмотическим давлением 7,6 атм, а значит – это показатель осмотического давления крови. Осмотическое давление крови зависит от числа молекул растворенных в ней веществ. При этом свыше 60 % от его величины создается NaCl, а всего на долю неорганических веществ приходится до 96%. Осмотическое давление крови, лимфы, тканевой жидкости, тканей приблизительно одинаково и является одной из жестких гомеостатических констант (возможные колебания 7,3-8 атм). Даже в случаях поступления излишних количеств воды или соли, осмотическое давление не претерпевает изменений. При избыточном поступлении в кровь вода быстро выводится почками и переходит в ткани и клетки, что восстанавливает исходную величину осмотического давления. Если же в крови повышается концентрация солей, то в сосудистое русло переходит вода из тканевой жидкости, а почки начинают усиленно выводить соли.
|
|
|
Любой раствор, имеющий осмотическое давление, равное таковой плазмы, называется изотоническим. Соответственно раствор с более высоким осмотическим давлением называют гипертоническим, а с более низким – гипотоническим. Поэтому, если тканевая жидкость будет гипертонической, то вода будет поступать в нее из крови и из клеток, напротив, при гипотонической внеклеточной среде вода переходит из нее в клетки и кровь.
Аналогичную реакцию можно наблюдать со стороны эритроцитов крови при изменении осмотического давления плазмы: при её гипертоничности эритроциты, отдавая воду, сморщиваются, а при гипотоничности набухают и даже лопаются. Последнее используется в практике для определения осмотической резистентности эритроцитов. Так, изотоничными к плазме крови являются: 0,85-0,9% раствор NaCl, 1,1% раствор KCl, 1,3% раствор NaHCO3, 5,5% раствор глюкозы и др. Помещенные в эти растворы эритроциты не изменяют формы. В резко гипотонических растворах и особенно дистиллированной воде эритроциты набухают и лопаются. Разрушение эритроцитов в гипотонических растворах – осмотический гемолиз. Если приготовить ряд растворов NaCl с постепенно уменьшающейся концентрацией и помещать в них взвесь эритроцитов, то можно найти ту концентрацию гипотонического раствора, в котором начинается гемолиз и разрушаются лишь единичные эритроциты. Эта концентрация NaCl характеризует минимальную осмотическую резистентность эритроцитов, которая у здорового человека находится в пределах 0,42-0,48 (% раствор NaCl). В более гипотонических растворах все большее число эритроцитов гемолизируется и та концентрация NaCl, при которой все красные тельца будут лизированы, называется максимальной осмотической резистентностью. У здорового человека она колеблется от 0,34 до 0,30 (% раствор NaCl). При некоторых гемолитических анемиях границы минимальной и максимальной стойкости смещаются в сторону повышения концентрации гипотонического раствора.
|
|
|
Онкотическое давление – часть осмотического давления, создаваемое белками в коллоидном растворе, поэтому его еще называют коллоидно-осмотическим. Ввиду того, что белки плазмы крови плохо переходят через стенки капилляров в тканевую микросреду, создаваемое ими онкотическое давление удерживает воду в крови. Онкотическое давление в крови выше, чем в тканевой жидкости. Кроме плохой проницаемости барьеров для белков, меньшая их концентрация в тканевой жидкости связана с вымыванием белков из внеклеточной среды током лимфы. Онкотическое давление плазмы крови составляет в среднем 25-30 мм рт.ст., а тканевой жидкости – 4-5 мм рт.ст. Поскольку из белков в плазме больше всего содержится альбуминов, а их молекула меньше других белков, а молярная концентрация выше, то онкотическое давление плазмы создается преимущественно альбуминами. Снижение их содержания в плазме ведет к потере воды плазмой и отеку тканей, а увеличение – к задержке воды в крови. В целом онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи и всасывание воды в кишечнике.
Коллоидная стабильность плазмы крови обусловлена характером гидратации белков, наличием на их поверхности двойного электрического слоя ионов, создающего поверхностный фи-потенциал. Частью этого потенциала является электро-кинетический (дзета) потенциал - это потенциал на границе между коллоидной частицей, способной к движению в электрическом поле, и окружающей жидкостью, т.е. потенциал поверхности скольжения частицы в коллоидном растворе. Наличие дзета-потенциала на границах скольжения всех дисперсных частиц формирует на них одноименные заряды и электростатические силы отталкивания, что обеспечивает устойчивость коллоидного раствора и препятствует агрегации. Чем выше абсолютное значение этого потенциала, тем больше силы отталкивания белковых частиц друг от друга. Таким образом, дзета-потенциал является мерой устойчивости коллоидного раствора. Величина его существенно выше у альбуминов, чем у других белков. Поскольку альбуминов в плазме значительно больше, то коллоидная стабильность плазмы крови преимущественно определяется этими белками, которые обеспечивают коллоидную устойчивость не только других белков, но и углеводов и липидов.
Суспензионная устойчивость крови связана с коллоидной стабильностью белков плазмы. Кровь представляет собой суспензию, или взвесь, т.к. форменные элементы находятся в ней во взвешенном состоянии. Взвесь эритроцитов в плазме поддерживается гидрофильной природой их поверхности, а также тем, что эритроциты (как и другие форменные элементы) несут отрицательный заряд, благодаря чему отталкиваются друг от друга. Если отрицательный заряд форменных элементов уменьшается, например, в присутствии нестабильных в коллоидном растворе и с меньшим дзета-потенциалом белков (фибриногена, гамма-глобулинов, парапротеина), несущих положительный заряд, то снижаются силы электрического отталкивания и эритроциты склеиваются, образуя «монетные» столбики. В присутствии этих белков суспензионная устойчивость уменьшается. В присутствии же альбуминов суспензионная способность крови увеличивается. Суспензионная стабильность эритроцитов оценивается по скорости оседания эритроцитов (СОЭ) в неподвижном объеме крови. Суть метода заключается в оценке (в мм/час) отстоявшейся плазмы в пробирке с кровью, в которую предварительно добавляется цитрат натрия для предотвращения ее свертывания. Величина СОЭ зависит от пола. У женщин – 2-15 мм/ч, у мужчин - 1-10 мм/ч. Изменяется этот показатель и с возрастом. Наибольшее влияние на СОЭ оказывает фибриноген: при увеличении его концентрации более 4 г/л она повышается. СОЭ резко увеличивается во время беременности за счет значительного повышения в плазме уровня фибриногена, при эритропении, снижении вязкости крови и содержания альбуминов, а также при увеличении в плазме глобулинов. Воспалительные, инфекционные и онкологические заболевания, а так же анемии сопровождаются увеличением этого показателя. Уменьшение СОЭ типично для эритремии, а также для язвы желудка, острого вирусного гепатита, кахексии.
Концентрация водородных ионов и регуляция рН крови. В норме рН артериальной крови - 7,37-7,43 в среднем 7,4 (40 нмоль/л), венозной – 7,35 (44 нмоль/л), т.е. реакция крови слабощелочная. В клетках и тканях рН достигает 7,2 и даже 7,0, что зависит от интенсивности образования «кислых» продуктов метаболизма. Крайние пределы колебаний рН крови, совместимые с жизнью, – 7,0-7,8 (16-100 нмоль/л).
В процессе обмена веществ ткани выделяют в тканевую жидкость, а следовательно, и в кровь «кислые» продукты метаболизма (молочную, угольную кислоты), что должно привести к сдвигу рН в кислую сторону. Реакция же крови практически не изменяется, что объясняется наличием буферных систем крови, а также работой почек, легких, печени.
Буферные системы крови следующие.
1.
 |
Буферная система гемоглобина – самая мощная, на ее долю приходится 75% всей буферной емкости крови. Эта система включает восстановленный гемоглобин (ННb) и его калиевую соль (КНb). Буферные свойства этой системы обусловлены тем, что ННb, будучи более слабой кислотой, чем Н2СО 3, отдает ей ион К+, а сам, присоединив ионы Н+, становится очень слабо диссоциирующей кислотой. В тканях система гемоглобина выполняет роль щелочи, предотвращая закисление крови вследствие поступления в нее СО2 и Н+, а в легких – кислоты, препятствуя защелачиванию крови после выделения из нее углекислоты.KНbO2 + KHCO3
 KHb + O2 + H2CO3
KHb + O2 + H2CO3
2. Карбонатная буферная система образована бикарбонатом натрия и угольной кислотой. По своей значимости занимает второе место после системы гемоглобина. Она функционирует следующим образом. Если в кровь поступает кислота более сильная, чем угольная, то вступает в реакцию NaHCO3 и происходит обмен ионов Na+ на Н+ с образованием слабодиссоциирующей и легко растворимой угольной кислоты, что предотвращает повышение концентрации ионов водорода. Увеличение же содержания угольной кислоты приводит к ее распаду под влиянием фермента эритроцитов – карбоангидразы на воду и углекислый газ. Последний удаляется через легкие, а вода - через легкие и почки.
НСl+NaHCO3= NaCl+H2CO3 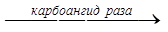 (CO2+H2O)
(CO2+H2O)
Если в кровь поступает основание, то в реакцию вступает угольная кислота, в результате чего образуется NaHCO3 и вода, а их избыток выводится почками. В клинической практике карбонатный буфер используются для коррекции кислотно-щелочного резерва.
3. Фосфатная буферная система представлена дигидрофосфатом натрия, который обладает кислотными свойствами, и гидрофосфатом натрия, который ведет себя, как слабое основание. Если в кровь поступает кислота, то она реагирует с гидрофосфатом натрия , образуя нейтральную соль и дигидрофосфат натрия, избыток которых удаляется с мочой. В результате реакции рН не меняется.
HCl+Na2 НPO4=NaCl+NaH2PO4
Схема реакции при поступлении щелочи выглядит следующим образом:
NaOH+NaH2PO4=Na2HPO4+H2O
И вновь содержание Н+-ионов почти не изменяется.
4. Буферная система белков плазмы поддерживает рН крови за счет их амфотерных свойств: в кислой среде они ведут себя как основания, а в щелочной – как кислоты.
В эритроцитах функционируют все 4 буферные системы, в плазме 3 (отсутствует гемоглобиновый буфер), а в клетках различных тканей основную роль в поддержании рН играют белковая и фосфатная системы.
Важная роль в поддержании постоянства рН крови отводится нервной регуляции. При поступлении кислых и щелочных агентов раздражаются хеморецепторы сосудистых рефлекторных зон, импульсы от которых идут в ЦНС (в частности, в продолговатый мозг) и рефлекторно включаются в реакцию периферические органы (почки, легкие, потовые железы и т.д.), деятельность которых направлена на восстановление исходной величины рН.
Буферные системы крови более устойчивы к действию кислот, чем оснований. Это обусловлено тем, что в процессе метаболизма образуется больше «кислых» продуктов и опасность закисления более велика.
Щелочные соли слабых кислот, содержащихся в крови, образуют так называемый щелочной резерв крови. Его величина определяется тем количеством углекислого газа, которое может быть связано 100 мл крови при напряжении СО2, равном 40 мм рт.ст.
Несмотря на наличие буферных систем и хорошую защищенность организма от возможных изменений рН, все же иногда при некоторых условиях наблюдаются небольшие сдвиги активной реакции крови. Сдвиг рН в кислую сторону называется ацидозом, в щелочную – алкалозом. Как ацидозы, так и алкалозы бывают дыхательные (респираторные) и недыхательные (нереспираторные или метаболические). При дыхательных сдвигах меняется концентрация углекислоты (понижается при алкалозе и повышается при ацидозе), а при недыхательных – бикарбоната, т.е. основания (снижается при ацидозе и повышается при алкалозе). Однако, нарушение баланса водородных ионов не обязательно приводит к сдвигу уровня свободных Н+-ионов, т.е. рН, поскольку буферные системы и физиологические гомеостатические системы компенсируют изменения баланса водородных ионов. Компенсацией называют процесс выравнивания нарушения путем изменения в той системе, которая не была нарушена. Например, сдвиги уровня бикарбонатов компенсируются изменениями выведения углекислоты.
У здоровых людей дыхательный ацидоз может возникнуть при длительном пребывании в среде с повышенным содержанием углекислого газа, например, в замкнутых помещениях малого объема, шахтах, подводных лодках. Недыхательный ацидоз бывает при длительном употреблении кислой пищи, углеводном голодании, усиленной мышечной работе.
Дыхательный алкалоз формируется у здоровых людей при нахождении в условиях сниженного атмосферного давления, соответственно, парциального давления СО2, например, высоко в горах, полетах в негерметичных летательных аппаратах. Гипервентиляция легких также способствует потери двуокиси углерода и дыхательному алкалозу. Недыхательный алкалоз развивается при длительном приеме щелочной пищи или минеральной воды типа «Боржоми».
Следует подчеркнуть, что все случаи возникновения сдвигов кислотно-щелочного состояния у здоровых людей обычно являются полностью компенсированными. В условиях патологии ацидозы и алкалозы встречаются значительно чаще, и, соответственно, чаще бывают частично компенсированными или даже некомпенсированными, требующими искусственной коррекции. Значительные отклонения рН сопровождаются тягчайшими последствиями для организма. Так, при рН=7,7 возникают тяжелейшие судороги (тетания), что может привести к смерти.
Из всех нарушений кислотно-щелочного состояния наиболее частым и грозным в клинике является метаболический ацидоз. Он возникает как следствие нарушений кровообращения и кислородного голодания тканей, избыточного анаэробного гликолиза и катаболизма жиров и белков, нарушения выделительной функции почек, избыточной потери бикарбоната при заболеваниях желудочно-кишечного тракта и др.
Снижение рН до 7,0 и меньше приводит к резким нарушениям деятельности нервной системы (потере сознания, коме), кровообращения (расстройствам возбудимости, проводимости и сократимости миокарда, фибрилляции желудочков, снижению тонуса сосудов и артериального давления) и угнетению дыхания, что может привести к смерти. В связи с этим, накопление водородных ионов при дефиците оснований определет необходимость коррекции с помощью введения бикарбоната натрия, восстанавливающего преимущественно рН внеклеточной жидкости. Однако для удаления избытка углекислоты, образующейся при связывании Н+-ионов бикарбонатом, требуется гипервентиляция легких. Поэтому при дыхательной недостаточности применяют буферные растворы (трис-буфер), связывающие избыток Н+ внутри клеток. К коррекции также подлежат сдвиги баланса Na+, K+, Ca2+, Mg2+,Cl-,обычно сопровождающие ацидозы и алкалозы.
Температура крови зависит от интенсивности обмена веществ того органа, от которого оттекает кровь, и колеблется в пределах 37-40оС. При движении крови происходит не только выравнивание температуры в различных сосудах, но и создаются условия для отдачи или сохранения тепла в организме.
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
Дата добавления: 2018-10-26; просмотров: 394; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
