Приклади розв ’ язання типових задач
Приклад 1. На титрування 20 см3 0,1 н розчину натрій тетраборату (бури) витратили 19,20 см3 розчину сульфатної кислоти. Визначити молярну концентрацію еквівалента розчину сульфатної кислоти та титр розчину сульфатної кислоти.
Розв’язання. Визначаємо молярну концентрацію еквівалента розчину сульфатної кислоти:
С(½ H2SO4) = С(бури) · V(бури) ∕ V(H2SO4) = 0,1042 моль /дм3.
Визначаємо титр розчину сульфатної кислоти:
Т(H2SO4) = С(1/2 H2SO4) · М(1/2 H2SO4) / 1000 = 0,005106 г/см3.
Приклад 2. Обчислити молярну концентрацію еквівалента розчину натрій гідроксиду, якщо на титрування ним наважки 0,1590г (х.ч.) щавлевої кислоти Н2С2О4.2Н2О (розчиненої в певній кількості води) пішло 24,60 см3 розчину натрій гідроксиду.
Розв’язання. Запишемо рівняння реакції:
Н2С2О4 + 2NаОН = Nа2С2О4 + 2Н2О
М(1/2Н2С2О4.2Н2О)=126,06/2=63,03 г/моль
За законом еквівалентів кількість еквівалентів натрій гідроксиду дорівнює кількості еквівалентів щавлевої кислоти, або
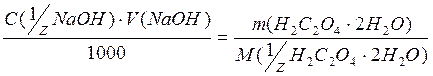
Звідси 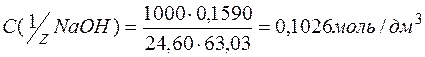
Контрольні завдання
136. Скільки грамів Na2CO3 знаходилося у 200 см3 розчину, якщо на титрування 20,00 см3 цього розчину необхідно 20,00 см3 0,112 н розчину хлоридної кислоти?
137. Скільки грамів хімічно чистої щавлевої кислоти Н2С2О4.2Н2О необхідно для приготування 2000 см3 0,1н розчину?
138. Скільки см3 розчину сульфатної кислоти (w=50%, r=1,4 г/см3) необхідно додати до води, щоб отримати 2 дм3 0,25 н розчину кислоти?
139. Скільки см3 розчину калій гідроксиду з масовою часткою 40% та густиною 1,41 г/см3 необхідно для приготування 2 дм3 0,1 н розчину?
|
|
|
140. До якого об’єму необхідно розвести 50 см3 розчину сульфатної кислоти з масовою часткою 38% та густиною 1,29 г/см3, щоб отримати 0,5 н розчин по відношенню до реакції повної нейтралізації?
141. Скілько літрів 5 н розчину натрій гідроксиду можна приготувати з 4 літрів 50%-ного розчину густиною 1,52 г/см3?
142. Як приготувати 500 см3 0,1 н розчину хлоридної кислоти з 30%-ного розчину густиною 1,15 г/см3?
143. Скільки мілілітрів розчину фосфатної кислоти з масовою часткою 40% та густиною 1,25 г/см3 тнеобхідно для приготування 2,5 дм3 0,5 н розчину по відношенню до реакції повної нейтралізації?
144. В мірній колбі на 200 см3 приготовлений розчин з 1,4200 г кристалічного амоній оксалату 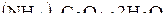 . Обчисліть молярну концентрацію еквівалента розчину та його титр.
. Обчисліть молярну концентрацію еквівалента розчину та його титр.
145. На титрування 0,3451г H2C2O4 витрачається 20,00 см3 розчину NaOH. Обчисліть молярну концентрацію еквівалента розчину та титр.
146. В лабораторії є 0,1046н розчин НCl. Визначить молярну концентрацію НCl, ТHCl , ТHCl /Ca(OH)2.
147. На титрування розчину, що отриманий розчиненням 3,1580 г технічного КОН, витрачається 27,45 см3 НСl (ТНСl/NaOH = 0,07862 г/см3). Визначте масову частку калій гідроксиду в зразку технічного продукту.
|
|
|
148. На титрування наважки 0,1907 г натрій тетраборату 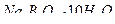 витрачається 10 см3 розчину HCl. Обчисліть титр та молярну концентрацію еквівалента розчину.
витрачається 10 см3 розчину HCl. Обчисліть титр та молярну концентрацію еквівалента розчину.
149. На титрування наважки 0,2584 г зневодненої Na2CO3 витрачено 27,30 см3 розчину сульфатної кислоти. Визначити титр і молярну концентрацію розчину сульфатної кислоти.
150. Скільки літрів 5 н розчину натрій гідроксиду можна приготувати з 4 літрів 50%-ного розчину густиною 1,52 г/см3?
Тема 11. Методи окисно-відновного титрування
11.1. Метод перманганатометрії
В перманганатометрії використовується окиснювальна здатність KMnO4 в кислому середовищі. Робочим розчином в даному методі є розчин калій перманганату. Даним методом при безпосередньому титруванні робочим титрованим розчином KMnO4 можна визначати кількість відновників.
Перманганатометрія - безіндикаторний метод, тому що точку еквівалентності можна зафіксувати на основі перетворення іонів MnO4- рожевого кольору в безкольорові іони Mn2+ .
Метод перманганатометрії застосовують для кількісного визначення феруму (ІІ), пероксиду водню, нітратів, хрому, кальцію, марганцю.
В кондитерських виробах методом перманганатометрії можна визначити кількість цукру, азотистих речовин тощо.
|
|
|
Встановити титр калій перманганату за точною його наважкою неможливо, тому що він легко змінюється під впливом відновників, наприклад, аміаку, органічних речовин, що попадають в воду з пилом, тощо. Внаслідок цього концентрація розчину KMnO4 в перший час після приготування декілька зменшується. Титр його встановлюють через 7-10 днів після приготування розчину. За цей час окиснення присутніх в розчині домішок відновників встигає закінчитися і концентрація KMnO4 перестає змінюватися.
Звідси виходить, що брати точну наважку KMnO4 не має сенсу, а титр його слід встановлювати за якимось первинним стандартом, що має відновні властивості. Титр і концентрацію розчину калій перманганату встановлюють за безводним оксалатом натрію Na2C2O4 або дигідратом щавлевої кислоти Н2С2О4.2Н2О. В основі процесу стандартизації розчину KМnO4 за щавлевою кислотою лежить реакція окиснення іону С2О42- іонами MnO4- в сильно кислому середовищі (до розчину, що титрують додають сульфатну кислоту). Реакція каталізується іонами Mn2+.
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O

 MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 2
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 2
10
|
|
|
C2O42- - 2e- = 2CO2 5
За даною реакцією молярна маса еквівалента калій перманганату дорівнює 1/5 М(KMnO4):
 |
Фактор еквівалентності щавлевої кислоти дорівнює – ½, тому молярна маса еквіваленту дигідрату щавлевої кислоти дорівнює:
126,06
М(1/2 H2C2O4 . 2H2O) = __________ = 63,03 г/моль
2
Всі продукти безкольорові, тому точку еквівалентності можно зафіксувати за появою рожевого кольору від надлишку, що дає крапля KMnO4. .
Взаємодія іонів MnO4- з іонами C2O42- протікає дуже повільно, тому пропонують титрувати гарячий розчин щавлевої кислоти.
Метод йодометрії
Йодометрія є одним з титриметричних методів окиснення-відновлення.
В основі цього методу лежать наступні окисно-відновні реакції :
I2 + 2ē = 2 I¯ (1)
2I¯ – 2ē = I2 (2)
Реакція (1) протікає в присутності таких відновників, які можуть бути окиснені вільним йодом, тобто мають окисно-відновний потенціал менший, ніж у системи I2 / 2I¯ (+ 0,54 В), наприклад, Na2S2O3 ´ 5H20 (натрій тіосульфат), H2SO3, H2S тощо.
Реакція (2) протікає в присутності окисників, що віднімають електрони від іонів йоду, тобто ті, у яких окисно-відновний потенціал більше +0,54 В, наприклад: KMnО4, K2Cr2O7, Cl2, Br2 та ін. Отже, методом йодометрії можуть бути визначені як окисники, так і відновники.
Як робочі титровані розчини у цьому методі застосовуються такі: титрований розчин йоду (окисник) і титрований розчин натрій тіосульфату Na2S2O3 ´ 5H20 (відновник).
Визначення відновників здійснюють або безпосереднім титруванням розчином йоду, або способом зворотнього титрування. Для цієї мети до визначеного об’єму відновника додають у надлишку визначений об’єм титрованого розчину йоду, а потім надлишок відтитровують другим робочим розчином — натрій тіосульфатом.
Визначення окисників не проводять безпосереднім титруванням робочим розчином натрій тіосульфату, тому що реакція між окисником і натрій тіосульфатом проходить складно і важко визначити точку еквівалентності. Визначення окисників здійснюють методом заміщення. Для цього до розчину окисника додають надлишок KJ і H2SO4. При цьому окисник виділяє еквівалентну кількість йоду з калій йодиду, який потім відтитровують робочим розчином натрій тіосульфату, наприклад:
а) K2Cr2O7 + 6KJ + 7H2SO4 = 3J2 + Cr2(SO4)3 + 4K2SO4 + 7H2O


 Cr207 2- + 6ē + 14Н+ = 2Cr3+ + 7 Н2О 1
Cr207 2- + 6ē + 14Н+ = 2Cr3+ + 7 Н2О 1
6
2J-1 - 2ē = J2 3

Cr207 2- + 6J-1 + 14Н+ = 2Cr3++ 3 J2 + 7 Н2О
б) 2Na2S2O3+J2=2NaJ+Na2S4O6
 натрій тетратіонат
натрій тетратіонат
2S2O32- - 2ē = S4O62-
 J2 + 2ē = 2J-1
J2 + 2ē = 2J-1

2 S2O32- + J2 = S4O62- + 2J-1
Знаючи об’єм титрованого розчину натрій тіосульфату, що витрачений на титрування йоду, який виділений в еквівалентній кількості визначеним об’ємом окисника, обчислюють молярну концентрацію еквівалента розчину окисника.
Еквівалентна точка в йодометрії визначається за допомогою індикатора — розчину крохмалю.
Кристали натрій тіосульфату або гіпосульфіту Na2S2O3 ´ 5H2O, що містять 5 молекул кристалізаційної води, на повітрі легко вивітрюються, тобто втрачають частину води, тому їхній склад не завжди відповідає формулі Na2S2O3 ´ 5H2O. Тому готують розчин натрій тіосульфату лише приблизної концентрації, при цьому наважку натрій тіосульфату беруть на технічних терезах, а потім визначають титр шляхом титрування за вихідною речовиною, наприклад, калій дихромату K2Cr2O7.
В основі процесу стандартизації розчину Na2S2O3 ´ 5H2O за калій дихроматом лежать реакції:
K2Cr2O7 + 6KJ + 7H2SO4 = 3J2 + Cr2(SO4)3 + 4K2SO4 + 7H2O


 Cr207 2- + 6ē + 14Н+ = 2Cr3+ + 7 Н2О 1
Cr207 2- + 6ē + 14Н+ = 2Cr3+ + 7 Н2О 1
6
2J-1 - 2ē = J2 3

Cr207 2- + 6J-1 + 14Н+ = 2Cr3++ 3 J2 + 7 Н2О
M(1/6 K2Cr2O7) = 294,22 : 6 г/моль = 49,03г/моль
2Na2S2O3 + J2 = 2NaJ + Na2S4O6
2S2O32- - 2ē ® S4O62-
J2 + 2ē ® 2J-
 2S2O32- + J2 = S4O62- + 2J-1
2S2O32- + J2 = S4O62- + 2J-1
М(1/2 J2) = М(J2)/2 = 126,92г/моль
При встановленні титру натрій тіосульфату за калій дихроматом застосовують метод заміщення. Для цього використовують допоміжний розчин калій йодиду. Калій дихромат як окисник виділяє з калій йодиду вільний йод у кількості, еквівалентній взятій наважці калій дихромату. Йод, що виділився, титрують натрій тіосульфатом. Індикатор — розчин крохмалю.
Дата добавления: 2018-09-20; просмотров: 342; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
