Процес віддачі електронів, що супроводжується підвищенням ступеня окиснення елемента, називається окисненням.
Електрони, що віддає Сульфур, приєднують атоми Брому; ступінь окиснення Брому змінюється від 0 до - 1.
Br20 +2ē→ 2Br-1 (відновлення)
Процес приєднання електронів, що супроводжується зниженням ступеня окиснення елемента, називається відновленням.
 Підбирають стехіометричні коефіцієнти для сполук, атоми яких змінюють ступені окиснення. Для даної реакції баланс «електронного обміну» такий:
Підбирають стехіометричні коефіцієнти для сполук, атоми яких змінюють ступені окиснення. Для даної реакції баланс «електронного обміну» такий:
1 S-2 - 2ē → S0 (окиснення)
1 Br20 +2ē→ 2Br -1 (відновлення)
Враховуючи те, що кількість втрачених відновником електронів повинна дорівнювати кількості електронів, яку приєднує окисник, знаходять спільний множник для двох електронно-іонних рівнянь. Для даного випадку цей спільний множник дорівнює 2.
Отже, з однією молекулою Н2S в реакцію вступає одна молекула брому.
Знайдені коефіцієнти підставляють у схему реакції:
H2S + Br2 = 2HBr + S↓
Розглянуте рівняння реакції є найпростішим прикладом окисно-відновного процесу.
На процес окиснення — відновлення дуже впливають концентрації окисника й відновника. Збільшення концентрації окисника або зменшення концентрації відновника збільшує окиснювальну дію окисника.
Можливість і характер перебігу окисно-відновного процесу іноді залежить від середовища. Наприклад, у кислому середовищі сильний окисник перманганат-іон МnО4‾ відновлюється до Мn2+, у лужному середовищі іони Мангану Мn2+ легше стають відновниками, окиснюючись до Мn+4 (іноді до Мn+6). У нейтральному і слабко лужному середовищах окиснення і відновлення сполук Мангану приводить до утворення оксиду Мангану (ІV). У сильно лужному середовищі сполуки Мангану окиснюються й відновлюються до манганат-іона (МnО42- ).
|
|
|
На практиці часто доводиться обчислювати еквівалент речовин не тільки за реакціями обміну, а й за окисно-відновними. Треба вміти визначити еквівалент відновника й окисника.
Еквівалент речовини в окисно-відновних реакціях — це кількість речовини, що віддає або приєднує один електрон.
Молярна маса еквівалента речовини в реакціях окиснен ня — відновлення дорівнює молярній масі цієї речовини, поділеній на кількість електронів, які приєднує 1 моль окисника або віддає 1 моль відновника.
Приклади розв ’ язання типових задач
Приклад 1. Взаємодія калій перманганату з калій іодидом за наявності сульфатної кислоти призводить до знебарвлення малинового розчину і виділення йоду. Ця реакція відбувається за схемою:
+7 -1 +2 0
|
|
|
КМnО4 + КІ + Н2SО4 → МnSО4 + І2 + ...
Встановлюють, що ступінь окиснення Мангану змінився від +7 до +2, а Йоду від -1 до 0, тобто Манган відновився (калій перманганат - окисник), а Йод окиснився (калій йодид — відновник).
Щоб обчислити найважливіші коефіцієнти (перед окисником і відновником), необхідно скласти електронний баланс рівняння:

2 Mn+7 +5ē → Mn +2 (відновлення)
5 2I ‾ - 2ē→ I20 (окиснення)
Оскільки кількість втрачених Йодом електронів повинна дорівнювати кількості електронів, що приєднує Манган, знаходять спільний множник для цих двох рівнянь. Рівність втрачених і приєднаних електронів буде тоді, коли 10 йодид-іонів віддадуть 10 електронів, а два іони Мангану приєднають 10 електронів.
Отже, множники 2 і 5 визначають коефіцієнти відповідно біля Мангану та Йоду в рівнянні окисно-відновної реакції; ці коефіцієнти можуть бути перенесені в молекулярне рівняння як основні. Розглянуту реакцію можна записати так:
2КМnО4 +10КІ + Н2SО4 → 2МnSО4 +5І2 + ...
Нарешті, треба обчислити другорядні коефіцієнти, тобто ті, що стоять біля сполук з елементами, які не змінюють свої ступені окиснення. Треба врахувати кількість іонів К+, SО42-, атомів Оксигену та іони Гідрогену. Сульфат-іони потрібні для зв'язування не тільки іона Мn2+, а й Калію, іони Гідрогену зв'язують усі вісім атомів Оксигену у молекули води. Отже, рівняння матиме такий остаточний вигляд:
|
|
|
2КМnO4 +10КІ + 8Н2SO4 = 2МnSО4 + 6К2SО4 + 5І2 + 8Н2О
Для складання рівнянь окисно-відновних реакцій краще застосовувати іонно-електронний метод; він більш правильно відображає суть процесу. Так, для розглянутої реакції іонно-електронні рівняння матимуть вигляд:
 2 Mn O4‾ +5ē + 8H+→ Mn+2 + 4H2O (відновлення)
2 Mn O4‾ +5ē + 8H+→ Mn+2 + 4H2O (відновлення)
5 2I ‾ - 2ē→ I2 (окиснення)
Перше рівняння процесу («напівреакції») відновлення перманганат-іона показує, що під час перетворення іона МпО4- в катіон Мп2+ чотири атоми Оксигену, що звільнились, мають зв'язатися в чотири молекули води. Для цього і потрібні вісім іонів Гідрогену. Друге рівняння процесу («напівреакції») окиснення Йоду показує, що цей процес відбувається без участі іонів Гідрогену.
Знаходять спільний множник для цих двох іонно-електронних рівнянь (двох «напівреакцій»), додають рівняння процесів відновлення і окиснення, враховуючи множники 2 і 5; одержують сумарне іонне рівняння даної окисно-відновної реакції:
|
|
|

2 Mn O4‾ +5ē + 8H+→ Mn+2 + 4H2O (відновлення)
5 2I ‾ - 2ē→ I2 (окиснення)

2МnО4‾ +16H+ +10І‾ → 2Мn+2 +5І2 + 8H2O
Одержане рівняння реакції можна подати тепер і в молекулярній формі:
2КМnO4 +10КІ + 8Н2SO4 = 2МnSО4 + 5І2 + 6К2SО4 + 8Н2О
Приклад 2. Знайти молярну масу еквівалента калій перманганату в реакції:
КМnО4 + Na2SО3+ 3H2SО4 = МnSО4 + K2SO4 + 5Na2SO4+3H2O
 2 Mn O4‾ +5ē + 8H+→ Mn+2 + 4H2O (відновлення)
2 Mn O4‾ +5ē + 8H+→ Mn+2 + 4H2O (відновлення)
5 SO3 2-- 2ē+H2O→ SO4 2- +2H+ (окиснення)
У цій реакції перманганат-іон відновлюється, приєднуючи 5 електронів,
тому: 
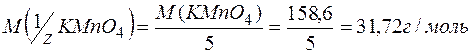
Контрольні завдання
61. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
P + HIO3 + H2O ® H3PO4 + HI
H2S + Cl2 + H2O ® H2SO4 + HCl.
62. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
KClO3 + Na2SO3 ® KCl + Na2SO4
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
63. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
P + HClO3 + H2O ® H3PO4 + HCl
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O.
64. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O.
65.Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
HNO3 + Zn ® N2O + Zn(NO3)2 + H2O
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 +KCl + H2O.
66. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
K2Cr2O7 + HCl ® Cl2 + CrCl3 +KCl +H2O
Au + HNO3 + HCl ® AuCl3 + NO + H2O.
67. Чи можуть відбуватися окисно-відновні реакції між: а) NH3 та KMnO4; б) HNO2 та HI; в) HCl и H2Se? Чому? На підставі електронних рівнянь підберіть коефіцієнти в рівнянні реакції, що відбувається за схемою :
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O.
68.Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
HCl + CrO3 ® Cl2 + CrCl3 + H2O
Cd + KMnO4 + H2SO2 ® CdSO4 + K2SO4 + MnSO4 + H2O.
69. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
I2 + NaOH ® NaOI + NaI + Н2О
MnSO4 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + PbSO4 + H2O.
70. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
H2SO3 + HClO3 ® H2SO4 + HCl
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
71. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
I2 + Cl2 + H2O ® HIO3 + HCl
FeCO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + CO2 + MnSO4 + K2SO4 + H2O.
72. Виходячи зі ступені окиснення фосфору в сполуках РН3, Н3РО4, Н3РО3 визначте, яка з них є тільки окисником, тільки відновником та яка може проявляти як окисні, так і відновні властивості. Чому? На підставі електронних рівнянь підберіть коефіцієти в рівнянні реакції, що відбувається за схемою:
PbS + HNO3 ® S + Pb(NO3)2 + NO + H2O.
73. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O
P + HNO3 + H2O ® H3PO4 + NO.
74. Складіть електронні рівняння та вкажіть, який процес – окиснення чи відновлення, відбувається в наступних перетвореннях:
Mn6+ ®Mn2+ ; Cl5+ ®Cl- ; N3- ®N5+. На підставі електронних рівнянь підберіть коефіцієти в рівнянні реакції, що відбувається за схемою:
Cu2O + HNO3 ® Cu(NO3)2 + NO + H2O
75. Складіть електронні рівняння наведених реакцій: підберіть коефіцієнти, вкажіть окисник та відновник, процес окиснення та відновлення. Знайдіть молярну масу еквівалента окисника та відновника.
HNO3 + Ca ® NH4NO3 + Ca(NO3)2 + H2O
K2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O.
Тема 6. Комплексн і сполуки
Серед неорганічних сполук численну групу складають координаційні або комплексні сполуки. Вони утворюються при взаємодії молекул двох або більше речовини. Наприклад,
AgCN + KCN = K[Ag(CN)2]
CuCl2 + 4NH4OH = [Cu(NH3)4]Cl2 + 4H2O
У молекулі комплексної сполуки один з атомів (зазвичай позитивно заряджений) займає центральне місце і називається комплексо утворювачем або центральним атомом (у наведених прикладах Ag+; Cu2+). Комплексоутворювач координує навкруги полярні молекули або протилежно заряджені іони (наприклад, NH3, CN-, OH-), що називаються лігандами. Комплексоутворювач і ліганди складають внутрішню сферу комплексної сполуки, яку зазвичай беруть в квадратні дужки:
2+
 [CN- Ag+ CN-]1-; NH3 NH3
[CN- Ag+ CN-]1-; NH3 NH3
Cu+2
NH3 NH3
Кількість лігандів, що розташовані навколо комплексоутворювача, визначається його координаційним числом (к.ч.).
Спостерігається певна залежність між величиною координаційного числа і зарядом комплексоутворювача.
Так, якщо заряд +1, к.ч.=2;
якщо заряд +2, к.ч.=4 и 6;
якщо заряд +3, к.ч.=6 и 4;
якщо заряд +4, к.ч.=8 и 6 тощо.
У даних прикладах комплексоутворювач Ag+ має координаційне число два (к.ч.=2), Cu+2 - чотири (к.ч.=4).
Внутрішня сфера є комплексним іоном, заряд його дорівнює алгебраїчній сумі зарядів комплексоутворювача і лігандів. Наприклад, заряд комплексного іона [Ag+1(CN) 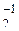 ]- дорівнює: (+1)+2(-1)=-1; заряд комплексного іона [Fe+3(CN)
]- дорівнює: (+1)+2(-1)=-1; заряд комплексного іона [Fe+3(CN) 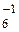 ]3- дорівнює: (+3) + 6(-1) = -3.
]3- дорівнює: (+3) + 6(-1) = -3.
Іони, що не увійшли до внутрішньої сфери, складають зовнішню сферу комплексної сполуки. Сумарний заряд зовнішньої сфери дорівнює за величиною, але протилежний за знаком заряду комплексного іона, так що комплексна сполука электронейтральна: K3[Fe(CN)6] 3(+1)+(+3) + 6(-1)=0.
У разі незарядженої внутрішньої сфери зовнішня сфера відсутня, наприклад, [Co+3(NH3)3Cl-3] (+3) + 3(-1)=0.
Типовими комплексоутворювачами являються катіони d-елементів (Ag+, Cd2+, Cu2+, Fe2+, Fe3+, Cr3+, Co2+, Pt4+, Co3+ та ін.), які мають перехідні від 8 до 18-електронних рівнів, вільні енергетичні комірки в останньому (іноді в передостанньому рівні). У них менше, ніж у s-елементів радіуси і більше густина заряду. Вони легко поляризують аніони і полярні молекули. Комплексоутворювачами можуть бути і інші частки, в певних умовах здатні до комплексоутворювання. Наприклад, p-елементи: Pb2+, Al3+, Sn2+, N-3 і інші.
Найважливішими лігандами є полярні молекули (H2O, NH3, CO та ін.), кислотні залишки (CN-, NO2-, Cl-, F-, J-, CNS-, S2O32- та ін.) і гідроксильні іони ОН-.
В комплексній сполуці можуть знаходитися як однорідні ліганди, так і різнорідні.
Так, катіон Сr3+ може утворювати комплексні іони складу [Cr(H2O)6]3+, [Cr(OH)(H2O)5]2+, [Cr(OH)2(H2O)4]+, [Cr(OH)6]3- та ін.
В утворенні хімічного зв'язку між комплексоутворювачем і лігандами велику роль грає донорно-акцепторний механізм. Так, при утворенні аміакату міді [Cu(NH3)4]2+ молекули амоніаку проявляють донорні властивості за рахунок неподіленої електронної пари, що знаходиться на останньому енергетичному рівні атома Нітрогену:
H

 H N :
H N :



H
Іон Сu2+ надає вільні 4s- і три 4р-орбіталі. Внаслідок sp3-гібридизації іон Купруму має чотири вільні гібридні орбіталі, на яких розташовуються неподілені електронні пари чотирьох молекул амоніаку. Комплекс має тетраедричну структуру, яка і визначає деякі його властивості.
Дата добавления: 2018-09-20; просмотров: 488; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
