Приклади розв’язання типових задач
Приклад 1. Обчислити масову частку у відсотках, молярну концентрацію, молярну концентрацію еквіваленту розчину H3PO4, що отримали при розчиненні 18 г кислоти H3PO4 у 282 см3 води, якщо густина розчину 1,031 г/см3. Чому дорівнює титр цього розчину?
Роз’язання. а) Масова частка показує число грамів речовини, що міститься у 100 г розчину ( у відсотках). Масу 282 см3 можна прийняти за 282 г, тоді маса розчину, що отримали, становить 18 + 282 =300 г, а w = 18 ·100/300 = 6 %;
б) Молярна концентрація показує число молей розчиненої речовини, що міститься в 1 дм3. Маса 1 дм3 розчину становить 1031 г. Маса кислоти в 1 дм3 дорівнює: х= 1031·18/300 =61,86 г, кількість речовини – 61,86/97,99 =0,63 моль (М(H3PO4)) = г/моль), молярна концентрація – 0,63 М;
в) Молярна концентрація еквіваленту показує число моль еквівалентів, що міститься в 1 дм3. М(1/Z H3PO4) = М(H3PO4)/3 = 97,99/3 = 32,66 г/моль, С(1/Z H3PO4) = 61,86/32,66 = 1,89 н.;
г) Титр – кількість грамів розчиненої речовини, що міститься в 1 см3 розчину. Т = 61,86./1000 = 0,06186 г/см3.
Приклад 2. Який об’єм 3,65%-го розчину хлоридної кислоти (густина 1,01 г/см3) необхідно для повного розкладання 25 г кальцій карбонату?
Розв ’ язання. Простіше всього задачу можна розв’язати, застосовуючи закони еквівалентів у комбінованій формі:

Для цього переведемо концентрацію розчину HCl з масового відсотка в молярну концентрацію еквівалента. Ця концентрація виражається формулою:
 .
.
Для розрахування молярної концентрації еквівалента HCl необхідно знати масу розчиненої речовини та об’єм розчину. З умови задачі витікає, що 3,65%-ий розчин хлоридної кислоти містить 3,65 г HCl в 100 г розчину.
|
|
|
100 г розчину займають об’єм, який можна знайти як відношення маси до густини 100/1,01= 99,01 см3. Тоді
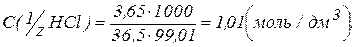
 (г/моль);
(г/моль);
підставимо ці значення в першу формулу і отримаємо:

 .
.
Приклад 3. Обчислити рН 0,1 н розчину хлоридної кислоти.
Розв’язання: У вираз рН = -lg[Н+] підставляємо значення вмісту іонів Гідрогену в 0,1 н розчині хлоридної кислоти, виходячи з того, що α→1. Отже, [Н+] = Ск-ти, тобто [Н+] = 1·10 -1 моль/дм3. Звідси рН=-lg 1·10 -1 = 1.
Приклад 4. Скласти молекулярні та іонні рівняння гідролізу солей: а) KNO2, б) ZnCI2, в) FeCI3 + K2CO3.
Розв’язання. а) Гідроліз KNO 2 .
При розчиненні у воді KNO2 дисоціює на іони K+ та NO2‾. Ця сіль утворена слабкою кислотою НNO2 та сильною основою КОН. Таким чином, гідроліз йде за аніоном слабкої кислоти NO2‾.
Іони NO2‾ зв’язують водневі іони води, утворюючи слабодисоціюючі молекули НNO2. Іони калію не зв’язують гідроксильні іони води, тому що КОН сильна основа:
KNO2 + Н2О ↔ НNO2 + КОН
В іонно-молекулярній формі:
NO2‾ + НОН ↔ НNO2 + ОН‾
|
|
|
Накопичення іонів ОН‾ обумовлює лужне середовище, рН > 7.
б) Гідроліз ZnCI 2.
Соли слабкої основи багатозарядного металу та сильної кислоти вступають до реакції гідролізу ступінчасто, в основному за першим ступенем з утворенням основної солі і кислоти:
ZnCI2 + Н2О ↔ ZnОНCI + НCI
або в іонній формі
Zn2+ + НОН ↔ ZnОН+ + Н+; рН< 7.
Утворення молекули Zn(ОН)2 не відбувається, тому що іон ZnОН+ є більш слабким електролітом, ніж молекули Zn(ОН)2.
в) Гідроліз FeCI 3 + K 2 CO 3 .
Солі, що утворені слабкою основою і слабкою кислотою, гідролізують за катіоном та аніоном, їхні іони одночасно зв’язують іон Н+ і ОН-. Гідроліз йде глибоко. Реакція середовища залежить від відносної сили кислоти і основи. Таким чином, сіль FeCI3 гідролізує за катіоном, а K2CO3 – за аніоном:
Fe3+ + Н2О = FeОН2+ + Н+
CO32‾ + Н2О = НСО3‾ + ОН‾
Якщо розчини солей знаходяться в одній посудині, то йде взаємне посилення гідролізу кожної з них, тому що іони Н+ та ОН‾ утворюють молекулу слабкого електроліта Н2О. При цьому гідролітична рівновага зміщується вправо і гідроліз кожної солі йде до кінця з утворенням Fe(ОН)3 та СО2 (Н2СО3). Рівняння реакцій:
2Fe3+ + 3CO32‾ + 3НОН = 2Fe(ОН)3 + 3СО2
|
|
|
2FeCI3 + 3K2CO3 + 3Н2О = 2Fe(ОН)3¯ + 3СО2 + 6КСІ.
Контрольні завдання
46. На нейтралізацію 500 см3 розчину, що містить 8 г NaOH, треба було 250 см3 розчину сульфатної кислоти. Обчисліть молярну концентрацію еквівалента сульфатної кислоти.
47. Скільки води потрібно додати до 100 см3 розчину нітратної кислоти з масовою часткою HNO3 48% і густиною 1,303 г/см3 , щоб одержати розчин з масовою часткою 20%.
48. Скільки грамів кухонної солі NaCl варто додати до 450 г розчину тієї ж солі з масовою часткою 8% для одержання розчину з масовою часткою 12 %?
49. Скільки грамів харчової соди NaНCO3 містить 500 см3 2н розчину цієї речовини?
50. Обчисліть молярну концентрацію та молярну концентрацію еквівалента розчину фосфатної кислоти (масова частка 50%, густина 1,33 г/см3).
51. У яких об'ємних співвідношеннях необхідно змішувати 4 н розчин нітратної кислоти і воду для приготування 0,5 н розчину HNO3 ?
52. Розрахуйте молярну концентрацію еквівалента розчину сульфатної кислоти з масовою часткою H2SO4 20% і густиною 1,15 г/см3 .
53. Який об’єм розчину сульфатної кислоти з молярною концентрацією еквівалента 0,2 моль/дм3 потрібно для нейтралізації розчину, що містить 0,40 г NaOH у 50 см3?
54. Скільки грамів розчину AgNO3 з масовою часткою 5% необхідно взяти для проведення обмінної реакції з 120 см3 0,6 н розчину AICI3?
|
|
|
55. Які об’єми 2М і 6М розчинів НСI потрібно змішати для утворення 0,5 дм3 3 М розчину?
56. Чому дорівнює молярна концентрація еквівалента розчину NaOH (w=30%, p=1,328 г/см3).
57. На нейтралізацію 25 см3 розчину хлоридної кислоти треба було 24,4 см3 1 н розчину NaOH. Визначите молярну концентрацію хлоридної кислоти
58. Який об’єм розчину сульфатної кислоти з густиною 1,38 г/см3 і масовою часткою H2SO4 92% потрібно взяти для приготування 3 дм3 0,5 н розчину сульфатної кислоти?
59. Необхідно випаровуванням підвищити концентрацію 4 кг розчину сульфатної кислоти з масовою часткою H2SO4 20% до розчину з масовою часткою H2SO4 80%. Скільки води буде вилучено з первинного розчину?
60. Які об’єми 1М і 3М розчинів натрій гідроксиду потрібно взяти для приготування 0,5 дм3 1,5 М розчину?
Дата добавления: 2018-09-20; просмотров: 288; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
