Характер дисоціації комплексних сполук.
Стійкість комплексних іонів.
Між внутрішньою і зовнішньою сферами комплексної сполуки діють сили електростатичного притяжіння протилежно заряджених іонів, тому в розчинах іони зовнішньої сфери легко відриваються від внутрішньої. Відбувається первинна дисоціація. В цьому випадку комплексна сполука дисоціює на 100 відсотків подібно сильним електролітам:
[Сd(NH3)4]SO4 → [Cd(NH3)4]2+ + SO42-
комплексний катіон
K2[Cd(CN)4] → 2K+ + [Cd(CN)4]2-
комплексний аніон
Ліганди, що знаходяться в середині внутрішньої сфери комплексу, зв'язані з комплексоутворювачем ковалентними зв'язками і їх розрив в розчині здійснюється, як правило, у незначній мірі. Ця дисоціація є вторинною. Процес цей оборотний, і в розчині встановлюється рівновага між комплексними іонами та частинками, що утворюють їх:
 [Cd(NH3)4]2+ Cd2+ + 4NH3
[Cd(NH3)4]2+ Cd2+ + 4NH3
 [Cd(CN)4]2- Cd2+ + 4CN-
[Cd(CN)4]2- Cd2+ + 4CN-
Константи рівноваги цих процесів називаються константами нестійкості комплексних іонів (Кн). Вони характеризують міцність (ступінь стійкості) внутрішньої сфери комплексу. Наприклад:
[Cd2+]×[NH3]4
Кн[Cd(NH ) ]2+ = ------------------- =1×10-7
[ [Cd(NH3)4]2+]
[Cd2+]×[CN-]4
Кн[Cd(CN) ]2- = ------------------ = 1,4×10-17
[ [Cd(CN)4]2-]
Ці константи показують, що комплексний іон [Cd(CN)4]2- більш міцний ніж комплексний іон [Cd(NH3)4]2+.
|
|
|
 Комплексні іони, що характеризуються великим значенням константи нестійкості, у водному розчині майже цілком розпадаються на комплексоутворювач і ліганди. Так, у розчині солі K2[MgCl4] рівновага дисоціації [MgCl4]2- Mg2+ + 4Cl- сильно зміщена вправо, комплексні іони існують тільки в концентрованих розчинах.
Комплексні іони, що характеризуються великим значенням константи нестійкості, у водному розчині майже цілком розпадаються на комплексоутворювач і ліганди. Так, у розчині солі K2[MgCl4] рівновага дисоціації [MgCl4]2- Mg2+ + 4Cl- сильно зміщена вправо, комплексні іони існують тільки в концентрованих розчинах.
Комплексні сполуки з дуже хитливою внутрішньою сферою називають подвійними солями і позначають їх не координаційною формулою, а звичайними формулами через крапку. Наприклад,
2KCl×MgCl2,а не K2[MgCl4]; (NH4)2SO4 ×FeSO4×6H2O, а не (NH4)2[Fe(SO4)2(H2O)4]×2H2O (сіль Мора).
Подвійні солі – дуже розповсюджені сполуки. Між ними і комплексними сполуками різкої межі немає, відрізняються вони практично ступенем дисоціації комплексного іона. Тобто подвійні солі дисоціюють зразу на 100 відсотків.
Умови утворення і руйнування комплексних іонів.
Ізомерія комплексних іонів.
Оборотний характер процесу дисоціації комплексних іонів дозволяє руйнувати комплекси, зв'язуючи його складові частини в більш міцні комплекси або малорозчинні сполуки.
|
|
|
Розглянемо взаємодію [Ag(NH3)2]Cl з KJ і KCN.
У розчині діамінаргентум хлорид - [Ag(NH3)2]Cl цілком дисоціює на іони [Ag(NH3)2]+ і Cl-, комплексні іони дисоціюють частково:
 [Ag(NH3)2]+ Ag+ + 2NH3
[Ag(NH3)2]+ Ag+ + 2NH3
Рівновагу цієї реакції можна змістити цілком вправо, зв'язуючи іони Ag+ у більш міцний комплекс [Ag(CN)2]- , тому що
Kн 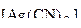 - = 1×10-21 < Kн
- = 1×10-21 < Kн 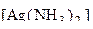 + = 9×10-8
+ = 9×10-8
або можна зв'язати іони Ag+ у важко розчинену сполуку AgJ, для якої ДРАgJ = 1×10-16 < K 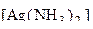 + = 9×10-8.
+ = 9×10-8.
Рівняння відповідних реакцій можна записати так:
1) [Ag(NH3)2]+ + 2CN- = [Ag(CN)2]- + 2NH3
[Ag(NH3)2]Cl + 2KCN = K[Ag(CN)2] + KCl + 2NH3
2) [Ag(NH3)2]+ + J- = AgJ¯ + 2NH3
[Ag(NH3)2]Cl + KJ = AgJ¯ + 2NH3 + KCl
Для комплексних сполук характерна ізомерія.
Існує ізомерія геометрична, пов'язана з різним положенням лігандів у вузлах кристалічних ґрат відносно комплексоутворювача. Так, комплекс [Pt(NH3)2Cl2] може існувати у вигляді двох просторових ізомерних форм, які відрізняються кольором, розчинністю, реакційною здатністю та іншими властивостями.
 |  |
Cl- NH3 Cl- NH3
Pt2+ Pt+2
NH3 Cl- Cl- NH3
|
|
|
транс-ізомер цис-ізомер
Відома іонізаційна ізомерія, що визначається різним розподілом іонів між внутрішньою і зовнішньою сферами, наприклад,
[Co(NH3)5Br]SO4 - пентаамінбромокобальт(II) сульфат і
[Co(NH3)5SO4]Br – пентаамінсульфокобольт(II) бромід.
Гідратна ізомерія зв'язана з різним розподілом молекул води. Так, кристалогідрати хром(III) хлориду відомі в трьох ізомерних формах:
[Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2×H2O, [Cr(H2O)4Cl2]Cl×2H2O
синьо-фіолетовий темно-зелений ясно-зелений
З явищем гідратної ізомерії зв'язана можливість одержання при випарюванні розчинів відповідних кристалогідратів різної будови і кольору: Cr2(SO4)3×18H2O (фіолетового) і Cr2(SO4)3×6H2O (зеленого);
Al2(SO4)3×18H2O і Al2(SO4)3×27H2O (кристалізується при температурі нижче 9,50С) та інші.
Аніони за їх здатністю до утворення внутрішньої сфери комплексних сполук можна розташувати у визначені ряди. Так, для комплексоутворювача Cr3+ ряд має вигляд: OH- >C2O42-> SO42- >Cl- .
Комплексні сполуки відіграють важливу роль у життєдіяльності організмів. Наприклад, такі найважливіші у фізіологічному відношенні речовини, як хлорофіл і гемоглобін, є складними внутрішньокомплексними сполуками.
|
|
|
Дата добавления: 2018-09-20; просмотров: 364; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
