Приклади розв ’ язання типових задач
Приклад. Визначте ступінь окиснення та координаційне число комплексоутворювача, а також заряд комплексного іону в сполуці
[Cr(NH3)6]Cl3. Напишіть рівняння електролітичної дисоціації цієї комплексної сполуки в водному розчині та вираз для константи нестійкості.
Розв’язання. Запишемо рівняння електролітичної дисоціації:
[Cr(NH3)6]Cl3 = [Cr(NH3)6]3+ + 3Cl-.
Враховуючи той факт, що в зовнішній сфері три іона Cl-, то заряд комплексного іону дорівнює +3. Розрахуємо заряд іону хрома: х+0 =+3; х=+3. Тоді ступінь окиснення хрома (заряд іону) дорівнює +3. Координаційне число іону Cr3+ дорівнює 6. Іон [Cr(NH3)6]3+ є слабким електролітом, но в незначній мірі оборотно дисоціює за другим ступенєм: [Cr(NH)6]3+=Cr3+ + 6NH3. Для цього процесу можна записати вираз константи рівноваги у вигляді
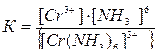
У випадку електролітичної дисоціації комплексного іону константу рівноваги називають константою нестійкості (Кн) цього комплексного іону. Чим менше значення Кн, тим міцніше комплексний іон.
Контрольн і за в дан н я
76. Складіть координаційну формулу комплексної сполуки платини: PtCl4×6NH3. Координаційне число платини (IV) дорівнює 6. Наведіть рівняння електролітичної дисоціації цієї сполуки у водному розчині.
77. Який механізм утворення хімічного зв'язку між іоном Cu2+ і молекулами амоніаку в сполуці [Cu(NH3)4)]SO4?
78. Порівняйте способи утворення ковалентних зв'язків в молекулі NH3 і в іоні NH4+ . Дайте обгрунтовану відповідь.
|
|
|
79. Обчисліть ступінь окиснення і координаційне число комплексоутворювача в комплексному іоні [Ni(NH3)5Cl]+. Наведіть рівняння електролітичної дисоціації і вираз для константи нестійкості комплексного іона.
80. Назвіть комплексну сіль K3[Fe(CN)6]. Наведіть для неї рівняння електролітичної дисоціації, вкажіть заряд і координаційне число комплексоутворювача.
81. Аргентум хлорид розчиняється у водних розчинах амоніаку. Дайте цьому пояснення і наведіть молекулярне і іонне рівняння відповідної реакції.
82. При взаємодії яких речовин утворилася комплексна сполука Na2[Zn(OH)4]? Наведіть рівняння електролітичної дисоціації цієї сполуки у водному розчині.
83. Алюміній гідроксид розчиняється в надлишку лугу КОН, утворюючи гідроксосполуку з координаційним числом, що дорівнює 6. Яка формула цієї сполуки? Наведіть рівняння реакції утворення цієї сполуки.
84. Як здійснюється хімічний зв'язок між молекулами NH3 і HCl? Яка сполука при цьому утворюється? Дайте обгрунтовану відповідь.
85. Наведіть молекулярне і іонне рівняння реакції обміну, що протікає між наступними солями: K4[Fe(CN)6] + FeCl3 = … + …, маючи на увазі, що комплексна сполука, яка утворюється, не розчинна у воді.
86. Як диссоціюють подвійні солі і комплексні сполуки? Наведіть рівняння електролітичної дисоціації: KCr(SO4)2 и K[AuCl4]. В останньому випадку визначте заряд комплексного іона, а також ступінь окиснення атома- комплексоутворювача.
|
|
|
87. Наведіть формулу комплексної сполуки, виходячи з його назви: натрій гексанітрито(III) кобальтат.
88. Визначте заряд і координаційне число комплексоутворювача в комплекснії сполуці K2[Co(CN)4]. Наведіть рівняння електролітичної дисоціації цієї солі у водному розчині.
89. Складіть формулу комплексного іона, в якому комплексоутворювачем з координаційним числом, що дорівнює 4, є іон Cu2+, а лігандами - молекули амоніаку. Наведіть вираз константи нестійкості цього комплексного іона.
90. При додаванні нітратної кислоти до розчину діаммінаргентум(I) хлориду утворюється осад арґентум хлориду. Наведіть молекулярне і іонне рівняння реакцій, поясніть причину руйнування комплексного іона.
ЗМІСТОВИЙ МОДУЛЬ ІІІ.
ЯКІСНИЙ АНАЛІЗ ХАРЧОВИХ ПРОДУКТІВ
Тема 7. Якісний аналіз аніонів та катіонів харчових продуктів
Виникнення і становлення хімії як науки тісно пов'язано з методами аналізу речовин.
Методи аналізу можна поділити на три групи: 1) хімічні; 2) фізичні; 3) фізико - хімічні. Першим етапом визначення складу речовин за хімічним та фізико-хімічним методами є проведення хімічної реакції. Кінцевий етап визначення полягає в спостереженні зовнішнього ефекту хімічної реакції (якісний аналіз) або кількісному вимірюванні однієї з фізичних властивостей продукту реакції (маси, інтенсивності забарвлення, об’єму тощо).
|
|
|
У загальному випадку хімічний аналіз складається з таких етапів: 1) переведення досліджуваної речовини у розчин; 2) відокремлення елементів, що визначаються, від інших та їх концентрування; 3) якісне виявлення і кількісне визначення. Для відокремлення, концентрування і визначення елементів застосовуються хімічні реакції різних типів.
В основі методів розділення і концентрування елементів лежать реакції осадження, комплексоутворення та окиснення - відновлення. Так, розділення іонів на окремі групи ґрунтується на реакціях осадження. До методів розділення належить хроматографічний аналіз, який полягає у тому, що компоненти суміші по-різному адсорбуються твердою речовиною-адсорбентом.
Харчові системи аналізуються за допомогою різних методів: хімічних, фізико-хімічних, фізичних.
Хімічний аналіз поділяється на:
|
|
|
1. Якісний
2. Кількісний
3. Структурний
4. Системний
Якісний призначається для якісного виявлення речовин. Кількісний встановлює кількість елементів. Структурний - для дослідження структур речовин. Системний - для визначення складних хімічних систем.
Також методи аналізу поділяються за способом проведення реакції на:
"Мокрий" метод - реакції проходять між розчинами (наприклад, отримання барій сульфату);
"Сухий" метод - пірохімічний метод (наприклад, забарвлення полум'я пальника солями в певний колір) і метод розтирання (розтирають дві сухі солі, наприклад, натрій ацетат та натрій гідросульфат - відчувається запах оцту).
Для хімічного аналізу речовин беруть різні кількості досліджуваного розчину і відповідно до цього — різну кількість реактивів. Метод аналізу, в якому використовують 0,1 — 1 г речовини, називається макрометодом, якщо використовують менше 0,01 г речовини — мікрометодом. Проміжний метод аналізу називається напівмікрометодом. У більшості випадків користуються напівмікрометодом. Існує і ультрамікрометод, коли для аналізу беруть дуже малу кількість речовини, а зовнішній ефект реакції спостерігають під мікроскопом.
Для проведення реакції можна використовувати одну або кілька крапель розчинів досліджуваної речовини на смужках фільтрувального паперу або на годинниковому скельці. Такий метод називається краплинним.
Для відкриття того чи іншого іона можна використовувати реакції, в результаті яких утворюються кристали певної форми. Такий метод називається мікрокристалоскопічним. Спостерігають за формою кристалів за допомогою мікроскопа або лупи.
Предмет якісного аналізу - розвиток теоретичних основ, розробка нових і вдосконалення існуючих методів, визначення елементного складу речовини.
Задача якісного аналізу - визначення якості речовини, визначення окремих елементів або іонів, що входять до складу речовини, що досліджується, ідентифікація речовини (встановлення аналогії з певними еталонами - стандартами).
У більшості випадків речовину переводять спочатку в розчин, а потім визначають у ньому наявність окремих компонентів - іонів або молекул. Аналіз у розчинах раніше називали «мокрим» методом на відміну від «сухого», за яким усі операції аналізу проводяться із сухими речовинами.
Під час аналізу речовини користуються реакціями, характерними для того чи іншого іона за наявності сторонніх іонів. У тих випадках, коли для якогось іона немає відповідних характерних реакцій, застосовують попереднє розділення іонів.
Якісний аналіз мокрим способом зводиться до виявлення катіонів і аніонів у розчинах солей, основ і кислот. Якісне виявлення іонів у розчині можна виконувати дробним (кожний іони виявляють характерними реакціями за наявності інших іонів) і систематичним (складну суміш іонів розділяють на окремі групи, в межах яких виявляють окремі іони) методами аналізу.
Розділення іонів на групи в систематичному ході аналізу застосовується тільки при виявленні катіонів. Аналіз аніонів проводиться за іншою схемою.
Дата добавления: 2018-09-20; просмотров: 340; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
