Способы выражения концентрации растворов
Концентрация растворов определяется количеством вещества, содержащемся в определенном объеме (или определенной массе) раствора или растворителя в зависимости от того, что выбрано в качестве меры измерения.
Наиболее употребительны следующие концентрации.
1. Массовая (весовая) процентная концентрация (С %) определяется числом граммов (весовых частей) растворенного вещества в 100 г. (в.ч.) раствора.
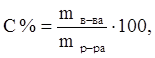
где m – масса, г.
Массу раствора можно выразить через его объем V мл и плотность r, г/мл.
mр-ра = V×ρ.
Молярная концентрация, молярность (См) определяется числом молей растворенного вещества в 1 литре раствора (моль/л):
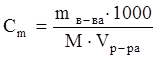 ,
,
где Vр-ра – объем раствора, мл; М – мольная масса вещества, г/моль; 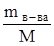 – число молей вещества в V мл. раствора.
– число молей вещества в V мл. раствора.
Эквивалентная, нормальная концентрация нормальность (Сн) определяется числом эквивалентов растворенного вещества в 1 литре раствора, (экв/л, н, N):
Сн 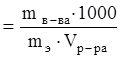 ,
,
где mэ – эквивалентная масса вещества, г/моль;  – число эквивалентов вещества в V мл раствора.
– число эквивалентов вещества в V мл раствора.
Эквивалентная масса вещества рассчитывается по формуле
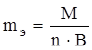 ,
,
где М – мольная масса вещества, г/моль; n – число атомов электроположительной части вещества; В – валентность.
Моляльная концентрация, моляльность (Cm) определяется числом молей растворенного вещества в 1 кг растворителя, (моль/кг):
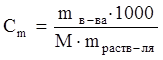 ,
,
где М - мольная масса вещества, г/моль; mв-ва и mраств-ля – соответственно массы растворенного вещества и растворителя, г; 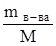 – число молей вещества.
– число молей вещества.
|
|
|
Титр раствора (Т) определяется числом граммов растворенного вещества в 1 мл раствора (г/мл):
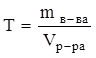 .
.
Титр также можно вычислить по формуле (г/мл):
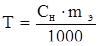 ,
,
где Сн – нормальная концентрация; экв/л; mЭ – эквивалентная масса вещества, г/моль.
Свойства растворов
Согласно закону Рауля повышение температуры кипения tкип или понижение температуры кристаллизации tкрист раствора прямо пропорционально моляльной концентрации растворенного вещества:
Δtкип = КЭСm,
где Δtкип – разность между температурами кипения раствора и чистого растворителя, °С, т. е. повышение температуры кипения; КЭ – эбуллиоскопическая константа растворителя; Сm – моляльная концентрация раствора,
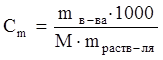 ,
,
где М - мольная масса вещества, г/моль; mв-ва и mраств-ля – соответственно массы растворенного вещества и растворителя, г.
Температура кристаллизации раствора определяется по формуле
Δtкрист = Кк,×Сm,
где Δtкрист – разность между температурами кристаллизации чистого растворителя и раствора, т. е. понижение температуры кристаллизации, °С; Кк – криоскопическая константа растворителя; Сm – моляльная концентрация раствора.
|
|
|
Для воды КЭ = 0,52°; КЭ = 1,86°.
Температура кипения
tкип = 100 + Δtкип, tкрист = 0 - Δtкрист.
Растворы электролитов
Вещества, молекулы которых в растворе или расплаве распадаются на ионы и проводят электрический ток, называются электролитами. Положительно заряженные ионы называются катионами. К ним относятся, например, ионы водорода Н+ и металлов Меn+. Отрицательно заряженные ионы называются анионами. К ним относятся ионы кислотных остатков (SO42-, Cl-, СO32- и др.) и гидроксид-ионы ОН-.
Процесс распада вещества на ионы называется электролитической диссоциацией.
Например, молекула соляной кислоты диссоциирует в водном растворе:
НСl = Н+ + Сl-.
Все электролиты условно делятся на сильные и слабые. Количественной характеристикой электролитов является степень диссоциации a – это отношение числа молекул, распавшихся на ионы (n¢), к общему числу растворенных молекул (n):
a = n¢/n.
Сильные электролиты полностью распадаются на ионы (a » 1 или » 100 %). К ним относятся:
кислоты - Н2SO4, НNO3, HCl, HBr, HJ, НMnO4, HСlO4, H2CrO4;
основания – LiOH, NaOH, КОН, RbOH, CsOH, Са(ОН)2, Bа(ОН)2, Sr(ОН)2;
cоли – почти все растворимые в воде.
|
|
|
Слабые электролиты не полностью распадаются на ионы (a < 3 %). К ним относятся все остальные кислоты, основания и некоторые соли.
Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации применяется знак обратимости Û.
Слабые электролиты характеризуются константой диссоциации Кд. Это есть отношение произведения концентраций ионов в растворе, возведенных в степени, соответствующие стехиометрическим коэффициентам уравнения диссоциации, к концентрации недиссоциированных молекул. Например:
Н2S Û 2H+ + S2-,
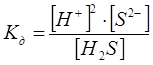 ,
,
где [ ] – концентрация.
Сильные электролиты диссоциируют в одну стадию:
H2SO4 Û 2H+ + SO42-,
Ba(OH)2 Û Ba2+ + 2OH-,
Na2CO3 Û 2Na+ + CO32-.
Слабые электролиты диссоциируют в две или более стадий:
1. Н2CO3 Û Н+ + НCO3- – I стадия.
НCO3- Û Н+ + CO32- – II стадия.
Суммарно процесс идет так:
Н2CO3 Û 2Н+ + CO32-.
2. Mg(OH)2 Û MgOH+ + OH- – I стадия.
MgOH+ Û Mg2+ + OH- – II стадия.
Суммарно процесс идет так:
Mg(ОН)2 Û Mg2+ + 2OH-.
Ионообменные реакции
Это реакции, идущие в растворах между ионами. Сущность их выражается ионными уравнениями, которые записываются так:
|
|
|
сильные электролиты пишутся в виде ионов, а слабые электролиты, газы, осадки (твердые вещества) – в виде молекул, независимо от того в какой части уравнения они находятся: левой или правой.
Задачи:
1. AgNO3 + HCl = AgCl¯ + HNO3 – молекулярное уравнение;
Ag+ + NO3- + H+ + Cl- = AgCl¯ + H+ + NO3- – ионное уравнение.
Если одинаковые ионы в обеих частях уравнения сократить, то получится краткое, или сокращенное, ионное уравнение:
Ag+ + Cl- = AgCl¯.
 CO2
CO2
2.  Na2CO3 + H2SO4 = Na2SO4 + H2CO3
Na2CO3 + H2SO4 = Na2SO4 + H2CO3
H2O
2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + CO2 + Н2О,
CO32- + 2H+ = CO2 + Н2О.
Молекулы CO2 и Н2О записываются в недиссоциированном виде, так как Н2О очень слабый электролит, CO2 – газ.
 CO2
CO2
 3. CaCO3¯ + 2HCl = CaCl2 + H2CO3
3. CaCO3¯ + 2HCl = CaCl2 + H2CO3
H2O
CaCO3¯ + 2H+ + 2Cl- = Ca2++ 2Cl- + CO2 + H2O,
CaCO3¯ + 2H+ = Ca2+ + CO2 + H2O.
4. CH3COOH + NH4OH = CH3COONH4 + H2O,
CH3COOH + NH4OH = CH3COO- + NH4+ +H2O,
CH3COOH и NH4OH – слабые электролиты.
 NH3
NH3
 5. CH3COONH4 + NaOH = CH3COONa + NH4OH
5. CH3COONH4 + NaOH = CH3COONa + NH4OH
H2O
CH3COO- +NH4++Na+ + OH- = CH3COO- + Na+ + NH3 + H2O,
CH3COO- + NH4+ + OH- = CH3COO- + NH3 + H2O.
Реакции в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Кислоты, соли и основания
Дата добавления: 2018-09-22; просмотров: 396; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
