Межмолекулярное взаимодействие.
Силы Ван-дер-Ваальса
Очень слабые силы притяжения между нейтральными атомами, молекулами, проявляющиеся на расстоянии, превосходящем размеры частиц, называют межмолекулярным притяжением, или силами Ван-дер-Ваальса. Свое название они получили по имени голландского исследователя, он ввел поправочный коэффициент в уравнение состояния идеального газа, так как эти силы обусловливают отступление свойств реальных газов от идеальных. Эти силы действуют между молекулами на небольших расстояниях, с увеличением расстояния между молекулами эти силы сильно убывают. Межмолекулярные силы имеют электрическую природу и рассматривают как результат действия трех эффектов – ориентационного, индукционного, дисперсионного:
Е = Еор. + Еинд. + Едисп..
5.7.1. Ориентационное взаимодействие
Возникает только в полярных веществах, молекулы которых обладают собственным дипольным моментом. При этом молекулы поворачиваются друг к другу разноименными полюсами и притягиваются (рис. 5.11). Величина ориентационного эффекта тем больше, чем больше дипольный момент молекулы и меньше расстояние между ними. С увеличением температуры ориентационный эффект уменьшается, так как тепловое движение молекул нарушает ориентацию диполей.
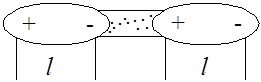
Рис. 5.11
5.7.2. Индукционное взаимодействие
Возникает между полярной и неполярной молекулами. Под влиянием электрического поля диполя в неполярной молекуле наводится (индуцируется) временный дипольный момент, а затем обе молекулы взаимодействуют как диполи. Индукционное взаимодействие в 10–20 раз меньше ориентационного, оно сильно зависит от поляризуемости неполярной молекулы и дипольного момента полярной. Чем больше поляризуемость и чем больше дипольный момент, тем сильнее ориентационное взаимодействие.
|
|
|
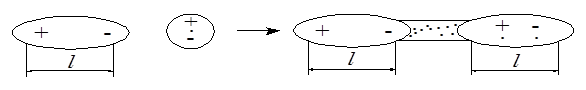
Рис. 5.12
Индукционное взаимодействие, в отличие от ориентационного, не зависит от температуры, так как наведение дипольного момента в неполярной молекуле осуществляется при любом пространственном положении (рис. 5.12).
5.7.3. Дисперсионное взаимодействие
Это взаимодействие возникает между неполярными молекулами и всеми другими независимо от их строения и полярности, это взаимодействие универсально, оно обуславливает жидкое и твердое состояние молекул.

Рис. 5.13
Рассмотрим систему, состоящую из электронов и ядер. В любой момент времени вследствие несовмещения центров тяжести электронного облака и ядра такая система представляет собой мгновенный диполь, направление диполей соответствует движению электронов и непрерывно меняется. Каждый из диполей будет влиять на ориентацию подобных мгновенных диполей в соседних молекулах. Движение всех диполей системы перестает быть независимым и становится синхронным (рис. 5.13).
|
|
|
Вопросы для самоподготовки
Почему атомы соединяются в молекулы?
Природа химической связи.
Как длина и энергия связи позволяют оценить ее прочность?
Какие существуют типы химической связи?
Существует ли стопроцентная ионная или ковалентная связи?
Почему полярные молекулы называют диполями?
Полярность и поляризуемость химической связи - понятия разные или одинаковые?
Влияет ли природа взаимодействующих атомов на полярность молекул?
Как устроена металлическая кристаллическая решетка?
Чем отличается металлический тип связи от ковалентной?
Почему металлы хорошо проводят электричество, тепло, ковки, пластичны?
РАСТВОРЫ
Раствором называется термодинамически устойчивая однофазная конденсированная система переменного состава, состоящая из двух или большего числа компонентов (растворенного вещества и растворителя).
Дата добавления: 2018-09-22; просмотров: 557; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
