СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН
Открытие Периодического закона Д. И. Менделеевым относится к 1869 г. Закон был сформулирован следующим образом: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
В современном состоянии Периодическая система элементов состоит из 10 горизонтальных рядов (периодов) и 8 вертикальных столбцов (групп). Первые три ряда образуют три малых периода. Последующие периоды включают по два ряда. Кроме того, начиная с шестого, периоды включают дополнительные ряды лантаноидов (шестой период) и актиноидов (седьмой период).
По периоду наблюдается ослабление металлических свойств и усиление неметаллических. Конечный элемент периода представляет собой благородный газ. Каждый последующий период начинается со щелочного металла, т. е. по мере роста атомной массы элементов изменение химических свойств имеет периодический характер.
Вертикальные ряды называются группами. Каждая группа состоит из элементов, сходных по свойствам.
В больших периодах наблюдается периодичность изменения свойств внутри самих периодов. Например, высшая валентность по кислороду сначала равномерно растет, затем, достигнув максимума в середине периода, падает до +2, затем снова возрастает и достигает +7 в конце периода.
Д. И. Менделееву пришлось отступить от принципа возрастания массы для трех элементов и поставить аргон (атомная масса 39,948) до калия (39,098), кобальт (58,9332) до никеля (58,70) и теллур (127,60) до йода (126,9045). Отступление сделано исходя из свойств элементов, требовавших такой последовательности в расположении.
Последующие открытия в строении атома оказались фундаментальной основой Периодического закона Д. И. Менделеева.
Открытие электрона Дж. Дж. Томсоном в 1897 г., а также радиоактивности А. Беккерелем в 1896 г. и последующие исследования в этом направлении привели к установлению сложного строения атома.
В 1911 г. Резерфорд предложил ядерную модель атома. Атом состоит из ядра, вокруг которого вращаются электроны. Ядро несет положительный заряд, а электроны - отрицательный. Суммарный заряд атома равен нулю. Диаметр атома, примерно 10-8 см, диаметр ядра 10-13–10-12 см.
Из опытов Резерфорда следовало, что заряд ядра в относительных единицах численно равен порядковому номеру элемента. Это же было подтверждено Г. Мозли в 1913 г.
В настоящее время Периодический закон Д. И. Менделеева формулируется следующим образом: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Согласно ядерной модели атома, электроны движутся по круговым орбитам вокруг ядра и кулоновская сила притяжения между электроном и ядром компенсируется центробежной силой отталкивания. Приобретая или отдавая энергию, электрон по спирали переходит на другую орбиту. Однако спектры раскаленных газов линейчатые или дискретные, в них представлены только отдельные вполне определенные линии, а это не должно наблюдаться в соответствии с предложенной теорией.
С другой стороны, по законам классической электродинамики электрон при своем движении должен излучать электромагнитные волны, терять при этом энергию и через 10-6 секунды упасть на ядро.
В 1913 г. Нильс Бор предположил, что имеются устойчивые разрешенные состояния электрона в атоме, в которых он не испускает и не поглощает энергию. Переход из состояния в состояние осуществляется скачкообразно.
Бор опирался на идею М. Планка о квантовании энергии. Согласно этой идее, световая энергия испускается и поглощается квантами, пропорциональными частоте светового колебания (n):
Е = hn, (1)
h = 6,6252.10-34Дж.с - постоянная Планка.
Бор предложил два постулата, ставшие основой его модели:
1. Из бесконечного числа орбит, возможных с точки зрения классической механики, допустимы лишь определенные дискретные орбиты, по которым электрон движется не излучая энергии.
2. Частота испускаемого атомом излучения при переходе с орбиты на орбиту определяется соотношением hn = Eнач. - Екон..
Постулаты оправдались при расчете спектра атома водорода. Но в целом теория оказалась внутренне противоречивой и многое не объясняла.
Дальнейшее развитие теории строения атома связано с квантовой механикой. Корпускулярные свойства фотона выражены уравнением (1). Волновые свойства через уравнение (2):
ln = с, (2)
где l - длина волны электромагнитного колебания, n - его частота; с - скорость распространения света. Из уравнений (1) и (2) следует:
Е = hc/l. (3)
С другой стороны, по уравнению Эйнштейна
E = mc2, (4)
тогда
mc2 = hc/l, (5)
откуда
l = h/mc. (6)
Поскольку произведение массы тела на его скорость называется испульсом (р), то последнее уравнение можно записать в следующем виде:
l = h/p. (7)
В 1924 г. Де Бройль предположил наличие корпускулярно- волнового дуализма у электрона. В этом случае
l = h/mv, (8)
т. е. движение электрона характеризуется волновыми свойствами. Это подтверждает дифракция электронов.
В 1925 г. Шредингер предположил, что состояние электрона в атоме описывается уравнением стоячей электромагнитной волны. Подставив в него l из уравнения Де Бройля, он получил уравнение, связывающее энергию электрона с пространственными координатами и так называемой волновой функцией y, которая в этом уравнении соответствует амплитуде трехмерного волнового процесса. Уравнение Шредингера имеет вид
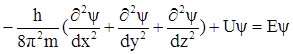 , (9)
, (9)
где U - потенциальная энергия электрона; Е - полная энергия электрона.
Следует отметить:
1. Уравнение имеет решение при некоторых определенных значениях энергии электрона. Квантовый характер поведения электрона в атоме является следствием решения уравнения, использующего волновые характеристики движения электрона.
2. Решения уравнения дают вероятность нахождения электрона в той или иной точке пространства вокруг ядра атома и никак не связывают эту вероятность с траекторией движения электрона.
В это же время Гейзенберг предложил уравнение, которое носит название принципа неопределенностей:
Δx × Δ(mvx) ³ h / 2p. (10)
Из уравнения (10) следует, что нельзя с одинаковой точностью определит координату частицы (Δх) и ее импульс (Δmvx), то есть нельзя точно указать положение электрона в каждый момент времени, можно лишь говорить о вероятности его пребывания около ядра, которая пропорциональна Y2. Часто говорят об электроне, как о размытом в пространстве облаке отрицательного заряда, хотя физически эта модель несовершенна.
Электрон в атоме представляет собой трехмерную колеблющуюся систему, которой соответствует трехмерная стоячая волна. Для этого случая уравнение имеет решение при определенных значениях трех так называемых квантовых чисел. Между кинетической энергией электрона и главным квантовым числом существует взаимосвязь:
Е = h2 × n2 / 8ml, (11)
где l - длина атома; m - масса электрона.
Главное квантовое число принимает значения 1, 2, 3, и т. д. Состояние электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме. Электронное облако увеличивается с ростом энергии электрона, т. е. с ростом значения главного квантового числа. Электроны с одним значением главного квантового числа образуют электронные облака одинаковых размеров. Обычно говорят об электронных слоях или электронных оболочках, отвечающих определенным значениям главного квантового числа. Каждый энергетический уровень обозначается заглавной буквой латинского алфавита (табл. 4.1).
Таблица 4.1
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Обозначение | K | L | M | N | O | P | Q |
Форма электронного облака не может быть произвольной. Она определяется орбитальным квантовым числом l, которое также называют азимутальным или побочным. При данном значении n оно принимает целочисленные значения от 0 до (n - 1):
n = 1; l = 0.
n = 2; l = 0; 1.
n = 3; l = 0, 1, 2.
Таким образом, данному n соответствует n побочных квантовых чисел.
Физический смысл побочного квантового числа состоит в том, что оно определяет значение орбитального момента количества движения электрона, а эта величина является квантованной характеристикой состояния электрона в атоме.
В многоэлектронных атомах энергия электрона зависит и от главного, и от орбитального квантовых чисел. Поэтому состояния электрона с разными l называют энергетическими подуровнями электрона в атоме. Подуровням присвоены буквенные обозначения (табл. 4.2).
Таблица 4.2
| l | 0 | 1 | 2 | 3 |
| Обозначение | s | p | d | f |
Обычно говорят об s-, p-, d-, f- подуровнях и соответственно об s-, p-, d-, f-электронах.
При записи цифрой указывается главное квантовое число, а затем буквой - орбитальное квантовое число. Например, 2р означает, что у электрона n = 2, l = 1; 3d: n = 3, l = 2.
Электронное облако не имеет очерченных границ в пространстве. Можно говорить лишь о его плотности в каждой точке пространства, и она определяется квадратом волновой функции Y2.
Обычно проводят граничную поверхность, которая заключает 90 % заряда и массы электрона.
Граничная поверхность 1s электрона представляет собой сферу. Значения Y и Y2 в зависимости от расстояния от ядра не зависят от направления в пространстве. Это справедливо для 2s, 3s и т. д.
Для 2р электронов Y не имеет сферической симметрии, у l облаков - форма гантелей, или восьмерок, расположенных вдоль каждой из координатных осей. Для d-электронов четыре облака имеют форму четырехлопастных лепестков, пятое имеет форму восьмерки с пояском по центру. Из уравнения Шредингера следует, что ориентация облака в пространстве не может быть произвольной и определяется значением магнитного квантового числа m. При данном l существует от -l до +l целочисленных значений m : l = 0, m = 0; l = 1, ml = -1, 0, 1; l = 2, ml = -2, -1, 0, 1, 2 и т. д. В общем случае число значений m равно (2l + 1).
ml получило название магнитного квантового числа, так как его значения зависят от взаимодействия магнитного поля, создаваемого электроном, с внешним магнитным полем. Если внешнее магнитное поле отсутствует, то энергия электронов в атоме не зависит от значения ml.
Состояние электрона в атоме, характеризующееся определенными значениями трех квантовых чисел или, иными словами, определенной энергией, формой и ориентацией электронного облака в пространстве, получило название атомной электронной орбитали.
Количество m при данном l соответствует количеству электронных облаков, т. е. на подуровне s одно облако сферической формы (l = 0, ml = 0). Любые его расположения в пространстве идентичны.
Для p-облаков (l = 1, ml = -1, 0, +1) возможны три способа расположения в пространстве вдоль координатных осей.
На d-подуровне (l = 2, ml = -2, -1, 0, +1, +2) существует пять облаков. Три из них расположены между осями координат и обозначаются dxy, dyz, dxz, четвертое направлено вдоль осей x-y и обозначается dx2-y2 , пятое - вдоль оси z и обозначается dz2.
Исследования атомных спектров показали, что есть четвертое число, которое характеризует электрон, хотя и не связано с его движением вокруг сферы. Это число назвали спиновое квантовое число и обозначили буквой mS. Это число характеризует вращение электрона вокруг собственной оси, он принимает значения +1/2 и -1/2.
n, l, ml, mS полностью определяют состояние электрона в атоме.
В многоэлектронных атомах на каждый электрон действуют остальные электроны, при этом электронные облака отдельных электронов как бы сливаются в общее многоэлектронное облако.
По энергетическим подуровням происходит возрастание энергии в следующем порядке:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f @
@ 5d < 6p < 7s < 5f @ 6d < 7p.
Для определения состояния электрона в атоме используется принцип запрета Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Это значит, что каждая атомная орбиталь с определенными n, l, ml может быть занята не более, чем двумя электронами, спины которых противоположны по знаку. Такие электроны называют спаренными. Максимальное число электронов на подуровне равно 2×(2l + 1), максимальное число электронов на энергетическом уровне равно 2n2.
Орбиталь обычно обозначают в виде квадрата , внутри которого изображают стрелками электроны с разными спинами (¯). Число орбиталей на подуровне равно количеству магнитных квантовых чисел. В некоторых случаях используются обозначения в виде символов. Например, для водорода 1s1, для гелия 1s2 , для лития 1s2 2s1, для бериллия 1s2 2s2, для бора 1s2 2s2 2p1 . На подуровне p имеется три орбитали ’’’. Первая ячейка заполняется одним электроном у атома бора, за ним следует углерод. В этом случае второй р-электрон пойдет во вторую ячейку, или, иными словами, на вторую орбиталь. Такой порядок заполнения определяет правило Гунда. Оно гласит: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. У следующего после углерода азота электрон заполняет третью свободную орбиталь, т. е. электронная формула для азота будет 1s22s22p3. Для последующих элементов пойдет заполнение каждой орбитали вторым электроном.
Приведенный выше порядок заполнения подуровней определяется двумя правилами В. М. Клечковского.
Первое правило гласит: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и побочного квантовых чисел (n + l) к орбиталям с большим значением этой суммы.
Осложнений не возникает до подуровня 3d.
Для 3d n = 3, l = 2, (n + l) = 5, для 4s n = 4, l = 0, (n + l) = 4, поэтому будет заполняться сначала 4s, а затем 3d. Для скандия: Z = 21:
3d; (n + l) = 5,
4p; (n + l) = 5,
5s; (n + l) = 5.
При одинаковых величинах суммы (n + l) энергия электрона тем выше, чем больше значение главного квантового числа. В этом случае порядок заполнения определяет второе правило Клечковского: при одинаковых значениях (n + l) заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа. Таким образом, у скандия начинает заполняться подуровень 3d. У цинка заполнение 3d завершается. Эти элементы называются d-элементами, или переходными элементами. Особенность заполнения этих оболочек в том, что при переходе к каждому последующему элементу новый электрон появляется не во внешнем (n = 4), а во втором снаружи (n = 3) электронном слое.
После заполнения 3d идет заполнение 4p-подуровня ( с Ga до Kr). С рубидия заполняется подуровень 5s. В четвертом электронном слое имеется f-подуровень, который в пятом периоде не заполняется.
После заполнения 5s2 у стронция идет заполнение
4d (Y - Cd) – d-элементы, затем 5p (In - Xe) – р-элементы.
Шестой период начинается с s-элементов цезия и бария, у них (n + l) = 6, затем 4f, (n + l) = 7. Но у лантана (Z = 57) появляется 5d1 – электрон. У следующего церия начинает заполняться 4f-подуровень, туда же переходит и электрон с 5d. Электронная формула для церия имеет вид
1s22s22p63s23p64s23d104p65s24d105p66s24f2.
14 элементов-лантаноидов относятся к f-элементам. Харктерно, что у них заполняется слой n = 4. C Hf, Z = 72, начинается заполнение 5d-подуровня, оно заканчивается у Hg (Z = 80).
Седьмой период построен аналогично шестому периоду: Fr и Ra - s-эле-менты, Ac (Z = 89) – d-элемент, затем 14 f-элементов - актиноидов.
В некоторых случаях наблюдается проскок электронов. Например, при переходе от никеля (Z = 28) к меди (Z = 29) число электронов увеличивается на 2 за счет проскока одного 4s-электрона на 3d (3d104s1). Аналогичный проскок у серебра и золота. Это связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням. Проскок электрона наблюдается также у Nb, Pd, Pt.
В кристаллах атомы можно представить в виде соприкасающихся друг с другом шаров. Тогда расстояние между центрами соседних атомов можно принять равным двум радиусам.
Зависимость атомных радиусов от зарядов имеет периодический характер. В пределах периода с ростом заряда ядра размер атома уменьшается, что объясняется притяжением электронов к ядру. Это иллюстрирует табл. 4.3.
Таблица 4.3
| Элемент | Li | Be | B | C | N | O | F |
| r, нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
| Элемент | Na | Mg | Al | Si | P | S | Cl |
| r, нм | 0,189 | 0,160 | 0,143 | 0,134 | 0,130 | 0,104 | 0,099 |
В пределах подгруппы с ростом заряда ядра размеры атомов увеличиваются (табл. 4.4).
Таблица 4.4
| Li 0,155 | Be 0,113 | N 0,071 |
| Na 0,189 | Mg 0,160 | P 0,130 |
| K 0,236 | Ca 0,197 | As 0,148 |
| Rb 0,248 | Sr 0,215 | Sb 0,161 |
| Cs 0,268 | Ba 0,221 | Bi 0,182 |
Если атом лишается части электронов, то образуются положительно заряженные катионы, если же он присоединяет электроны, то образуются отрицательно заряженные анионы.
Радиус катиона всегда меньше, а у аниона больше, чем радиус электронейтрального атома.
В пределах одной подгруппы радиус ионов одинакового заряда возрастает с увеличением заряда ядра, что связано с ростом числа электронных слоев (табл. 4.5).
Таблица 4.5
| 1-я группа | 2-я группа | 6-я группа | 7-я группа |
| Li+ 0,068 | Be2+ 0,034 | O2- 0,136 | F- 0,133 |
| Na+ 0,098 | Mg2+ 0,074 | S2- 0,182 | Cl- 0,181 |
| K+ 0,133 | Ca2+ 0,104 | Se2- 0,193 | Br- 0,196 |
| Rb+ 0,149 | Sr2+ 0,120 | Te2- 0,211 | I- 0,220 |
Металлы легко отдают внешние электроны, а неметаллы их присоединяют. Энергия, затрачиваемая на отрыв электронов от атома, называется энергией ионизации. Ее определяют бомбардировкой атомов пучком электронов, ускоренных в электрическом поле. Наименьшее напряжение поля, при котором скорость электронов, бомбардирующих атом, достаточна для его ионизации, называется потенциалом ионизации данного элемента.
Отрыв каждого последующего электрона идет при более высоком потенциале. Поэтому второй и третий потенциалы ионизации значительно выше первого. Металлические свойства элемента выражены тем сильнее, чем ниже потенциал ионизации.
С увеличением заряда ядра в пределах подгруппы потенциал ионизации уменьшается. Это связано с возрастанием радиусов атомов и увеличением числа электронных слоев, экранирующих ядро, за счет чего уменьшается его связь с внешними электронами.
По периоду заряд ядра растет, радиус уменьшается, поэтому потенциал ионизации увеличивается, а металлические свойства ослабевают.
Для случая, когда элементы присоединяют электроны, говорят о сродстве к электрону. Оно характерно для металлоидов, близко к нулю или отрицательно для металлов. Его измеряют в электронвольтах (эВ). 1 эВ – энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1В (1 эВ = 1,6.10-9 Дж).
Ядро атома состоит из протонов (р) и нейтронов (n). Заряд протонов равен +1, нейтрон заряда не имеет. Масса протона равна 1,00728 а.е.м., масса нейтрона – 1,00867 а.е.м.
Атомы одного элемента могут иметь разное число нейтронов. Такие атомы называются изотопами, например, 24Mg, 25Mg, 35Cl, 37Cl. Массовое число атома равно сумме масс протонов и нейтронов. Масса ядра всегда меньше суммы масс протонов и нейтронов. Это так называемый дефект массы. Он связан с тем, что при образовании ядра из нуклонов ( нуклоны- протоны и нейтроны ) выделяется энергия связи ядра.
Самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (a-частицы), называется радиоактивностью.
Радиоактивная постоянная показывает, какая часть атомов от общего числа распадается в 1 секунду. Чем больше радиоактивная постоянная, тем быстрее распадается атом.
Количество атомов радиоактивного изотопа, распадающихся в единицу времени, пропорционально имеющемуся в данный момент общему количеству атомов этого изотопа.
Промежуток времени, в течение которого разлагается половина первоначального количества элемента, называется периодом полураспада.
Основные виды радиоактивного распада a-распад, b-распад, электронный захват и спонтанное деление.
При a-распаде ядро испускает 4He и образуется атом элемента, смещенного на 2 места от исходного элемента к началу периодической системы. b-распад по современным представлениям: р и n - два состояния нуклона. Избыток нейтронов приводит к неустойчивости изотопа, при этом распад идет по схеме n ® p + e, возможно и по схеме p ® n + e+, где е+ – позитрон. Этот распад называется позитронным, он наблюдается у некоторых искусственных элементов.
При b-распаде образуется атом элемента, смещенного на одно место от исходного радиоактивного элемента к концу периодической системы ( при позитронном распаде наоборот).
Электронный захват происходит по схеме e + p ® n.
Спонтанное деление - самопроизвольный распад ядер тяжелых элементов на два (иногда на три или четыре) ядра элементов средины периодической системы.
Наряду с естественной существует искусственная радиоактивность.
Вопросы для самоподготовки
Назовите имена великих ученых, которые способствовали становлению атомно-молекулярного учения.
Кто впервые ввел понятие “атомный вес”, сделал химию из науки качественно-описательной количественной?
Что такое атом, нуклоны? Дать их характеристику.
Назовите имена ученых, давших первые значимые модели атома. Их положительные и отрицательные стороны.
Что означает двойственная природа материальной частицы?
Что такое волны Де-Бройля?
Что изучает наука квантовая механика?
Что такое уравнение состояния квантовой механики, уравнение Шредингера?
Что такое атомная орбиталь?
Какие квантовые числа вы знаете? Зачем они нужны?
Сколько подуровней на энергетическом уровне при данном п?
Что такое электронные формулы элементов?
Каков порядок заселения электронами энергетических уровней и подуровней? Какие правила при этом соблюдаются? Каково максимальное число электронов на подуровнях, уровнях при данном п?
Зачем нужно знание электронных структур атомов элементов?
Система элементов Д. И. Менделеева, его формулировка периодического закона.
Закон Мозли. Современная формулировка периодического закона.
В чем причина периодического изменения свойств элементов и их соединений?
Как по положению элемента в таблице Д. И. Менделеева предсказать:
состав ядра (количество протонов и нейтронов), количество электронов;
структуру электронной оболочки атома;
число валентных электронов,
свойства его самого и его основных соединений.
Калий и медь элементы одной группы, одного периода, а свойства их резко отличаются (калий очень активный металл, а медь очень пассивна). Причины?
Дата добавления: 2018-09-22; просмотров: 812; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
