ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Атомы, соединяясь между собой, приводят к образованию простых и сложных веществ. Как же атомы соединяются друг с другом? Какова природа химической реакции?
Учение о химической связи – основная проблема химии. Не зная природы химической связи, нельзя понять причины многообразия химических соединений, представить механизм их образования. От природы, характера сил, действующих между атомами, зависят и свойства соединений: химические, физические и др.
В 1916 г. немецкий ученый Коссель предположил, что при взаимодействии один из атомов отдает, а другой - принимает электрон. При этом первый атом превращается в положительно заряженный ион, а другой - в отрицательно заряженный ион и они притягиваются друг к другу за счет сил электростатического притяжения. Дальнейшее развитие идей Косселя привело к созданию теории ионной связи.
В том же 1916 г. американский ученый Льюис предложил теорию образования химической связи с помощью электронных пар, обобществленных и одновременно принадлежащих двум атомам. Эта идея была положена в основу современной теории ковалентной связи.
В настоящее время существует множество методов описания и объяснения химической связи, но природа любой связи едина, она имеет электрическое происхождение, так как при образовании любой связи обязательно принимают участие электроны.
Параметры химической связи
Основными параметрами молекул являются длина связи, энергия связи, валентный угол.
|
|
|
Длина связи – расстояние между центрами ядер взаимодействующих атомов в молекуле. Она определяется экспериментально, измеряется в ангстремах (Å) или в нанометрах (нм). Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов. Примеры определения длины (l) связи:
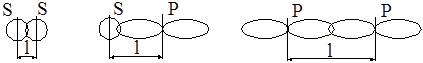
Энергия связи – очень важная характеристика молекулы. Энергия, которая выделяется при образовании молекулы /АВ/ из атомов /А/ и /В/, называется энергией связи. Измеряется она в джоулях (Дж).
А + В = АВ + Есв.
Мерой прочности связи является количество энергии, затраченной на ее разрыв:
АВ = А + В – Еразр., Есв = – Еразр..
Длина связи и ее энергия – взаимозависимые величины. Чем связь длиннее, тем она менее прочна и наоборот.
Задача.
Молекула Есв, кДж/моль Длина связи, Å
Н – F 614,4 0,90
Н – Cl 430,5 1,28
Н – Br 353,6 1,41
Н – I 299,4 1,62
|
|
|
Валентный угол – угол между линиями связи.
Задача.
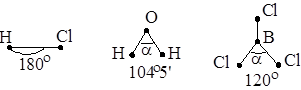
Валентный угол взаимосвязан с пространственной геометрической структурой молекул, характером связи в молекуле.
Типы химической связи
1. Ковалентная.
2. Ионная.
3. Металлическая.
4. Водородная.
5. Силы межмолекулярного взаимодействия:
а) ориентационные,
б) индукционные.
в) дисперсионные.
Ковалентная связь
В раскрытии природы химической связи большую роль сыграла квантовая химия. Наибольшее распространение получили два квантово-механических способа расчета систем из ядер и электронов (молекул):
1. Метод молекулярных орбиталей (ММО).
2. Спиновая теория валентности, или метод валентных схем (МВС).
5.3.1. Метод молекулярных орбиталей
Созданный ранее метод валентных схем (ВС) не мог обосновать некоторые вопросы в теории ковалентной связи.
1. По методу ВС связь между атомами осуществляется за счет электронных пар. Как же тогда объяснить устойчивость молекулярного иона водорода Н2+ (Н×Н)+. Связь в данном случае одноэлектронная, а ион устойчив (Есв = 259 кДж/моль).
2. Экспериментально было доказано, что молекула О2 – парамагнитна, т. е. в ее структуре имеется неспаренный электрон. Метод ВС этого объяснить не в состоянии.
|
|
|
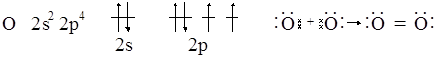
Приведенные здесь и многие другие факторы получили объяснение на основе метода молекулярных орбиталей (МО). Этот метод исходит из следующих положений.
1. В молекуле все электроны являются общими, сама молекула – это совокупность ядер и электронов, это единое целое.
2. Подобно тому, как в атоме каждому электрону соответствует атомная орбиталь (АО), в молекуле каждому электрону соответствует молекулярная орбиталь (МО):
АО s, р, d, f ... (буквы латинского алфавита),
МО s, p, d, j ... (буквы греческого алфавита).
Каждая МО также характеризуется набором квантовых чисел, только МО в отличие от АО многоядерная (многоцентровая), а не двухядерная (двухцентровая).
3. Молекулярные орбитали строятся из атомных орбиталей путем линейных комбинаций (т. е. путем сложения и вычитания волновых функций). Поэтому метод еще называют МО ЛКАО – молекулярные орбитали – линейные комбинации атомных орбиталей.
4. Молекулярных орбиталей образуется столько, сколько комбинируется атомных орбиталей.
5. В молекуле при заполнении электронами молекулярных орбиталей сохраняются принцип минимума энергии, запрет Паули, правило Гунда и др.
|
|
|
Поскольку молекулярные орбитали многоцентровые, они по форме сложнее атомных орбиталей.
Рассмотрим пример построения простейших молекул по методу молекулярных орбиталей, например, водорода (Н2).
Образование МО из АО изображают в виде энергетических диаграмм. По вертикали откладывают значение энергии, которая возрастает снизу вверх. Рассмотрим энергетическую диаграмму построения молекулы водорода по методу МО. Из двух исходных АО (1s) получили две молекулярные орбитали: одну с меньшей энергией – связывающую и другую с большей энергией – разрыхляющую.
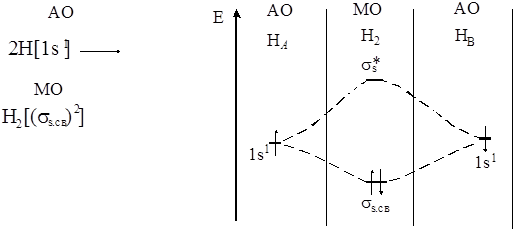
Согласно принципу минимума энергии, два электрона двух атомов водорода займут связывающую орбиталь с меньшей энергией, по запрету Паули спины электронов должны быть антипараллельны.
Согласно методу МО образование молекулы возможно только в том случае, если число электронов на связывающей орбитали больше, чем на разрыхляющей. В противном случае молекула не образуется. Кратность связи определяют по числу связывающих электронов по формуле
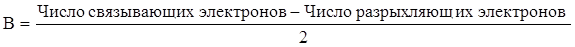 .
.
Рассчитаем кратность связи в молекуле водорода: 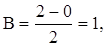 т. е. осуществляется одним электроном. Кратность связи равна единице.
т. е. осуществляется одним электроном. Кратность связи равна единице.
5.3.2. Метод валентных схем – спиновая теория валентности
Из раздела “Химическая термодинамика” мы уже знаем, что устойчивая молекула может образоваться только при условии уменьшения потенциальной энергии системы.
Впервые с позиций квантовой механики природу сил в молекуле водорода объяснили В. Гейтлер и Ф. Лондон в 1927 г. Они осуществили приближенный расчет на основании уравнения Шредингера и нашли зависимость потенциальной энергии системы, состоящей из двух атомов водорода от расстояния между ядрами этих атомов. Они выяснили, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При одинаковых спинах (рис. 5.1, кривая 1) энергия системы из двух сближающихся атомов непрерывно возрастает, т. е. связь между атомами водорода не возникает. При антипараллельных спинах (рис. 5.1, кривая 2) при сближении атомов энергия системы уменьшается и достигает минимума при rо = 0,74 Å, образуется молекула водорода, для которой это и есть длина связи.
Итак, условием образования ковалентной связи является противоположное направление спинов электронов взаимодействующих атомов.
Образование связи между атомами водорода является результатом перекрывания, взаимопроникновения электронных облаков взаимодействующих атомов. Область перекрывания лежит между ядрами, здесь повышенная электронная плотность, образуется общее молекулярное облако, положительно заряженные ядра притягиваются к области перекрывания и образуется устойчивая молекула.
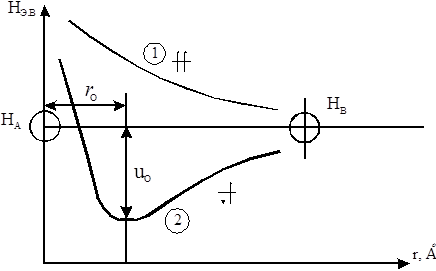
Рис. 5.1
Американский ученый Льюис предложил изображать химическую связь в виде валентных схем (ВС):

Ковалентная связь по методу ВС является двухэлектронной, двухцентровой. Слейтер и Полинг распространили этот метод на многоатомные молекулы. В основе метода лежат два положения.
1. Ковалентная связь образуется двумя неспаренными электронами с антипараллельными спинами, эта пара электронов одновременно принадлежит двум атомам. Ковалентная связь может образоваться как между атомами одного элемента, так и разных.
2. Ковалентная связь тем прочнее, чем больше степень перекрывания электронных облаков. Степень же перекрывания зависит от размера электронного облака, формы орбитали и способа их перекрывания.
Влияние способа перекрывания и формы электронного облака на прочность связи рассмотрим на рис. 5.2, 5.3.
а). область перекрывания лежит на линии связи – это s-связь, самая прочная и самая распространенная. Там, где имеется одинарная связь, это всегда s-связь (рис. 5.2);
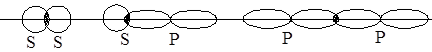
Рис. 5.2
б) область перекрывания перпендикулярна оси связи и есть две области перекрывания – это p связь. Она длиннее s связи и менее прочна (рис. 5.3).

Рис. 5.3
5.3.3. Донорно-акцепторный механизм образования химической связи
Ковалентная связь образуется не только путем обобществления электронных пар (одноэлектронный механизм образования связи). Возможен и другой механизм образования связи – двухэлектронный, или донорно-акцепторный. В этом механизме один атом представляет для связи неподеленную пару электронов (это донор электронной пары), а другой атом представляет свободную орбиталь (акцептор электронной пары):
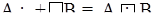
5.3.4. Свойства ковалентной связи (насыщаемость, направленность)
Свойство насыщаемости – это способность атома образовывать ограниченное число ковалентных связей. Это свойство определяет количественный состав молекул (Н2, а не Н3 или Н4). Почему? К молекуле водорода Н2 нельзя присоединить еще один атом водорода, так как спин его электрона окажется параллельным одному из электронов в молекуле и произойдет отталкивание.
Свойство насыщаемости или его еще называют ковалентность определяется наличием в атоме валентных орбиталей и числом валентных электронов (неспаренных). Число валентных неспаренных электронов может быть увеличено при возбуждении атомов.
Валентность углерода в невозбужденном состоянии равна 2, а в возбужденном – 4. Максимальная ковалентность углерода равна 4. Существует молекула СН4 (метан), а не СН3 или СН5.
Направленность – это важнейшее свойство связи, определяющее геометрию молекул, пространственную структуру. Причина направленности связи заключается в том, что перекрывание орбиталей, образующих химическую связь, происходит в направлении их наибольшей плотности. Так как форма АО и плотность разная, то связь имеет разное направление:
s-облако – сфера, образует легко связи по всем направлениям;
p-облако – “гантели”, направлены по трем координатным осям, рх, ру, рzобразуют связи вдоль трех координатных осей. Рассмотрим примеры построения молекул.
Наиболее простые случаи образования связи в двухатомных молекулах, когда оба атомы одновалентны (линейные молекулы, угол валентный – 180°).
В этих случаях электронная плотность симметрично распределена или оттянута к более электроотрицательному атому (рис. 5.4).
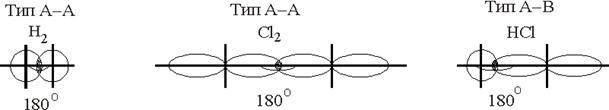
Рис. 5.4
 Молекулы типа А2В, например Н2О. У атома кислорода валентными являются 2 неспаренных р-электрона. Два р-облака обычно располагаются в пространстве под углом 90о. Но в молекуле воды валентный угол 104°5¢ (рис. 5.5). Это объясняется полярностью связи О – Н, т. е. общее электронное облако оттянуто к более электроотрицательному атому О. На атомах водорода появляется положительный заряд и они начинают отталкиваться, увеличивая валентный угол. Объяснение этому явлению также можно дать пользуясь теорией гибридизации (см. дальше). Молекулы типа А2В имеют угловую форму. Так, элементы-аналоги кислорода образуют угловые молекулы, но так как связь Э – Н в этом ряду становится менее полярной, то и валентный угол приближается к 90° (см. рис. 5.6, а).
Молекулы типа А2В, например Н2О. У атома кислорода валентными являются 2 неспаренных р-электрона. Два р-облака обычно располагаются в пространстве под углом 90о. Но в молекуле воды валентный угол 104°5¢ (рис. 5.5). Это объясняется полярностью связи О – Н, т. е. общее электронное облако оттянуто к более электроотрицательному атому О. На атомах водорода появляется положительный заряд и они начинают отталкиваться, увеличивая валентный угол. Объяснение этому явлению также можно дать пользуясь теорией гибридизации (см. дальше). Молекулы типа А2В имеют угловую форму. Так, элементы-аналоги кислорода образуют угловые молекулы, но так как связь Э – Н в этом ряду становится менее полярной, то и валентный угол приближается к 90° (см. рис. 5.6, а).
Молекула Валентный угол, град.
Н2О 104,5
Н2S 92
Н2Se 91
Н2Te. 90.
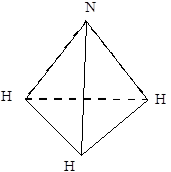
Молекулы типа А3В, например NH3, PH3. Связь в этих молекулах осуществляется тремя неспаренными р-электронными облаками, расположенными под углом 120° по трем координатным осям.
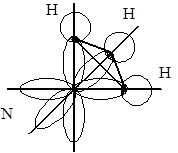
а б
Рис. 5.6
Форма молекулы – пирамида, построенная на треугольном основании. Но и как в случае с молекулой воды, вследствие полярности связи валентный угол отличается от 120° (рис. 5.6, б).
Сложнее происходит образование химической связи у элементов подгруппы бериллия, бора, углерода. Здесь участие в образовании связи принимают и s- и р-электроны. И хотя исходные электронные облака имеют различную форму и энергию, полученные в молекуле связи оказываются равноценными и по длине, и по энергии. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи? Ответ на этот вопрос дает теория гибридизации, разработанная Слейтером и Полингом.
5.3.5. Теория гибридизации
Согласно этой теории химическая связь образуется за счет перекрывания не чистых, а так называемых “гибридных”, смешанных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей изменяется и образуются новые орбитали одинаковой формы и энергии. Гибридное электронное облако асимметрично, имеет большую вытянутость по одну сторону от ядра, что приводит к большему перекрыванию и большей прочности связи. Гибридная орбиталь представлена на рис. 5.7.
|
Рис. 5.7 |
Таким образом, гибридизация связана с энергетическим выигрышем за счет:
а) образования более прочной связи,
б) более симметричного распределения электронной плотности внутри молекулы.
Число гибридных орбиталей всегда равно числу исходных орбиталей. Гибридные орбитали образуются только в случае, если исходные орбитали не очень сильно отличаются по энергии. Так 1s-орбитали не могут гибридизироваться с 2р, так как у них разное значение главного квантового числа, следовательно, большая разница в энергиях орбиталей.
Рассмотрим примеры гибридизации.
sр-гибридизация. Гибридизация 1s- и 1р- облака приводит к образованию двух sр (q2) гибридных облаков, расположенных под углом 180°. Поэтому молекулы с таким типом гибридизации линейные. sр-гибридизацию рассмотрим на примере молекулы ВеСl2 (рис. 5.8).
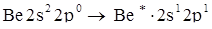 .
.
Для образования химической связи атом бериллия должен перейти в возбужденное состояние. Образующийся возбужденный атом имеет 2 неспаренных электрона sи р, образуются две гибридные орбитали. Атомы хлора дают для образования связи по р-электронному облаку.
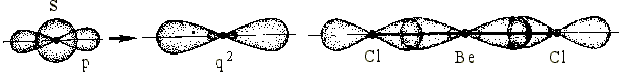
1s + 1p = q2
Рис. 5.8

1s + 2р = q3.
а б
Рис. 5.9
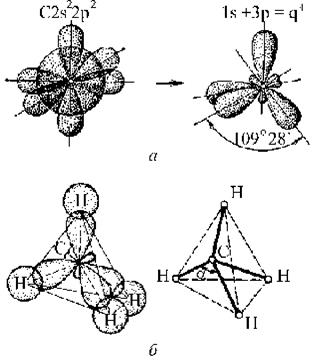
Рис. 5.10
sр2-гибридизация. 1s + 2р = q3. Рассмотрим этот тип гибридизации на примере молекулы ВСl3. Гибридные облака, их три, располагаются в пространстве под углом 120°, образуется плоская треугольная молекула (рис. 5.9).
sр3-гибридизация. Комбинация четырех орбиталей 1s + 3р = q4. Четыре гибридные орбитали располагаются в пространстве под углом 109°28¢ т. е, такие молекулы имеют тетраэдрическую форму (рис. 5.10).
5.3.6. Полярность и поляризуемость связи
Если двухатомная молекула состоит из одинаковых атомов, например Н2, Сl2, О2, то молекулярное облако, осуществляющее связь, равномерно, симметрично распределено между ядрами, такая молекула называется неполярной, или гомеополярной. Если же связь осуществляется между атомами разных элементов, то молекулярное облако обычно смещается к одному из атомов, возникает асимметрия в распределении зарядов, такая связь и молекула называется полярной, или гетерополярной.
Для оценки способности атома оттягивать на себя общее электронное облако пользуются величиной относительной электроотрицательности. Чем больше относительная электроотрицательность (ОЭО), тем сильнее атом притягивает к себе электронное облако. Это ведет к тому, что средняя плотность отрицательного электрического заряда оказывается выше, вблизи более электроотрицательного элемента, и ниже, вблизи менее электроотрицательного. В результате первый атом приобретает (–) заряд, а другой – (+). Эти заряды на атомах называют эффективными зарядами атомов в молекуле. Перераспределение электронной плотности внутри молекулы называется окисленностью элемента. Число электронных пар, принятых или отданных атомом, называют степенью окисления.
Так, в молекуле НСl электронная пара смещена в сторону более электроотрицательного Сl и у Сl появляется эффективный заряд, равный 0,17 заряда электрона, у Н такой же положительный заряд. Следовательно, молекула НСl является полярной молекулой. Ее можно рассматривать как систему из двух равных по величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями.
Ионная связь
Химическая связь, осуществляемая путем электростатического притяжения разноименно заряженных ионов, называется электровалентной или ионной связью. Соединения с такой связью называются гетерополярными, или ионными.
Ионную связь можно считать предельным случаем ковалентной связи, когда валентная пара электронов полностью оттягивается к более электроотрицательному атому, образующему отрицательный ион. Атом, теряющий электрон, превращается в (+) ион, например:
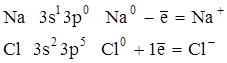
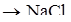
Ионных соединений не очень много. Ионная связь легко возникает при взаимодействии типичных металлов с низкой электроотрицательностью – Ме I и II группы и типичных неметаллов с высокой электроотрицательностью – элементы VI и VII групп. Эти два типа элементов резко отличаются по электроорицательности, разность ОЭО больше 2.
Таким образом, принципиального различия в механизме образования неполярной ковалентной, полярной ковалентной и ионной связей нет. Они отличаются лишь степенью отталкивания электронных пар. Химическая связь сочетает в себе единство ионной и ковалентной. Природа же любой связи едина, она имеет электрическое происхождение.
5.4.1. Отличительные особенности
ионных соединений от ковалентных
Ионная связь, в отличие от ковалентной, ненаправлена и ненасыщаема. Ионы можно представить в виде заряженных сфер, силовые поля которых равномерно распространяются в пространстве. Поэтому ион может притягивать к себе ион противоположного знака в любом направлении – отсюда ненаправленность связи. Взаимодействие друг с другом двух ионов не компенсирует силовые поля полностью, остается способность притягивать ионы в других направлениях – отсюда ненасыщаемость.
Ионные соединения обладают рядом отличительных особенностей.
1. Ионные соединения в твердом состоянии образуют кристаллы, в которых закономерно расположены в пространстве (+) и (–) ионы.
2. Ионные соединения обладают повышенной температурой кипения и плавления.
3. В расплавленном состоянии обладают электропроводностью (и в растворах тоже).
4. Хорошо растворяются в полярных растворителях, например, в воде.
Водородная связь
Водородная связь образуется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом (О, F, N, реже S, Сl и др.) другой молекулы. Водородная связь обозначается пунктирной линией. Этот вид связи осуществляется двумя парами электронов и протоном. Энергия водородной связи невелика 17–26 кДж/моль, но тем не менее эта связь играет очень важную роль, особенно в биохимии. В последние годы свойства водородной связи привлекают все возрастающее внимание.
Понятие о водородной связи было введено Верналом и Фаулером для объяснения сил, связывающих молекулы в жидкой воде. Предполагалось, что атомы водорода (протоны) молекулы воды взаимодействуют с неподеленной парой электронов кислорода так, что получается система:
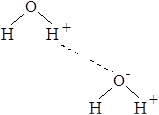 .
.
Несмотря на малую прочность водородной связи она определяет иногда структуру вещества и существенно влияет на его химические и физические свойства. Благодаря водородным связям молекулы объединяются в димеры, полимеры, циклы и более сложные ассоциаты.
Особенности свойств воды также определяются наличием водородной связи. Многие физические свойства веществ с водородной связью выпадают из общего хода изменения их в ряду аналогов. Так, летучесть ассоциированных жидкостей мала, а вязкость, теплота парообразования, температура кипения, аномально высоки:
Вещество Ткип, °С Вещество Ткип, °С
HCl –114,2 H2S –60,35
HBr –86,9 H2Se –41,4
HJ –50,8 H2Te –2



 HF. +20 . H2O . +100.
HF. +20 . H2O . +100.
Водородная связь может быть как межмолекулярной, так и внутримолекулярной. Водородная связь обладает свойствами ненаправленности и ненасыщенности.
Водородная связь очень распространена и встречается повсеместно – в воде, белках, полимерах, живых организмах и т. д. Такая ее универсальность связана с распространением в природе воды и соединений со связями О–Н. Большую роль она играет в биологических системах – упорядоченное расположение полипептидных цепей в структуре белка, двойные спирали нуклеиновой кислоты – все это благодаря водородной связи.
Металлическая связь
Металлические структуры обладают некоторыми очень характерными свойствами: очень высокие координационные числа 8, 12, высокая электро- и теплопроводность, металлический блеск, плотная упаковка, непрозрачность для всех видов радиоволн и др. В чем причина? Очевидно она связана с особенностями строения химической связи в металлах.
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов: у 16 Ме - по одному электрону, у 56 Ме - по два электрона, у 4 Ме - по три электрона. В то же время металлы на внешнем энергетическом уровне содержат большое число свободных орбиталей. Атомы в металле упакованы плотно, находятся близко друг от друга, это ведет к перекрыванию орбиталей внешнего уровня, созданию единой зоны проводимости, и валентные электроны из-за низкой энергии ионизации практически связаны не с отдельными ядрами, а делокализованы по всем атомам, утрачивают связь с отдельными атомами, легко обобществляются. Электроны в металле подвижны, легко перемещаются.
Таким образом, связь, образующаяся в результате электростатического притяжения между (+) ионами Ме и электронами, называется металлической и здесь природа связи электрическая.
Металлическая связь имеет некоторое сходство с ковалентной, она также основана на обобществлении валентных электронов. Но у ковалентной связь - двухэлектронная двухцентровая, а у металлов - многоэлектронная многоцентровая. Поэтому кристаллы с ковалентной связью хрупки, ломки, а металлы пластичны, так как возможно взаимное смещение ионов и электронов без нарушения связи.
Дата добавления: 2018-09-22; просмотров: 747; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

