МЕТАЛЛЫ. ОБЩАЯ ХАРАКТЕРИСТИКА
Общие сведения
Все ученые применяют термин – металлы. Это простые вещества, обладающие характерным металлическим блеском, прекрасной тепло- и электропроводностью, ковкостью и др. Наиболее характерным свойством металлов является способность их отдавать свои валентные электроны и превращаться в положительно заряженные ионы (катионы), т. е. в реакциях металлы проявляют восстановительные свойства.
В периодической системе Д. И. Менделеева на долю металлов приходится около 80 % всех элементов: все s-элементы, d- и f-элементы и часть р-элементов.
Резкой границы между металлами и неметаллами провести нельзя. Рассмотрим это на элементах IV периода. Начинается он с калия (4s1) – активного металла, легко отдающего свой единственный валентный электрон. Кальций (4s2) имеет на внешнем слое два валентных электрона, тоже активный металл. Далее по периоду слева направо растет число валентных электронов на внешнем энергетическом уровне d-элементов. Способность элементов к отдаче их уменьшаются, соответственно уменьшаются и восстановительные свойства металлов.
Однако, один и тот же элемент в разных степенях окисления может проявлять как свойства основные, так и кислотные. Например, хром (4s1 3d5) имеет степень окисления +2, +3, +6, образуя соответствующие соединения:
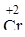 O O
| 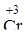 2O3 2O3
| 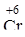 O3 O3
|
| Основные свойства | Амфотерные свойства | Кислотные свойства |
| Восстановительные свойства | Cr(OH)3 или | Окислительные свойства |
| Cr(OH)2 | H2CrO3 | H2CrO4 |
|
|
|
Следовательно, один и тот же элемент может проявлять свойства основные (в низшей степени окисления) и кислотные (в высшей степени окисления), т. е. резкой грани между металлами и неметаллами провести нельзя.
После d-элементов в IV периоде начинаются р-элементы (Ga, Ge, As), обладающие полупроводниковыми свойствами. Заканчивается период типичными неметаллами бромом и криптоном.
Классификация металлов
Единой классификации металлов нет. Чаще всего их классифицируют по какому-либо характерному признаку:
1. По плотности металлы подразделяются на легкие (плотность < 5 г/см3) и тяжелые (плотность > 5 г/см3).
Примером самого легкого металла может служить литий, его плотность равна 0,53 г/см3, самого тяжелого – осмий, его плотность равна 22,48 г/см3.
2. По температурам плавления металлы делят на легкоплавкие, имеющие температуру плавления менее 800 °С (например, температура плавления калия – 63,6 °С, цинка – 419 °С), и тугоплавкие, которые имеют температуру плавления выше 800 °С (например, температура плавления хрома 1850 °С, марганца – 1247 °С).
Это деление условное, очень зависит от степени чистоты металла. Чем он более чист, чем меньше содержит примесей, тем выше у него температура плавления.
|
|
|
Принято классифицировать металлы по положению их в периодической таблице Д. И. Менделеева:
1. Щелочные металлы (s-элементы I группы).
2. Щелочно-земельные металлы (s-элементы II группы).
3. Благородные металлы (d-элементы VIII группы Ru, Rh, Pd, Pt, Ir, Os, а также золото и серебро).
4. Редкоземельные металлы (лантаноиды, актиноиды, ванадий, молибден).
5. Цветные металлы, т. е. металлы, которые сами или их соединения имеют характерную окраску (медь, висмут и др.).
6. Черные металлы – железо и его сплавы.
Дата добавления: 2018-09-22; просмотров: 511; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
