Нахождение металлов в природе
В природе металлы находятся, как правило, в виде различных соединений (солей, оксидов, гидроксидов), но встречаются и в самородном состоянии (золото, платина). Встречаются руды сульфидные, карбонатные, оксидные и др., содержащие соответствующее соединение металла или, чаще, их смесь.
Например, встречаются следующие минералы:
Оксиды: TiO2 – рутил, Fe2O3 ·2H2O – железняк, Al2O3∙ 2H2O – бокситы.
Сульфиды: Fe2S – железный колчедан, ZnS – сфалерит, PbS – галенит.
Сульфаты: CaSO4 ·2H2O – гипс (строительный материал).
Карбонаты: CaCO3·Mg CO3 – доломит.
Физические свойства металлов
Все металлы, за исключением ртути, – твердые кристаллические вещества с характерным металлическим блеском. Металлы обладают различной твердостью: одни металлы очень мягкие и легко режутся ножом (натрий, калий), другие - очень твердые и приближаются по твердости к алмазу (хром).
Металлы хорошо проводят тепло, электричество, они упруги, пластичны. Все эти свойства металлов объясняются наличием определенного строения их кристаллических решеток, наличием обобществленных валентных электронов, осуществляющих прочную (металлическую связь) в металлических решетках.
Наличие свободных электронов во всех металлических структурах обуславливает существование общих свойств металлов и объясняет их.
1. Электропроводность. Поскольку обобществленные валентные электроны не связаны с определенными катионами, то под действием уже небольшой разности потенциалов электроны начинают перемещаться от + к – , поэтому возникает электрический ток.
|
|
|
С увеличением температуры электропроводность уменьшается, так как с повышением температуры возрастает амплитуда колебаний катионов, что затрудняет перемещение электронов между ними. С уменьшением температуры электропроводность резко возрастает (сверхпроводимость при абсолютном нуле).
2. Теплопроводность металлов высокая, что объясняется наличием свободных электронов (аналогично электропроводности).
3. Прекрасная ковкость (пластичность) металлов объясняется легкостью скольжения одних слоев катионов относительно других. Вместе с ними перераспределяются и связывающие их электроны, поэтому разрыва металлической связи не происходит. Если взять неметалл, например серу кристаллическую, ударить ее молотком, то кристалл будет крошиться на мелкие кусочки, так как в сере электроны закреплены за конкретными атомами и если произойдет их сдвиг, то получается разрыв связи (ковалентной).
На пластичность металлов большое влияние оказывают примеси, которые уменьшают свободу перемещения электронов и уменьшают пластичность.
|
|
|
4. Температура кипения и температура плавления зависят от структуры металла. Чем прочнее металлическая решетка (металлическая связь), тем прочнее металл, выше температура кипения и плавления.
Химические свойства металлов
7.5.1. Восстановительные свойства металлов
В химических реакциях металлы в большинстве случаев являются восстановителями, т. е. отдают свои валентные электроны. Но по своей восстановительной способности металлы различны.
А. Щелочные металлы являются самыми сильными восстановителями, они легко отдают свой единственный валентный электрон.
Б. Благородные металлы очень трудно отдают свои электроны, их восстановительная способность очень мала и очень низка химическая активность. Их ионы легко присоединяют к себе электроны от более активных металлов, т. е. являются окислителями.
В. Остальные металлы по восстановительной способности лежат между вышеуказанными группами металлов.
7.5.2. Взаимодействие металлов с водой
Щелочные металлы легко взаимодействуют с водой при обычных условиях, вытесняя водород из Н2О:
Li + 2Н2О = 2LiOН + H2,
Li0 - 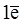 ® Li+ – восстановитель Li,
® Li+ – восстановитель Li,
2H+ + 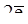 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Щелочно-земельные металлы менее химически активны и взаимодействуют с водой при нагревании, при повышенном давлении.
|
|
|
Остальные металлы с водой практически не взаимодействуют.
7.5.3. Взаимодействие металлов с кислотами
Характер взаимодействия металлов с кислотами зависит от следующих факторов:
1. От типа кислоты.
2. От концентрации кислоты.
3. От активности металла.
Взаимодействие металлов с бескислородными кислотами
При действии бескислородных кислот (HCl, HF, H2S, HBr), независимо от концентрации, происходит образование соли данного металла и выделение водорода. Ионы водорода выступают в качестве окислителя:
Mg + 2HCl = MgCl2 + H2,
Mg0 - 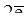 ® Mg+2 – восстановитель Mg0,
® Mg+2 – восстановитель Mg0,
2H+ + 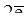 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Взаимодействие металлов c серной кислотой
А. Разбавленная серная кислота. Происходит образование соли металла и выделяется водород. В качестве окислителя в разбавленной серной кислоте выступают ионы водорода:
Fe + H2SO4(разб.) = Fe SO4 + H2,
Fe - 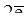 ® Fe+2 – восстановитель Fe0,
® Fe+2 – восстановитель Fe0,
2H+ + 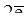 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Б. Концентрированная серная кислота. Происходит образование соли данного металла, воды и выделяется газообразный диоксид серы SO2. В качестве окислителя выступают ионы кислотного остатка SO42- (S+6):
|
|
|
Cu + 2 H2SO4 = CuSO4 + H2O + SO2,
Cu0 - 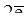 ® Cu+2 – восстановитель Cu,
® Cu+2 – восстановитель Cu,
S+6 + 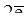 = S+4 – окислитель S+6.
= S+4 – окислитель S+6.
Взаимодействие металлов с азотной кислотой
Происходит образование соли данного металла, воды, а также одного из соединений: NH3, NH4NO3, N2O, NO, N2. Это зависит от концентрации кислоты и активности металла:
4Mg + 10HN+5O3(разб.) = 4Mg(NO3)2 + N-3H4NO3 + 3H2O,
Mg0 - 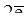 ® Mg+2 – восстановитель Mg0,
® Mg+2 – восстановитель Mg0,
N+5 + 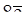 ® N-3 – окислитель N+5.
® N-3 – окислитель N+5.
Концентрированная азотная кислота. Происходит образование соли данного металла, воды и выделяется газообразный диоксид азота NO2:
Ag + 2HNO3(конц.) = Ag+NO3 + H2O + NO2,
Ag0 - 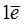 ®Ag+ – восстановитель Ag0,
®Ag+ – восстановитель Ag0,
N+5 + 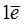 ® N+4 – окислитель N+5.
® N+4 – окислитель N+5.
Концентрированная азотная кислота и концентрированная серная кислота пассивируют при комнатной температуре железо, хром, алюминий и другие малоактивные металлы (за исключением меди). При этом на поверхности металла образуется защитная пленка, препятствующая его дальнейшему разрушению.
Взаимодействие металлов со щелочами
Со щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых обладают амфотерными свойствами. Происходит образование комплексной соли металла и выделяется газообразный водород из щелочи:
2NaOH + Zn0 + 2H2O = Na2[Zn+2(OH)4] + H20,
или
2NaOH + Zn0 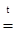 Na2ZnO2 + H20,
Na2ZnO2 + H20,
Zn0 - 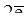 ® Zn+2,
® Zn+2,
2H+ + 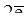 ® H20.
® H20.
7.5.4. Взаимодействие металлов с неметаллами
В результате возможно образование следующих типов соединений:
MexOy – оксиды. Все металлы, за исключением благородных, непосредственно соединяются с кислородом (при различных температурах).
MexCy – карбиды. Их получают нагреванием порошкообразных металлов с углеродом или парами углеводородов. Карбиды имеют очень высокую температуру плавления и большую твердость (8-9 ед.). Самую высокую твердость, равную 10 ед., имеет алмаз.
MexNy – нитриды. Образуются при нагревании металлов с азотом или аммиаком, обладают высокой твердостью, высокими температурами плавления, проявляют огнеупорные свойства.
MexHy – гидриды. Получаются при нагревании металлов с водородом. Гидриды металлов III группы имеют полимерную структуру. Гидриды d-металлов имеют нестехиометрический состав (гидриды внедрения).
Возможно образование и других соединений металлов с другими неметаллами.
Получение металлов из руд
Различные виды встречающегося в природе минерального сырья, пригодного для получения металлов в промышленном масштабе, называются рудами.
В основе всех методов выделения металлов из руд лежит восстановление их по схеме:
Me+n + 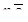 ® Me0,
® Me0,
где n – валентность металла.
В качестве восстановителя применяют графит, оксид углерода СО, водород, активные металлы, электрический ток и др.
7.6.1. Способы получения металлов
Существуют следующие способы получения металлов из руд.
1. Пирометаллургические:
а) карботермический;
б) металлотермический.
2. Электрометаллургические.
3. Гидрометаллургические.
1. Пирометаллургический способ заключается в применении высоких температур в процессе восстановления металла.
Карботермический способ – восстановление оксидов металлов углеродом или оксидом углерода СО при высоких температурах:
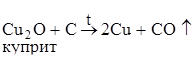 .
.
В доменных печах в качестве восстановителя применяют оксид углерода (II)СО:
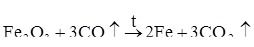 .
.
Металлотермический – в качестве восстановителей применяют более активные металлы при высоких температурах (Al, Mg, Ca и др.). Этим методом получают титан, уран, ванадий:
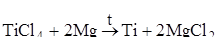 .
.
Если в качестве восстановителя применяют алюминий, то этот метод получил название алюмотермии:
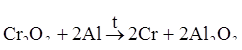 .
.
Электрометаллургия – технология, основанная на применении электрической энергии для восстановления металлов.
Такие активные металлы, как K, Na, Са, Mg, Al и др., получают электролизом расплавов их соединений. Например, при электролизе расплава хлорида натрия получают металлический натрий и газообразный хлор. Расплав соли NaCl, анод С (графит):
(-) К Na+ + 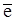 ® Na0, восстановление,
® Na0, восстановление,
(+) А 2Cl- - 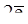 ® Cl2, окисление.
® Cl2, окисление.
Гидрометаллургия – технология, осуществляющая получение металлов из руд с помощью водных растворов специальных реагентов (кислот, щелочей, солей), которые переводят металлы из нерастворимого в руде состояния в водорастворимое. Далее металл из водных растворов выделяют либо восстановлением его более активным металлом, либо электролизом (если металл неактивный), либо экстракцией органическими соединениями.
Например, рассмотрим получение меди:
CuO¯ (т) + H2SO4(ж) = CuSO4(ж) + H2O(ж).
Из полученного раствора медь можно выделить восстановлением железом:
CuSO4 + Fe = Cu + FeSO4.
7.6.2. Получение металлов высокой степени чистоты
С повышением чистоты металлов значительно улучшаются их характеристики. Они становятся более пластичными, тепло- и электропроводными, труднее подвергаются коррозии и т. д.
Получение металлов высокой чистоты представляет собой очень сложную задачу, решенную далеко не для всех металлов. Существует ряд методов очистки, рассмотрим некоторые из них.
1. Вакуумная плавка – металл расплавляют в вакууме, что позволяет избавиться от ряда легколетучих и легкоплавких примесей различных металлов, неметаллов, газов.
Этот метод дает не очень большую степень чистоты металлов.
2. Термическое разложение йодидов металлов.
Метод применяют для очистки очень тугоплавких металлов, образующих летучие соединения с йодом, таких, как цирконий, титан, хром и др. Очищаемый металл помещают в тигель и добавляют йод. При нагревании происходит взаимодействие металла с йодом. При этом образуется летучий йодид металла (например, TiJ4). Под действием высокой температуры он разлагается по уравнению
TiJ4 ® Ti + 2J2.
В реакции выделяется чистый металл, а йод улавливается и снова возвращается в процесс.
Данный метод позволяет селективно выделять отдельные металлы из их смесей, получать металлы достаточно высокой степени чистоты.
3. Зонная плавка. Метод позволяет получать металлы очень высокой степени чистоты.
Слиток металла в виде стержня, помещенного в тигель, передвигают с малой скоростью (5-10 мм/ч) через электропечь. При этом расплавляется очень небольшой участок слитка, находящийся в зоне нагрева в данный момент. По мере передвижения тигля со слитком расплавленная зона перемещается от одного конца слитка к другому.
Процесс очистки основан на том, что растворимость примесей в жидкой фазе значительно выше, чем в твердой. При медленном перемещении слитка, а следовательно, зоны расплава вдоль слитка, примеси извлекаются расплавленной зоной и перемещаются в конец слитка.
При многократном повторении описанного процесса получают металл высокой степени чистоты. Примеси, собравшиеся в одном конце слитка, отрезают и подвергают дальнейшей очистке.
Вопросы для самоподготовки
Каковы особенности электронной структуры металлов?
К каким электронным семействам элементов они относятся?
Как изменяются металлические свойства элементов по периодам и группам?
Предскажите возможные степени окисления металлов, исходя из положения их в таблице Д. И. Менделеева.
Какие металлы входят в восьмерку самых распространенных химических элементов?
В каком виде встречаются металлы в природе?
Какие вы знаете способы получения металлов?
Как связать уникальные физические свойства металлов с их электронной структурой?
Из каких процессов складывается химическое поведение металлов?
В чем особенности взаимодействия металлов с кислотами-окислителями типа азотной и серной?
Дата добавления: 2018-09-22; просмотров: 2002; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
