Концентрационный гальванический элемент
Необходимую для работы гальванического элемента разность потенциалов можно создать, используя один и тот же раствор разной концентрации и электроды из одного металла. В этом случае элемент называется концентрационным и работает за счет выравнивания концентрации растворов. Такие элементы находят применение при измерении концентрации ионов в растворе. Примером концентрационного элемента может служить элемент, составленный из двух водородных электродов:
Pt, H2 /H2SO4 ½½H2SO4/ H2, Pt.
CH+ С¢¢Н+
Если СН+ < C¢¢H+, то Еэ = 0,059 lg С¢¢Н+/СН+.
При СН+ = 1 моль/л электродвижущая сила элемента будет определяться концентрацией водородных ионов во втором растворе, т. е.
Еэ = 0,059 lg C¢¢H+ = –0,059 pH.
Поляризационные явления в гальванических элементах
Равновесные потенциалы электродов могут быть определены при отсутствии в цепи тока. При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией. Различают катодную и анодную поляризации. Изменение потенциала при прохождении тока называют перенапряжением. Этот термин относят к некоторым конкретным процессам, например, к катодному выделению водорода (водородное перенапряжение).
Смещение величины потенциала электрода от исходного равновесного значения, вызванное изменением концентрации потенциалопределяющих ионов в растворе, называется концентрационной поляризацией.
|
|
|
В случае, когда поляризация вызывается изменением химической природы электрода, ее называют химической. Так, медный электрод в элементе Вольта инертный и на границе с раствором серной кислоты, насыщаясь водородом, образует “водородный” электрод, потенциал которого ниже потенциала медного электрода. Поэтому Еэ элемента Вольта непрерывно падает.
Процесс устранения поляризации называется деполяризацией. Концентрационную поляризацию в значительной мере можно уменьшить перемешиванием раствора. Химическую поляризацию можно снизить введением специальных веществ (деполяризаторов), вступающих в реакцию с продуктами, обуславливающими поляризацию.
Электролиз
9.6.1. Общая часть
Электролизом называется окислительно-восстановительный процесс, происходящий на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза называется электролизером, она состоит из двух электродов и электролита (раствор или расплав). Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока.
|
|
|
На характер и течение электродных процессов большое влияние оказывают состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и др.)
9.6.2. Напряжение разложения. Явления перенапряжения
Процессы электролиза обратны процессам работы соответствующих гальванических элементов и при обратимом процессе термодинамические характеристики их должны совпадать. Однако на практике процесс электролиза сопровождается побочными явлениями, делающими его не вполне обратимым.
Общее напряжение, которое необходимо приложить к электролитической ячейке, чтобы начался процесс электролиза, называют напряжением разложения – Еразл.. При обратимом процессе напряжение разложения равно электродвижущей силе Еэ гальванического элемента, но на практике оно оказывается большим. Так, при электролизе водных растворов серной, азотной, фосфорной кислот и гидроксидов натрия и калия происходит разложение воды и напряжение разложения всех этих электролитов близко к 1,7 В. Казалось бы оно должно соответствовать Еэ цепи Pt, /кислота/ O2, Pt, но для этой цепи Еэ = 1,07 В. Это явление называется перенапряжением при электролизе – h.
|
|
|
Еразл. = Еэ + h.
Катодное перенапряжение – это дополнительное напряжение, прикладываемое к катоду, чтобы сместить его потенциал в отрицательную сторону, а анодное – к аноду, чтобы сместить потенциал в положительную сторону.
Увеличение напряжения по сравнению с Еэ приводит к перерасходу электрической энергии. Напряжение может быть снижено уменьшением сопротивления электродов и электролита, а также поляризации электродов. Внутреннее сопротивление электролизера можно снизить применением электролита с высокой удельной электрической проводимостью, повышением температуры и уменьшением расстояния между электродами. Поляризация может быть понижена увеличением поверхности электродов, температуры, концентрации реагента, перемешиванием, а также уменьшением тока и применением электродов-катализаторов.
Иногда поляризация при электролизе играет положительную роль. Так, вследствие поляризации (перенапряжения) водорода удается осадить на катоде в водных растворах некоторые металлы, имеющие отрицательный потенциал.
|
|
|
9.6.3. Последовательность электродных процессов
При электролизе расплавов электролитов в электролите находятся лишь один вид катионов и один вид анионов, поэтому схема электролиза проста. Однако часто в электролите присутствуют несколько видов катионов и анионов и недиссоциированных молекул, поэтому возможно протекание нескольких электродных реакций.
Катодные процессы. Так как на катоде идет реакция восстановления, т. е. прием электронов окислителем, то в первую очередь должны реагировать наиболее сильные окислители. На катоде прежде всего протекает реакция с наиболее положительным потенциалом. Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы.
1. Ионы металлов, потенциал которых более отрицателен, чем потенциал водородного электрода. К ним относятся ионы металлов, стоящих в ряду напряжений до алюминия включительно. В водных растворах разряд этих ионов на катоде практически не происходит, вместо них выделяется водород: 2Н2О + 2е = Н2 + 2ОН- (2Н+ + 2е = Н2). Металлы могут быть получены электролизом из расплавленных солей, в которых ионы Н+ отсутствуют.
2. Катионы металлов, потенциал которых более положителен, чем потенциал водородного электрода. Они находятся в ряду напряжений после водорода и при электролизе практически полностью восстанавливаются на катоде: Men+ + ne = Me0.
3. Ионы металлов, потенциал которых относительно мало отличается от потенциала водородного электрода. К ним относятся ионы металлов, находящихся в ряду напряжений между алюминием и водородом. При электролизе на катоде они восстанавливаются одновременно с молекулами воды.
Анодные процессы. На аноде протекают реакции окисления восстановителей, т. е. отдача электронов. Поэтому на аноде в первую очередь окисляются вещества, имеющие наиболее отрицательный потенциал.
Характер реакций на аноде зависит также и от материала электрода. Различают нерастворимые и растворимые аноды.
Нерастворимые аноды изготавливают из угля, графита, платины. При электролизе нерастворимые аноды сами не посылают электроны во внешнюю цепь, электроны посылаются в результате окисления анионов и молекул воды. При этом аноны бескислородных кислот при их достаточной концентрации окисляются довольно легко (2Cl- – 2e = Cl2). Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, PO43– и др.) то на аноде окисляются не эти ионы, а молекулы воды:
2Н2О – 4е = О2 + 4Н+.
Растворимые аноды. Электроны во внешнюю цепь посылает сам анод, а не анионы раствора. Растворимые аноды изготавливаются из меди, серебра, цинка, никеля и др. металлов. При электролизе с растворимым анодом идет анодное окисление атомов металла: Me0 – ne = Men+. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например никель и железо в щелочном растворителе, свинец в серной кислоте. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
9.6.4. Примеры электролиза
1. Электролиз расплава хлорида натрия: NaCl ® Na+ + Cl-:
на катоде Na+ + e = Na0,
на аноде 2Cl- – 2 e = 2Cl0, 2Cl0 ® Cl2,
2NaCl ® 2Na + Cl2.
(расплав)
2. Электролиз раствора хлорида натрия:
NaCl ® Na+ + Cl-, H2O Û H+ + OH-:
на катоде 2H2O + 2e = H20 + 2OH-,
на аноде 2Cl- – 2e = 2Cl0; 2Cl0 ® Cl20,
в растворе:
Na+ + OH- = NaOH,
2H2O + 2NaCl ® Cl2 + H2 + 2NaOH.
(раствор)
3. Электролиз воды в различных средах:
2Н2О = 2Н2 + О2:
а) в нейтральном растворе (электролит Na2SO4):
на катоде 2Н2О + 2е = Н2 + 2ОН-,
на аноде 2Н2О – 4е = О2 + 4Н+,
в растворе ОН- + Н+ = Н2О;
б) в кислом растворе (электролит H2SO4):
на катоде 2Н+ + 2е = Н2,
на аноде 2Н2О – 4е = О2 + 4Н+;
в) в щелочном растворе (электролит NaOH):
на катоде 2Н2О + 2е = Н2 + 2ОН-,
на аноде 4ОН- – 4е = О2 + 2Н2О.
4. Электролиз сульфата никеля с растворимым никелевым анодом:
на катоде Ni2+ + 2e = Ni0, 2Н2О + 2е = Н2 + 2ОН–;
на аноде Ni0 – 2e = Ni2+.
В данном случае процесс сводится к анодному окислению никеля и катодному восстановлению его ионов, т. е. переносу никеля с анода на катод.
9.6.5. Законы электролиза Фарадея
В 1883 г. английский ученый М. Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химическое превращение на электроде.
1-й закон Фарадея. Количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества.
2-й закон Фарадея. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как эквивалентные массы.
При превращении 1 моля эквивалентов вещества на электроде через него проходит 96484 или, округленно, 96500 Кл (А,с). Эта величина называется постоянной Фарадея, F. Из законов Фарадея вытекает уравнение:
m = 
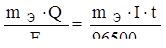 ,
,
где m – масса окисленного или восстановленного вещества, г; mэ – моль эквивалента вещества; Q – количество кулонов электричества, прошедшего через электролит (Q = I×t, где I – сила тока в амперах, t – продолжительность электролиза, с).
mэ / 96500 = Е. Величина Е называется электрохимическим эквивалентом вещества и характеризует массу вещества, выделившегося на электродах при прохождении через электролит 1 Кл электричества.
При практическом проведении электролиза действительно расход тока вследствие протекания побочных процессов обычно превышает количество его, рассчитанное по закону Фарадея. Закон был уточнен добавлением коэффициента выхода по току. Коэффициент выхода по току всегда меньше единицы. Формула уточненного закона Фарадея:
h = mфакт / mтеор.
9.6.6. Практическое применение электролиза
Электролиз широко используется в различных отраслях промышленности. Остановимся на некоторых наиболее распространенных.
Электролиз в металлургии. Электролизом растворов солей получают медь, цинк, кадмий, кобальт, марганец и другие металлы. На катоде происходит разряд ионов металла из раствора – Men+ + ne = Me. В этих процессах используют нерастворимые аноды, на которых обычно выделяется водород.
Метод электролиза используется также для рафинирования (очистки) металлов от примесей – меди, серебра, олова, свинца и др. Электролиз ведут с растворимым анодом. Изготавливают анод из чернового, неочищенного металла, он растворяется, а на катоде восстанавливаются ионы этого металла в чистом виде.
Электролизом расплавов соединений получают алюминий, магний, натрий, литий, бериллий, кальций, а также сплавы некоторых металлов.
Электролиз в химической промышленности. К наиболее крупному электролитическому процессу в промышленности относится электролиз раствора хлорида натрия с получением газообразных хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве. Кроме того, электролизом получают фтор из расплава смеси HF и NaF, водород и кислород из воды, диоксид марганца из раствора сульфата марганца, окислители: пероксид водорода, перманганат калия, гипохлорид, хлораты, хроматы и т. п., некоторые органические вещества, например, анилин из нитробензола.
Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия всеми металлами и сплавами, которые могут выделяться на катоде. Толщина покрытия в зависимости от назначения составляет 1–100 мкм.
Гальванические покрытия широко применяются во многих областях техники и имеют различные назначения: а) защита от коррозии – цинкование, кадмирование, лужение и др.; б) защита от коррозии и придание красивого внешнего вида – никелирование, хромирование, серебрение, золочение; в) повышение электрической проводимости – меднение, серебрение, золочение; г) повышение твердости и износостойкости – хромирование, родирование, палладирование; д) получение магнитных пленок – осаждение сплавов никель-кобальт и железо-никель; е) улучшение отражательной способности поверхности – серебрение, родирование, палладирование, хромирование; ж) улучшение способности к пайке – лужение, осаждение сплава олово-свинец; з) уменьшение коэффициента трения – свинцевание, хромирование, осаждение сплава олово-свинец, индий-свинец и др.
Нанесение гальванических покрытий проводится в гальванической ванне. Катодом служит изделие, на которое наносится покрытие. На катоде идет восстановление ионов металла – электроосаждение металла: Men+ + ne = Me. Анодом обычно служит такой же металл, что и металл покрытия и на нем идет окисление: Me – ne = Men+. Содержание ионов металла в растворе остается постоянным, так как расход ионов на катоде компенсируется поступлением их с анода.
Электрохимическая обработка металлов и сплавов. Для изменения размеров и формы, а также состояния поверхности металлических изделий используют электрохимические методы обработки, при которых производится электроокисление металлических изделий: электрохимическая размерная обработка, анодирование и др.
Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов (ЭХОМ). Этот способ обработки металлов позволяет обрабатывать детали сложной конфигурации и металлы, которые механически не могут быть обработаны или обрабатываются с большим трудом. Кроме того, инструмент при этом не изнашивается, а обработка не влечет изменения структуры металла.
Как при обычном электролизе с растворимым анодом, при ЭХОМ происходит анодное растворение металла, а на катоде, который при электрохимической обработке называют инструментом, обычно выделяется водород:
2Н+ + 2е = Н2.
Анодное оксидирование (анодирование) широко применяется для обработки металлов – алюминия, магния, меди, титана и др. На катоде выделяется водород, а на аноде происходит образование оксида металла.
Электрохимическое восстановление. При электролизе на катоде образуется атомарный водород, который служит для гидрирования находящихся в растворе органических и неорганических веществ, являющихся в таких процессах катодными деполяризаторами.
Вопросы для самоподготовки
Что изучает наука электрохимия?
Как устроена металлическая кристаллическая решетка?
Какие процессы происходят на границе металла с раствором при погружении металла в воду или раствор его соли?
Что такое электродный потенциал, от каких факторов он зависит?
Уравнение Нернста.
Можно ли определить абсолютную величину электродного потенциала?
Какой электрод принят за электрод сравнения?
Что такое стандартный (нормальный) потенциал?
Как составлен ряд напряжений металлов? Как положение металла в ряду напряжений позволяет определить его свойства?
Что такое гальванический элемент? Для чего он используется? Как работает? Какие реакции протекают на его электродах?
Сущность процессов, происходящих при электролизе.
Каков порядок разряда ионов на катоде, аноде?
Что такое электролиз с растворимым (активным) анодом? Как надо устроить электролиз для получения металла, его очистки (рафинирования)?
Практическое применение электролиза.
Коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлических материалов вследствие их химического или электрохимического взаимодействия с окружающей средой.
Потери от коррозии металлов складываются из стоимости изготовления металлических конструкций, пришедших в негодность вследствие коррозии, потери металлов и косвенных убытков – ремонта, простоя оборудования, порчи продукции и т. д.
Классификация видов коррозии
По механизму коррозии различают химическую и электрохимическую коррозию.
Химическая коррозия – взаимодействие металла с окружающей средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают при непосредственном взаимодействии металла и окислителя в одном акте. Примерами химической коррозии являются окисление металлов воздухом или продуктами горения топлива, обычно при высокой температуре; под действием агрессивных газов – хлора, диоксида серы и др., а также под действием жидких неэлектролитов – нефти, бензина и др.
2Zn + O2 ® 2ZnO; 2Fe + 3Cl2 ® 2FeCl3.
Электрохимическая коррозия – разрушение металла в среде электролита с образованием электрического тока, при этом, наряду с химическими процессами (окисление металла и восстановление окислителя), протекают и электрические – перенос электронов от одного участка к другому. Этот тип коррозии наиболее распространен и имеет место при контакте металлов с жидкими электролитами – водой, растворами солей, кислот, щелочей, расплавами солей и щелочей. Примерами электрохимической коррозии являются ржавление металлических изделий и конструкций во влажной атмосфере (станков, мостов, каркасов, средств транспорта и т. д., коррозия обшивки судов в морской воде, трубопроводов в земляном грунте, коррозия аппаратов на химических заводах и т. д.).
По условиям протекания коррозии различают:
Газовую коррозию – коррозию металлов в газах при высоких температурах, например, окисление и обезуглероживание стали при нагревании (сварке).
Атмосферную коррозию – коррозию металлов в атмосфере воздуха или влажного газа, например, ржавление конструкций на воздухе.
Жидкостную коррозию – коррозию металлов в жидкой среде – электролите (кислотная, солевая, морская коррозия и др.) или неэлектролите (бром, органический растворитель, жидкое топливо).
Подземную коррозию – ржавление подземных трубопроводов.
Коррозию при одновременном воздействии внешнего тока, механических напряжений, кавитации, трения и т. д.
По характеру коррозионного разрушения различают:
Сплошную коррозию – если коррозия охватывает всю поверхность металла. Такая коррозия может быть равномерной и неравномерной. Примером равномерной коррозии является растворение металлов в кислотах или щелочах.
При структурно-избирательной коррозии происходит преимущественное разрушение одной из структур сплава, например, в стали или чугуне.
При местной, или локальной, коррозии на поверхности металла обнаруживают поражения в виде пятен, не сильно углубленных в толщу металла (коррозия латуни в морской воде), язв – поражений, сильно углубленных в толщу металла (коррозия стали в грунте), точек (питтингов), иногда почти незаметных, но глубоко проникающих в металл (коррозия стали в морской воде). Коррозия в виде язв и точек очень опасна, так как при небольших потерях металла изделие может выйти из строя. Это особенно опасно для конструкций, где важно поддерживать герметичность (трубопроводы, реакторы и аппараты химических заводов, обшивка судов).
Химическая коррозия металлов
Причиной химической коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях, т. е. возможность самопроизвольного перехода металлов в более устойчивое окисленное (ионное) состояние с соответствующим уменьшением энергии Гиббса системы (DG < 0).
Наиболее распространенный вид химической коррозии – взаимодействие металла с кислородом с образованием слоя оксидов по реакции
Ме + 1/2О2 ® МеО.
Скорость газовой коррозии зависит от природы металла, состава сплава, свойств продуктов коррозии, температуры и др. факторов. При взаимодействии металла с кислородом, продуктами коррозии являются оксидные пленки разной толщины, от свойств которых зависит дальнейший процесс коррозии. Тормозить коррозию могут только пленки, обладающие защитными свойствами – сплошные, непористые, твердые, с высокой адгезией (прилипанием) к металлу, с коэффициентом термического расширения, близким к коэффициенту для металла, обладающие твердостью, износостойкостью. В обычных условиях покрыты защитной пленкой алюминий, титан, хром, тантал, никель, свинец, олово, бериллий, цинк.
Скорость газовой коррозии резко повышается с возрастанием температуры. Так, при нагревании железа, стали и чугуна они окисляются с образованием окалины, имеющей сложное строение. Оксид железа (III) образуется до t = 100 °С, а Fe3O4 при t = 400–575 °С. Эти оксиды имеют кристаллические решетки сложного строения, и диффузия кислорода в них затруднена. При более высокой температуре образуется FeO, имеющая структуру с дефектами, и FeO не обладает защитными свойствами. Поэтому применять углеродистые стали можно только до 575 °С.
Коррозия металлов в растворах неэлектролитов
Коррозия металлов в растворах неэлектролитов протекает с меньшей скоростью, чем в растворах электролитов, но при этом происходит значительное разрушение металлических конструкций, особенно при нагревании. При коррозии нефтью процесс ускоряется содержащимися в нефти соединениями серы – сероводородом, меркаптанами с образованием сульфидов и меркаптидов. Сталь может корродировать при соприкосновении с бензинами, так как углеводороды бензинов под действием кислорода воздуха окисляются с образованием органических кислот. Жидкий бром и расплавленная сера весьма активны и разрушают многие металлы. Попадание в неэлектролиты воды часто значительно активирует коррозию в неэлектролитах вследствие протекания электрохимической коррозии металла.
Электрохимическая коррозия
Электрохимическая коррозия металла напоминает работу гальванического элемента, в котором отрицательный электрод, например цинк, растворяется, когда он соединен проводником со вторым электродом, на котором восстанавливаются ионы водорода или другого вещества, и поэтому ее можно рассматривать как результат работы большого числа коррозионных гальванических элементов на корродирующей поверхности металла, соприкасающегося с электролитом. В первом приближении неоднородную поверхность металла можно рассматривать как двухэлектродную систему, состоящую из участков двух видов – анодных с более отрицательным электродным потенциалом и катодных - с более положительным электродным потенциалом.
Причины возникновения катодных и анодных участков разнообразны и связаны с микро- и макровключениями, наличием примесей на поверхности металла, микро- и макропорами, неоднородностью сплавов, неоднородностью поверхности металла, наличием продуктов коррозии, различием в концентрации солей, ионов и растворенного кислорода на разных участках поверхности и т. д. При этом анодами обычно являются частицы металла, катодами – примеси. Аноды растворяются, на катодах происходит связывание электронов.
Электрохимическая коррозия металлов состоит из трех основных процессов:
1) анодный процесс – растворение металла и образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках:
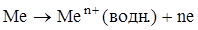 ;
;
2) процесс перетекания электронов от анодных участков к катодным и перемещение катионов и анионов в растворе;
3) катодный процесс – восстановление ионов и молекул среды:
а) кислая среда – восстановление ионов водорода, коррозия с водородной деполяризацией:
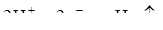
б) щелочная и нейтральная среда – восстановление кислорода, растворенного в воде, коррозия с кислородной деполяризацией. Металл катода при этом не разрушается

Дата добавления: 2018-09-22; просмотров: 665; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
