Необратимые и обратимые реакции
Реакции, которые протекают только в одном направлении и завершаются полным превращением реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO3 = 2KCl + 3O2 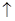 .
.
Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака:
3H2 + N2 Û 2NH3; ΔH = -46,2 кДж/моль.
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называют такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции – выпадают в виде осадков, выделяются в виде газа, например:
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl,
Na2CO3 + 2HCl ® 2 NaCl + CO2 + H2O;
2) образуется малодиссоциированное соединение, например, вода:
HCl + NaOH ® H2O + NaCl;
3) реакция сопровождается большим выделением энергии, например, горение магния:
2Mg + O2 ® 2MgO, ΔH = - 602,5 кДж/моль;
4) образованием комплексного соединения.
В уравнениях необратимых реакций между правой и левой частями ставится знак равенства или стрелка.
|
|
|
Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия, например:
H2 + J2 « 2HJ.
Под химическим равновесием понимается такое состояние обратимой реакции, когда скорости прямой и обратной реакции равны. В состояния равновесия прямая и обратная реакция не прекращается. Поэтому такое равновесие называется подвижным, или динамическим.
Используя закон действия масс, напишем выражение для скоростей прямой и обратной реакций:
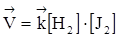 ;
; 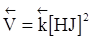 ,
,
если
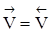 , то
, то 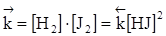 ,
,
или
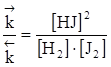 ,
, 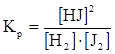 .
.
Отношение 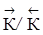 называется константой химического равновесия (обозначается Кр), которая постоянна при данной температуре, зависит от температуры и природы реагирующих веществ и не зависит от концентрации.
называется константой химического равновесия (обозначается Кр), которая постоянна при данной температуре, зависит от температуры и природы реагирующих веществ и не зависит от концентрации.
Кривые пересекаются в точке Кр. Этой точке соответствует определенное время и определенная концентрация. Точка Кр – это состояние равновесия обратимой реакции.
 С, %
С, %
Кр
t, c
Рис. 3.2
Химическое равновесие выполняется при постоянстве внешних условий (давлении, концентрации, температуре). Изменение этих условий нарушает равновесие и вызывает увеличение скорости прямой или обратной реакции. Через некоторое время снова наступает равновесие. Переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия.
|
|
|
Принцип Ле Шателье
Направление смещения химического равновесия при изменении концентрации реагирующих веществ, температуры и давления (в случаях газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия, или принципа Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие сместится в том направлении, где оказанное воздействие уменьшится.
Поясним это на примере следующей реакции:
3Н2(Г) + N2(Г) Û 2NH3(Г); ΔH = -46,2 кДж/моль.
3 объема 1 объем 2 объема
Экзотермическая реакция (тепло выделяется).
Если внешнее воздействие выражается в увеличении концентрации азота или водорода (исходных веществ), равновесие смещается к аммиаку, т. е. в сторону прямой реакции, протекающей с выходом этого вещества. Соответственно увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
|
|
|
При повышении температуры равновесие смещается в сторону эндотермической реакции, протекающей с поглощением тепла (в обратном направлении), а при понижении температуры – в сторону экзотермической реакции, идущей с выделением тепла (в прямом направлении).
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в правой и левой частях уравнения. В приведенном примере в левой части уравнения содержится четыре молекулы, а в правой – одна. Если понижать давление, то равновесие сместится в сторону возрастания числа молей газа (4 объема), т. е. в обратном направлении. Если увеличить давление, то равновесие сместится в сторону меньшего объема (2 моля вещества), т. е. в прямом направлении.
Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например,
N2(Г) + O2(Г) = 2NO(Г),
то увеличение давления не вызывает смещения химического равновесия.
Задача 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2SO2(Г) + O2(Г) Û 2SO3(Г),
|
|
|
если объем газовой смеси увеличить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ:
[SO2] = a, [O2] = в, [SO3] = c.
Согласно закону действия масс скорости прямой и обратной реакции до изменения объема составят:
Vпр. = k1 × а2 × в; Vобр. = k2 × с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из веществ увеличится в три раза:
[SO2] = 3а, [O2] = 3в, [SO3] = 3c.
Тогда скорость реакции
V¢пр = k1[3a]2 × [3в] = 27k1a2 ×в; V¢обр = k2(3с)2 = 9k2 × с2.
отсюда,
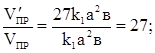
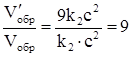 .
.
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз. Равновесие системы сместилось в сторону образования SO3.
Следует заметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Вопросы для самоподготовки
Что изучает химическая кинетика?
Что такое скорость химической реакции?
Единицы измерения скорости химической реакции.
Как читается и записывается математически закон действия масс?
Какие молекулы называют активными?
Что такое энергия активации?
Энергия активации и энергия активных молекул одно понятие или разные?
За счет чего температура изменяет скорость химической реакции?
Что такое катализатор, катализ?
Механизм действия катализатора.
Что такое химическое равновесие, почему его называют динамическим?
Что такое смещение химического равновесия?
Как читается принцип Ле Шателье?
Как записывается математически закон действия масс в гомогенных и гетерогенных системах?
Константа химического равновесия для гомогенных и гетерогенных химических реакций.
Дата добавления: 2018-09-22; просмотров: 1106; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
