Закон сохранения массы и энергии
В 1748 г. М. В. Ломоносов высказал теоретически, а затем в 1756 г. экспериментально обосновал закон сохранения массы вещества, который в настоящее время формулируется так: масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Позже французский химик Лавуазье, изучив некоторые реакции окисления металлов, пришел к тем же выводам, что и Ломоносов, и независимо от него сформулировал этот закон в 1789 г.
С точки зрения атомно-молекулярного учения суть закона сохранения массы веществ заключается в том, что при химических реакциях атомы не исчезают и не возникают из ничего – их количество остается неизменным до и после реакции. Например:
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
Поскольку атомы имеют постоянную массу и их количество в результате реакции не изменяется, то масса веществ до и после реакции остается постоянной.
М. В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии (количества движения) и рассматривал их в единстве как всеобщий закон природы. Исходя из общего принципа сохранения материи и движения, Ломоносов в 1760 г. сформулировал закон сохранения энергии. Этот закон был экспериментально подтвержден в 1842 г., когда Роберт Майер определил эквивалентные соотношения между различными видами энергии. Для химических реакций закон сохранения энергии выразится следующим образом: энергия системы, включающей вещества, вступившие в реакцию, равна энергии системы, включающей вещества, образовавшиеся в результате реакции.
|
|
|
До начала ХХ в. эти законы рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы вещества, а физика - с законом сохранения энергии.
В 1905 г. основоположник современной физики Альберт Эйнштейн показал, что энергия Е и масса m связаны соотношением
Е = mc2,
где с – скорость света в вакууме, равная 2,998∙108 м/с.
Это соотношение выражает эквивалентность массы и энергии любого объекта, но, отнюдь, не тождественность и не взаимопревращаемость вещества и энергии.
Единый закон сохранения массы и энергии можно сформулировать так: суммарные масса и энергия объектов, вступивших в реакцию, всегда равны суммарной массе и энергии продуктов реакции.
Теория химического строения вещества
Фундаментальная задача химии - изучение зависимости между химическими веществами и их свойствами.
Свойства вещества являются функцией его химического строения. Например, формулой C2H6O можно представить два разных вещества:
CH3-CH2-OH – этиловый спирт,
CH3-O-CH3 – диметиловый эфир.
До А. М. Бутлерова считали, что свойства вещества определяются их качественным и количественным составом. Он впервые в 1861 г. сформулировал основное положение своей теории химического строения так: химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением.
|
|
|
Это знаменитое положение может быть по праву названо законом Бутлерова и приравнено к фундаментальным законам химии.
В “переводе” на современный язык закон Бутлерова – теория химического строения вещества - утверждает: свойства молекулы определяются природой составляющих ее атомов, их количеством и химическим строением.
Периодический закон
Важнейшая задача химии заключается в изучении свойств элементов, в выявлении общих закономерностей их химического взаимодействия. Самое крупное научное обобщение в решении этой проблемы сделал Д. И. Менделеев, открыв в 1869 г. Периодический закон и табличное его выражение – Периодическую систему элементов.
Вследствие этого величайшего открытия стало возможным химическое предвидение, предсказание свойств новых химических элементов и соединений.
Периодическая система Менделеева является естественной систематикой атомов химических элементов. Д. И. Менделеев является основателем современной химии.
|
|
|
Исследуя изменения свойств химических элементов, расположенных в ряд по возрастающим значениям их атомной массы, Менделеев установил, что сходные в химическом отношении элементы встречаются через правильные промежутки (числа элементов) и, таким образом, одни и те же свойства периодически повторяются в этом ряду. На этом основании Менделеев и вывел Периодический закон, или, как он его назвал, закон периодичности, который сформулировал первоначально следующим образом: свойства элементов, а поэтому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от величины атомных весов элементов.
Располагая все элементы в ряд, Менделеев, по существу, придал каждому элементу порядковый или атомный номер. Впоследствии выяснился физический смысл атомного (порядкового) номера элемента – он совпадает по числовому значению с положительным зарядом ядер атомов соответствующих элементов, а следовательно, и с числом электронов в этих атомах.
Периодический закон установил, что свойства элементов и их соединений находятся в периодической зависимости от величины заряда ядра их атомов.
|
|
|
Таким образом, положительный заряд ядра (а не атомный вес по Менделееву) оказался более точным аргументом, от которого зависят свойства элементов и их соединений.
Учение о строении атомов вскрыло физический смысл Периодического закона. Химические и некоторые физические свойства являются функцией строения электронной оболочки, особенно ее наружных слоев.
Современная формулировка Периодического закона такая: свойства элементов и их соединений находятся в периодической зависимости от повторяющейся сходной структуры электронной оболочки их атомов.
Стехиометрические законы
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. В переводе с греческого “стехиометрия” обозначает “составная часть” и “измерять”.
Основу стехиометрии составляют стехиометрические законы: сохранения массы и энергии веществ, постоянства состава, эквивалентов, кратных отношений, объемных отношений, закон Авогадро. Эти законы основаны на фундаментальных законах, они являются количественным выражением атомно-молекулярной теории, закона сохранения массы и энергии.
1.5.1. Закон постоянства состава
Всякое чистое вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав – такова формулировка закона постоянства состава (Ж. Л. Пруст, 1801 г.).
Рассмотрим в качества примера воду: она содержит кислород и водород. По массе в воде содержится водорода 11,19 %, кислорода 88,81 %. Воду можно получить различными способами:
2Н2 + О2 = 2Н2О,
NaOH + HCl = H2O + NaCl,
Cu(OH)2 = H2O + CuO.
Во всех случаях чистая вода, независимо от способа получения, имеет приведенный выше состав.
Последующее развитие химии показало, что существуют соединения как постоянного, так и переменного состава. По предложению академика Н. С. Курнакова первые назвали дальтонидами (в память английского физика и химика Дальтона), вторые – бертоллидами (в память французского химика Бертолле). Состав дальтонидов можно представить в виде простых формул с целочисленным стехиометрическими индексами, например, H2O, HCl, CH4, C6H6.
У бертоллидов состав выражается дробными стехиометрическими индексами. Так, оксид титана (II) TiO в действительности имеет состав от TiO0,7 до TiO1,3, в составе TiO2 изменяется от TiO1,9 до TiO2,0 (в зависимости от условий синтеза). Бертоллиды распространены среди оксидов, гидридов, сульфидов, нитридов, карбидов, силицидов и других кристаллических неорганических соединений.
В связи с этим в современную формулировку закона постоянства состава следует внести уточнение. Состав соединений молекулярной структуры является постоянным независимо от способов получения. Состав же соединений с номенклатурной структурой зависит от условий получения (например, состав оксида титана (II) от температуры и давления кислорода, применяемого при их синтезе).
Надо учитывать изотопный состав элементов: обычная вода, например, содержит 11,19 % водорода, а тяжелая вода – 20 % дейтерия.
1.5.2. Закон эквивалентов
Элементы взаимодействуют друг с другом в строго определенных количественных отношениях. Это следует из закона постоянства состава. Одновременно с установлением этого закона Дальтоном было введено понятие эквивалента.
Химическим эквивалентом элемента (Э) называется такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Так, в соединениях HCl и NaH 1 моль атомов водорода соединяется с 1 молем атомов хлора и с 1 молем атомов натрия. Эквиваленты хлора и натрия равны 1 молю атомов.
Эквивалентная масса (mЭ, г/моль) – это масса 1 эквивалента вещества. В примере эквивалентные массы хлора и натрия численно равны их атомным массам: соответственно 35,453 и 22,9898 г/моль.
Задача. Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H2O и NH3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 моля атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/2 и 1/3 моля. Исходя из мольных масс атомов этих элементов, находим, что эквивалентная масса брома равна 79,9 г/моль, кислорода – 16 ∙ 1/2 = 8 г/моль, азота – 14 ∙ 1/3 = 4,67 г/моль, где 79,9, 16 и 14 – атомные массы соответствующих элементов.
Можно дать другое определение эквивалента: химическим эквивалентом элемента называется число единиц его массы, которое может в химических реакциях присоединять или замещать одну (точнее 1,008) часть массы водорода или 8 частей массы кислорода.
Между эквивалентной массой mэ, молярной массой атомов А и валентностью элемента В (степень окисления) в данном соединении существует зависимость:
mЭ 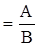 .
. 
По этой формуле определяется теоретическое значение эквивалентных масс элемента. Например:
mЭ, Al в Al2O3 = 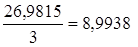 г/моль,
г/моль,
mЭ, Ca в CaSO4 = 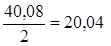 г/моль,
г/моль,
mЭ, Na в NaCl = 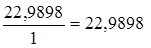 г/моль.
г/моль.
В отличие от атомной или молекулярной масс химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления). Постоянные значения эквивалентов могут быть только у элементов с постоянной валентностью (степенью окисления).
Понятие об эквивалентах и эквивалентных массах применимо и к соединениям.
Эквивалентом соединения называется такое его количество, которое в данной реакции взаимодействует с одним эквивалентом водорода или одним эквивалентом другого вещества.
Для вычисления эквивалентных масс сложных веществ можно пользоваться следующими формулами:
mЭ, оксида = 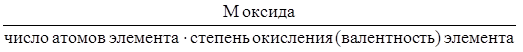
или
mЭ, оксида = mЭ элемента+ mЭ кислорода,
mЭ, кислоты = 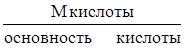 ,
,
mЭ, основания = 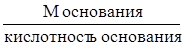 ,
,
mЭ, соли = 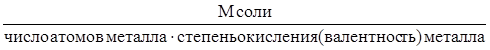 ,
,
где М – мольная масса соединений; основность кислоты – количество ионов водорода Н+ в кислоте, способных замещаться на металл; кислотность основания – количество гидроксидионов OH– в основании, способных замещаться на кислотные остатки.
Задача.
mЭ, HCl = MHCl / 1= 36,5 / 1 = 36,5 г/моль,
mЭ, H2SO4 = 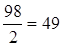 г/моль,
г/моль,
mЭ, Al(OH)3 = 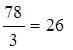 г/моль,
г/моль,
mЭ, Al2 (SO4)3 = 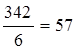 г/моль,
г/моль,
mЭ, FeO = 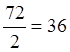 г/моль,
г/моль,
mЭ, CO2 = 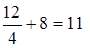 г/моль.
г/моль.
Подобно эквиваленту элемента, эквивалент сложного вещества может иметь несколько значений. Он зависит от типа химической реакции, в которую вступает данное вещество.
Задачи :
1) H2SO4 + NaOH = NaHSO4 + H2O, mЭ, H2SO4 = 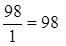 г/моль,
г/моль,
H2SO4 + 2NaOH = Na2SO4 + 2H2O, mЭ, H2SO4 = 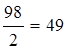 г/моль,
г/моль,
2) Сu(OH)2 + HCl = CuOHCl + H2O, mЭ, Cu(OH)2 = 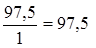 г/моль,
г/моль,
Сu(OH)2 + 2HCl = CuCl2 + 2H2O, mэ, Cu(OH)2 = 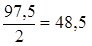 г/моль,
г/моль,
3) AlCl3 + NaOH = AlOHCl2 + NaCl, mЭ, AlCl3 = 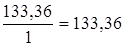 г/моль,
г/моль,
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl, mЭ, AlCl3 = 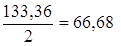 г/моль,
г/моль,
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl, mЭ, AlCl3 = 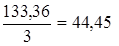 г/моль.
г/моль.
На основании понятий эквивалентов был сформулирован закон эквивалентов (М. Рихтер, 1792 г.): вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам или массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам).
Для реакции:
А + В = АВ,
mA / mB = mЭA/ mЭB,
где mA и mB – массы веществ А и В, mЭА и mЭВ – эквивалентные массы веществ А и В.
При решении некоторых задач целесообразно пользоваться значениями эквивалентного объема.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентном вещества.
Если одно из реагирующих веществ находится в твердом состоянии, а другое – газообразном, то закон эквивалентов можно представить формулой
m / V = mЭ / VЭ,
где m – масса твердого вещества; mЭ – его эквивалентная масса; V – объем газообразного вещества; VЭ – его эквивалентный объем (объем одного эквивалента).
VЭ, Н = 11,2 л/моль; VЭ, О = 5,6 л/моль.
1.5.3. Закон кратных отношений
Если два элемента образуют несколько соединений, то массы одного из элементов в разных соединениях относятся между собой как целые числа.
Например, азот и кислород дают пять оксидов N2O, NO, N2O3, NO2, N2O5. Массовое количество кислорода, приходящееся на одно и то же массовое количество азота, относятся как целые числа 1:2:3:4:5.
Следовательно, одинаковое число атомов азота в молекулах разных оксидов связано с различным числом атомов кислорода (табл. 1.1).
Таблица 1.1
| Оксид | N2O | NO | N2O3 | NO2 | N2O5 |
| Массовое количество N | 1 | 1 | 1 | 1 | 1 |
| Массовое количество O | 0,57 | 1,14 | 1,71 | 2,28 | 2,85 |
| Отношение между массовыми количествами кислорода в оксидах |
0,57 : 1,14 : 1,71 : 2,28 : 2,85 = 1 : 2 : 3 : 4 : 5 | ||||
Закон открытый Дальтоном в 1803 г., подтвердил атомистические представления. Наименьшее количество элемента, вступающее в соединение, – это атом. В соединение может вступать только целое число атомов. Из закона кратных отношений следует:
1) состав веществ (дальтонидов) меняется скачком, так как в соединения вступают целые числа атомов;
2) количество переходит в качество – это, по выражению Ф. Энгельса, “всеобщий закон развития природы, общества и мышления”. Энгельс дал такое определение химии: “Химию можно назвать наукой о качественных изменениях тел, происходящих под влиянием изменений количественного состава”.
Газовые законы
В прошлом веке наиболее полно были изучены химические реакции между газообразными веществами. Газовые законы являются также стехиометрическими.
1.6.1. Закон простых объемных отношений
(закон Гей-Люссака, 1808 г.)
При одинаковых физических условиях (давлении и температуре) объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа (коэффициенты химических уравнений).
Например, при взаимодействии двух объемов водорода и одного объема кислорода образуется два объема водяного пара:
2Н2(Г) + O2(Г) = 2H2O(пар).
Или 1 л водорода соединяется с 1 л хлора, образуя 2 л хлороводорода (объем отношения 1:1:2):
Н2(г) + Cl2(г) = 2HCl(г).
На этом законе основаны методы часто применяемого газового анализа.
1.6.2. Закон Авогадро
Для объяснения простых соотношений между объемами реагирующих газов итальянский ученый Амедео Авогадро в 1811 г. высказал гипотезу, которая впоследствии была подтверждена опытными данными и стала называться законом Авогадро. В равных объемах любых газов при одинаковых физических условиях (давлении и температуре) содержится одинаковое число молекул. Авогадро предположил, что молекулы простых газов состоят из двух одинаковых атомов. При соединении водорода с хлором их молекулы распадаются на атомы, которые образуют молекулы хлороводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора образуется две молекулы хлороводорода, то и объем последнего должен быть равен сумме объемов исходных газов, т. е.
H2 + Cl2 = 2HCl.
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (H2, Cl2, N2, O2 и др.). В химических уравнениях коэффициенты перед формулами газообразных веществ указывают на объемы реагирующих газов.
Из закона Авогадро вытекают два следствия, сформулированные в 1855 г. Жераром:
1) Один моль любого газа при нормальных условиях, т. е. при Т = 273,15 К и Р = 101325 Па, занимает один и тот же объем, равный 22,4 л. Этот объем называется молярным (мольным) объемом газа: V = 22,4 л/моль = = 22,4 м3/кмоль.
Поскольку в одном моле любого вещества содержится 6,02∙1023 молекул, то в 22,4 л любого газа при нормальных условиях содержится 6,02∙1023 молекул (число Авогадро NA).
При помощи числа Авогадро можно вычислить абсолютный вес атомов и молекул. Для этого нужно мольную массу атомов или молекул (атомную или молярную массу) разделить на число Авогадро;
2) Молярная масса (значит, и относительная молекулярная масса Mr) вещества в газообразном состоянии равна его удвоенной плотности по водороду (точнее 2,0158 плотности):
М = 2Dн2,
где М – молярная масса газа; Dн2 – плотность газа по водороду, которую можно определить простым физическим экспериментом:
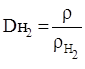 (r – плотность газа).
(r – плотность газа).
Часто плотность газа определяется по отношению к воздуху в Dвозд. Воздух является смесью газов, его средняя молярная масса равна 29 кг/кмоль. Молярная масса газа по воздуху М = 29 Dвозд.
Определение молярных масс показало, что молекулы простых газов состоят из двух атомов, а каждая молекула инертных газов – из одного атома (He, Ne, Ar, Kr, Хе, Rn,). Для инертных газов понятия атома и молекулы равнозначны. Однако молекулы некоторых простых веществ могут иметь три и более атомов, например, озона О3, фосфора Р4, паров серы при невысоких температурах S8.
1.6.3. Уравнение Менделеева-Клапейрона
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа) связывает массу (m, кг) и температуру (Т), давление (Р, Па) и объем (V, м3) газа с его мольной массой (М, кг/моль):
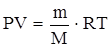 ,
,
где R – универсальная газовая постоянная, 8,31∙108 Дж/кмоль.
Зная массу любого объема газа при какой-то конкретной температуре и давлении, можно вычислить его молекулярную массу (а.е.м.), определив численно равную ей мольную массу вещества по уравнению Менделеева-Клапейрона:
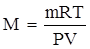 .
.
Задача. Вычислить молекулярную массу бензола, зная, что масса 600 мл его паров при 87 °С и давлении 83,2 кПа равна 1,30 г.
Решение. Выразив данные задачи в единицах СИ (Р = 8,32∙104 Па; V = 6∙10-4 м3; m = 1,30∙10-3 кг; Т = 360 К) и подставив их в уравнение Менделеева-Клапейрона, найдем
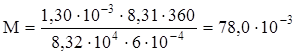 кг/моль = 78,0 г/моль.
кг/моль = 78,0 г/моль.
Молекулярная масса бензола равна 78,0 а.е.м.
Вопросы для самоподготовки
Назовите формы существования материи.
Что изучает химия?
Что такое атом, молекула, атомная и молекулярная массы?
Единицы измерения атомных и молекулярных масс.
Как оценить абсолютную массу атома любого элемента (в г)?
Что такое моль? Что такое эквивалент и эквивалентная масса элемента, вещества?
Назовите основные положения атомно-молекулярной теории.
Как читается и записывается математически закон эквивалентов?
Закон сохранения массы веществ.
Какие законы относятся к стехиометрическим, фундаментальным?
Зачем нужно знать химию?
Дата добавления: 2018-09-22; просмотров: 1097; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
