Основные положения молекулярно-кинетической теории. Идеальный газ. Параметры газа.
Основные положения молекулярно-кинетической теории:
1. Все вещества состоят из мельчайших частиц: молекул и атомов.
Молекула – наименьшая частица вещества, обладающая его основными химическими свойствами и состоящая из атомов, которые соединены между собой химическими связями.
Атом – наименьшая часть химического элемента (микрочастица). Атом состоит из ядра и электронов. В состав ядра атома входят протоны, несущие положительный элементарный заряд, и нейтроны, не имеющие заряда. Электроны – частицы, несущие отрицательный элементарный заряд..
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества. Это движение называется броуновским по имени ученого.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Газ – состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и находятся в тепловом хаотическом движении, заполняя весь объем.
Идеальным называют газ, взаимодействием между молекулами которого можно пренебречь.
Идеальным газомназывают газ, для которого можно пренебречь размерами молекул и силами молекулярного взаимодействия; соударения молекул в таком газе происходят по закону соударения упругих шаров.
Реальные газы ведут себя подобно идеальному, когда среднее расстояние между молекулами во много раз больше их размеров, т. е. при достаточно больших разрежениях.
|
|
|
Параметры газа:
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней.
Температурой называется физическая величина, характеризующая степень нагретости тела. С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению v= V/М. В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
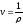
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Закон Менделеева–Клапейрона.
Состояние газа описывается тремя параметрами V, Р, Т, между которыми существует однозначное соотношение, называемое уравнением Менделеева -Клапейрона.
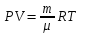
R - молярная газовая постоянная, определяет работу, которую совершает 1 моль газа при изобарном нагревании его на 1 К (кельвин), μ – молярная масса.
|
|
|
Из уравнения состояния идеального газа вытекает ряд важных следствий:
- При одинаковых температурах и давлениях в равных объёмах любых идеальных газов, содержится одинаковое количество молекул, равное постоянной Авогадро. (закон Авогадро).
- Давление смеси химически невзаимодействующих идеальных газов равно сумме парциальных давлений этих газов (закон Дальтона).: Р = Р1 + Р2 + Р3 + ... Парциальным называют давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал весь объем, равный объему смеси при той же температуре.
- Отношение произведения давления и объёма идеального газа к его абсолютной температуре есть величина постоянная для данной массы данного газа (объединенный газовый закон)
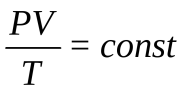
Дата добавления: 2018-08-06; просмотров: 741; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
