Термодинамическое состояние. Термодинамические процессы (равновесные, неравновесные, обратимые, необратимые).
Термодинамическое состояние тела (например, газа) характеризуется его массойm, молярной массой μ, давлением 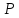 , объемом
, объемом 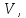 температурой
температурой 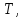 (а возможно, и другими величинами, например, определяющими его химический состав). Все эти величины называются термодинамическими параметрами тела.
(а возможно, и другими величинами, например, определяющими его химический состав). Все эти величины называются термодинамическими параметрами тела.
Совокупность макроскопических тел, которые при взаимодействии обмениваются энергией между собой и окружающей средой, называют термодинамической системой.
Физические величины (например, давление, температура и т. д.), характеризующие состояние термодинамической системы в данный момент времени, называют параметрами состояния, или термодинамическими параметрами.
Давление– физическая величина, характеризующая интенсивность сил, с которыми одно тело действует нормально (перпендикулярно) на поверхность другого – внутренний параметр системы. В СИ единицей измерения давления считается паскаль (Па), 1 Н/м2 = 1 Па.
Температура – физическая величина, характеризующая состояние термодинамического равновесия для всех частей макроскопической системы и являющаяся мерой отклонения от этого равновесия.
Переход термодинамической системы из одного состояния в другое называют термодинамическим процессом.
Состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени, в условиях изоляции от окружающей среды, называют равновесным.
|
|
|
Состояние термодинамической системы, в котором хотя бы один из параметров, характеризующих ее состояние, изменяется, называют неравновесным.
Процесс перехода системы от неравновесного состояния к равновесному называют релаксацией.
Если изменения параметров проходят таким образом, что в любом промежуточном состоянии система находится в равновесии, то такиепроцессыназываютсяравновесными.
Реальные процессы, будучи неравновесными, могут лишь в той или иной степени приближаться к равновесным, никогда в точности с ними не совпадая.
Равновесный процесс, протекающий при отсутствии трения, называетсяобратимым. Под трением в широком смысле слова здесь понимается любой процесс непосредственного превращения различных видов энергии в тепловую. Обратимый процесс может протекать самопроизвольно как в прямом, так и в обратном направлениях, проходя через те же самые равновесные состояния. В результате прямого и обратного процессов термодинамическая система и окружающая среда возвращаются в исходное состояние без остаточных изменений.
Необратимымназывается процесс, который либо вообще невозможен в обратном направлении по тому же самому пути, либо требует для своего осуществления дополнительных внешних затрат. Если нарушается хотя бы одно из условий обратимости, то процесс будет необратимым.
|
|
|
Примерами термодинамических процессов являются:
1. Изохорический процесс (V = const) – процесс перехода термодинамической системы из одного состояния в другое при постоянном объеме – закон Шарля.
2. Изобарический процесс (Р = const) – процесс перехода термодинамической системы из одного состояния в другое при постоянном давлении – закон Гей-Люссака.
3. Изотермический процесс (T = const) – процесс перехода термодинамической системы из одного состояния в другое при постоянной температуре – закон Бойля – Мариотта.
4. Адиабатический процесс (Q = const) – процесс перехода термодинамической системы из одного состояния в другое без теплообмена с окружающей средой – закон Пуассона.
Дата добавления: 2018-08-06; просмотров: 2210; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
