Средняя квадратичная скорость молекул. Молекулярно-кинетическое толкование абсолютной температуры.
Запишем уравнение состояния идеального газа (уравнение Менделеева-Клайпейрона) в виде
 , (11.47)
, (11.47)
где R - универсальная газовая постоянная R = 8,31×103  .
.
В одном киломоле любого вещества находится одно и то же количество молекул, равное числу Авогадро NA = 6,023×1023 моль-1.
Объем одного киломоля идеального газа при нормальных условиях
Vкм = 22,4 м3/кмоль.
Часто употребляется еще одна физическая константа - постоянная Больцмана k=R/NA=1.38×10-23 Дж/К. Для одного киломоля идеального газа можно записать
 и
и  . (11.48)
. (11.48)
Откуда следует
 =
=  или
или  ,
,  , (11.49)
, (11.49)
где  - средняя кинетическая энергия поступательного движения одной молекулы газа. Абсолютная температура T лишь постоянным множителем
- средняя кинетическая энергия поступательного движения одной молекулы газа. Абсолютная температура T лишь постоянным множителем  отличается от
отличается от 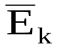 .
.
С точки зрения молекулярно-кинетической теории, абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекулы.:
<E пост>=3/2kT. (k –постоянная Больцманаk=R/NA=1.38×10-23 Дж/К.)
Абсолютный нуль (-273,15 0С) - температура, при которой поступательное движение молекул идеального газа замирает.
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
 , где
, где 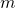 — Масса одной молекулы,
— Масса одной молекулы, 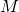 — Молярная масса (масса одного моля вещества).
— Молярная масса (масса одного моля вещества).
Число степеней свободы. Принцип равнораспределения энергии по степеням свободы. Внутренняя энергия идеального газа.
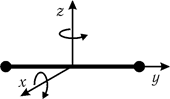 Рис. 9.4 Рис. 9.4
|
Числом степеней свободы называется число независимых координат, которыми описывается движение тела в пространстве. Материальная точка имеет три степени свободы, поскольку при ее движении в пространстве изменяются три координаты: x, y, z. Система из двух материальных точек, расстояние между которыми остается постоянным, имеет пять степеней свободы: три из них приходится на поступательное движение и две – на вращательное (рис. 9.4) вокруг осей x и z. Вращение вокруг оси y не дает дополнительной степени свободы, так как при этом положения материальных точек в пространстве не изменяется.
|
|
|
Средняя кинетическая энергия поступательного движения молекулы равна  – формула (8.12) (к – постоянная Больцмана, Т - температура). Это движение можно рассматривать как движение с тремя степенями свободы, поскольку молекулы идеального газа можно принять как материальные точки. Все три степени свободы равноправны, поэтому можно считать, что на одну степень свободы приходится энергия
– формула (8.12) (к – постоянная Больцмана, Т - температура). Это движение можно рассматривать как движение с тремя степенями свободы, поскольку молекулы идеального газа можно принять как материальные точки. Все три степени свободы равноправны, поэтому можно считать, что на одну степень свободы приходится энергия
 . .
| (9.8) |
В статистической физике доказывается, что на любую степень свободы движения молекулы (поступательную, вращательную и т.д.) приходится одна и та же энергия, равная  . Это утверждение носит название закона распределения энергии по степеням свободы.
. Это утверждение носит название закона распределения энергии по степеням свободы.
|
|
|
В общем случае, когда молекула имеет не одну степень свободы, аi степеней свободы, ее кинетическая энергия
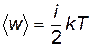 . .
| (9.9) |
Подсчитаем теперь внутреннюю энергию (U)одного киломоля идеального газа. Эта энергия может быть найдена умножением средней энергии одной молекулы на их число, т.е. на число Авогадро:
 . .
|
Поскольку kNA=R, где R – универсальная газовая постоянная, то
 . .
| (9.10) |
Из (9.10) видно, что внутренняя энергия идеального газа полностью определяется его температурой. Из-за отсутствия взаимодействия между молекулами идеального газа внутренняя энергия его зависит от числа частиц, температуры и не зависит от объема (закон Джоуля).
Дата добавления: 2018-08-06; просмотров: 1864; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
