Адиабатический процесс.Уравнение Пуассона.
Адиабатический, процесс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит.
Первое начало термодинамики для адиабатического процесса представим в виде:
dU = − dA
Следовательно, при адиабатическом процессе газ совершает работу за счет убыли его внутренней энергии.
Уравнение Пуассона описывает адиабатный процесс, протекающий в идеальном газе. Адиабатным называют такой процесс, при котором отсутствует теплообмен между рассматриваемой системой и окружающей средой: 
Уравнение Пуассона имеет вид:


 На рисунке видно, что кривая адиабаты идет круче, чем изотерма. Объясняется это тем, что при адиабатическом расширении идеального газа происходит не только уменьшение давления, но и понижение температуры, так как внутренняя энергия газа убывает. При адиабатическом сжатии газа растут давление и температура, не только из-за уменьшения объема, но и из-за увеличения внутренней энергии.
На рисунке видно, что кривая адиабаты идет круче, чем изотерма. Объясняется это тем, что при адиабатическом расширении идеального газа происходит не только уменьшение давления, но и понижение температуры, так как внутренняя энергия газа убывает. При адиабатическом сжатии газа растут давление и температура, не только из-за уменьшения объема, но и из-за увеличения внутренней энергии.
Классическая теория теплоемкости газа. Уравнение Майера.
Теплоемкостьютела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на 1 К.
|
|
|
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
 .
.
Молярная теплоемкость вещества– величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
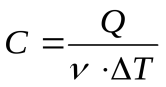 , откуда
, откуда  .
.
Различают теплоемкости газа при изохорном и изобарном процессах.
1. Молярная теплоемкость газа при изохорном процессе 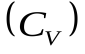 .
.
Для изохорного процесса первое начало термодинамики:
 .
.
Следовательно  , откуда
, откуда  .
.
2. Молярная теплоемкость газа при изобарном процессе  .
.
Для изобарного процесса первое начало термодинамики:
 .
.
Так как для изобарного процесса  ,
,
то  ,
,
откуда  .
.
Уравнение Майера.
Сравнение между собой Ср и СV приводит к уравнению Майера:
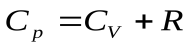 .
.
Это уравнение показывает, что Ср больше, чем СV на величину универсальной газовой постоянной R. Это объясняется тем, что при изобарном нагревании газа, в отличие от изохорного нагревания, требуется дополнительное количество теплоты на совершение работы расширения газа.
Таким образом, молярная теплоемкость газа определяется лишь числом степеней свободы и не зависит от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов.Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры
|
|
|
Дата добавления: 2018-08-06; просмотров: 3911; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
