Геморрагическая лихорадка с почечным синдромом
Острая вирусная зоонозная природно-очаговая болезнь, характеризующаяся системным поражением мелких кровеносных сосудов, геморрагическим диатезом, гемодинамическими расстройствами и поражением почек с развитием ОПН.
ЭтиологияВозбудитель — арбовирус семейства Bunyaviridae, рода Hantavirus, включаю- щий около 30 серотипов, 4 из которых (Hantaan, Puumala, Seul и Dobrava/Belgrad) вызывают заболевание, известное под названием ГЛПС. Вирус ГЛПС имеет сфери- ческую форму; диаметром 85–120 нм, содержит четыре полипептида: нуклеокап- сид (N), РНК-полимеразу и гликопротеины мембраны — G1 и G2. Геном вируса включает три сегмента (L-, M-, S-) одноцепочечной «минус»-РНК; реплициру- ется в цитоплазме инфицированных клеток (моноцитах, клетках лёгких, почек, печени, слюнных желёз). Антигенные свойства обусловлены наличием антигенов нуклеокапсида и поверхностных гликопротеинов. Поверхностные гликопротеины стимулируют образование вируснейтрализующих антител, в то время как антитела к нуклеокапсидному белку не способны нейтрализовать вирус. Возбудитель ГЛПС способен размножаться в куриных эмбрионах, пассируется на полевых мышах, золотистых и джунгарских хомяках, крысах Фишер и Вистар. Вирус чувствителен к хлороформу, ацетону, эфиру, бензолу, ультрафиолетовому облучению; инакти- вируется при 50 °С в течение 30 мин, кислотолабилен (полностью инактивируется при pH ниже 5,0). Относительно устойчив во внешней среде при 4–20 °С, хорошо сохраняется при температуре ниже –20 °С. В сыворотке крови, взятой у больных, сохраняется до 4 сут при 4 °С.
|
|
|
ЭпидемиологияОсновной источник и резервуар возбудителя ГЛПС — мышевидные грызуны (рыжая полёвка, лесная мышь, красно-серая полёвка, азиатская лесная мышь, домовые мыши и крысы), которые переносят бессимптомную инфекцию и выде- ляют вирус с мочой и фекалиями. Заражение людей происходит преимущественно воздушно-пылевым путём (при аспирации вируса из высохших испражнений инфицированных грызунов), а также контактным (через повреждённые кожные и слизистые покровы, при соприкосновении с грызунами или инфицированными объектами внешней среды — сено, солома, хворост), а также алиментарным (при употреблении продуктов, загрязнённых выделениями инфицированных грызунов и не прошедших термическую обработку). Передача инфекции от человека к чело- веку невозможна. Перенесённая инфекция оставляет стойкий пожизненный типоспеци- фический иммунитет. Природные очаги ГЛПС распространены по всему миру: в скандинавских странах (Швеция, Норвегия, Финляндия), Болгарии, Чехии, Словакии, Югославии, Бельгии, Франции, Австрии, Польше, Сербии, Словении, Хорватии, Боснии, Албании, Венгрии, Германии, Греции, Дальнем Востоке (КНР, КНДР, Южная Корея). В России ГЛПС регистрируют во всех регионах. Наиболее активные очаги существуют между Волгой и Уралом (Башкортостан, Татарстан, Республика Марий Эл, Самарская и Ульяновская области) и на Дальнем Востоке. Чётко выражена сезонность заболеваемости: с мая по декабрь.
|
|
|
Меры ПрофилактикиСпецифическая Специфическая не проводится. Корейская вакцина, изготовленная на основе штамма Hantaan, в России не сертифицирована. Неспецифическая Включает уничтожение грызунов в очагах, использование респираторов при работе в запылённых помещениях, хранение продуктов на складах, защищённых от грызунов.
ПатогенезИзучен недостаточно. Патологический процесс протекает стадийно; выделяют несколько стадий. • Заражение. Вирус внедряется через слизистые дыхательных, пищеваритель- ных путей, повреждённый кожный покров и репродуцируется в лимфоузлах и мононуклеарно-фагоцитарной системе. • Вирусемия и генерализация инфекции. Происходит диссеминация вируса и его инфекционно-токсическое воздействие на рецепторы сосудов и нервной системы, что клинически соответствует инкубационному периоду болезни. • Токсико-аллергические и иммунологические реакции (соответствуют лихорадочному периоду заболевания). Циркулирующий в крови вирус захва- тывают клетки мононуклеарно-фагоцитарной системы и при нормальной иммунореактивности удаляют из организма. Но при нарушении регуляторных механизмов комплексы антиген-антитело повреждают стенки артериол, повы- шая активность гиалуронидазы, калликреин-кининовой системы, в результате чего повышается проницаемость сосудов и развивается геморрагический диа- тез с плазмореей в ткани. Ведущее место в патогенезе также принадлежит кле- точным факторам иммунитета: цитотоксическим лимфоцитам, NK-клеткам и провоспалительным цитокинам (ИЛ-1, ФНО-α, ИЛ-6), которые оказывают повреждающее действие на инфицированные вирусом клетки. • Висцеральные поражения и обменные нарушения (клинически соот- ветствуют олигурическому периоду болезни). Результатом развившихся под действием вируса нарушений становятся геморрагические, дистрофические и некробиотические изменения в гипофизе, надпочечниках, почках и других паренхиматозных органах (манифестация ДВС-синдрома). Наибольшие изме- нения отмечают в почках — снижение клубочковой фильтрации и нарушение канальцевой реабсорбции, что приводит к олигурии, азотемии, протеинурии, кислотно-щелочному и водно-электролитному дисбалансу, в результате чего развивается ОПН. • Анатомическая репарация, формирование стойкого иммунитета, восста- новление нарушенных функций почек.
|
|
|
|
|
|
Клиническая картинаИнкубационный период — от 4 до 49 (в среднем 14–21) дней. Для заболевания характерна чёткая цикличность течения и многообразие клинических вариантов, от абортивных лихорадочных форм до тяжёлых, с массивным геморрагическим синдромом и стойкой почечной недостаточностью. Выделяют следующие периоды: начальный (лихорадочный), олигурический, полиурический, реконвалесцент- ный (ранний — до 2 мес и поздний — до 2–3 лет). Продромальные явления в виде недомогания, познабливания, утомляемости, субфебрилитета, длящиеся 1–3 дня, наблюдают не более чем у 10% больных.
Основные симптомы и динамика их развития Начальный период (1–3-й дни болезни) длительностью от 3 до 10 сут характе- ризуется острым началом, повышением температуры тела до 38–40 °С и более, сильной головной болью, сухостью во рту, тошнотой, снижением аппетита, слабо- стью, миалгиями. Отмечают запоры, хотя возможна и диарея до 3–5 раз в сутки. Характерны жалобы на снижение остроты зрения («мушки» перед глазами), боли в глазных яблоках, которые исчезают в течение 1–5 дней. Отмечают гиперемию лица, шеи, верхней части груди, инъекцию склер и конъюнктивы, гиперемию зева, геморрагическую энантему на слизистой оболочке мягкого нёба, умеренную брадикардию. Возможны кровянистые выделения из носа, рвота, боли в пояснице, животе; с 3–5-го дня появляется петехиальная сыпь в области ключиц, подмы- шечных впадин, груди. При тяжёлых формах отмечают симптомы менингизма. На 4–6-й день болезни возрастает риск развития ИТШ, особенно при нарушении лечебно-охранительного режима (физический труд, посещение бани, употребле- ние алкоголя). Олигурический период (с 3–6-го по 8–14-й день болезни) — при нор- мализации температуры тела состояние больного не улучшается, чаще оно даже ухудшается; усугубляются симптомы интоксикации (усиливается головная боль, появляется рвота, не связанная с приёмом пищи, икота, сухость во рту, анорек- сия), и суточный диурез снижается, степень выраженности олигурии коррелирует с тяжестью заболевания. Характерна выраженная адинамия, боли в поясничной области различной интенсивности, геморрагический синдром (кровоизлияния в склеры, в местах инъекций; носовые, желудочно-кишечные, маточные кровоте- чения). Кровоизлияния в жизненно важные органы (ЦНС, надпочечники, гипо- физ) могут стать причиной летального исхода. Объективно у больных отмечают бледность лица, пастозность век, одутловатость лица; брадикардию, гипотензию, сменяемую к концу периода гипертензией; проявляются симптомы бронхита (у курильщиков). При пальпации живота определяется болезненность в проекции почек, гепатомегалия, положительный симптом поколачивания по поясничной области. При выявлении последнего симптома следует проявлять особую осто- рожность из-за возможности разрыва капсулы почки. Полиурический период (с 9–13-го дня болезни) отличается развитием полиу- рии (до 5 л/сут и более), никтурии с гипоизостенурией; прекращением рвоты, исчезновением болей в пояснице, восстановлением сна и аппетита. В то же время сохраняется слабость, сухость во рту, усиливается жажда. Иногда в первые дни полиурии ещё нарастает азотемия, возможно развитие дегидратации, гипонатрие- мии, гипокалиемии. В период реконвалесценции восстанавливается суточный диурез, приходят к норме показатели мочевины и креатинина, улучшается общее состояние больно- го. Длительность выздоровления зависит от скорости восстановления почечных функций и продолжается от 3 нед до 2–3 лет. Оценка тяжести заболевания соот- ветствует степени выраженности основных клинических синдромов, прежде всего ОПН, и развитию осложнений.
ОсложненияОсложнения делят на специфические и неспецифические. • Специфические: G ИТШ; G ДВС-синдром; G азотемическая уремия; G отёк лёгких и головного мозга; G кровоизлияния в гипофиз, надпочечники, миокард, головной мозг; G эклампсия; G острая сердечно-сосудистая недостаточность; G профузные кровотечения; G надрыв или разрыв капсулы почки; G инфекционный миокардит; G геморрагический менингоэнцефалит, G парез кишечника; G вирусная пневмония и др. • Неспецифические: G пиелонефрит; G восходящий пиелит; G гнойный отит; G абсцессы; G флегмоны; G пневмонии; G паротит; G сепсис и др.
ДиагностикаКлиническая Характерно сочетание острого начала болезни с появлением лихорадки и сим- птомов интоксикации, поражения почек с развитием ОПН и геморрагическим синдромом. Эпидемиологический анамнез Пребывание в эндемичном очаге, характер профессиональной деятельности. Сезонность Цикличность течения с закономерной сменой инфекционно-токсических сим- птомов начального периода (лихорадка, головная боль, слабость, гиперемия лица, шеи, верхней трети груди, слизистых оболочек, инъекция сосудов склер) призна- ками нарастающей почечной недостаточности олигурического периода (боли в пояснице, животе; рвота, не связанная с приёмом пищи; снижение остроты зрения на фоне сильной головной боли, сухости во рту, жажды; выраженный геморраги- ческий синдром, снижение диуреза до менее 500 мл/сут). лабораторная диагностикаИнформативность лабораторных неспецифических (общеклинических, био- химических, коагулопатических, электролитных, иммунологических) и инстру- ментальных (ЭГДС, УЗИ, КТ, ЭКГ, рентгенографии ОГК и др.) показателей относительна, так как они отражают выраженность неспецифических патофи- зиологических синдромов — ОПН, ДВС и других, их следует оценивать с учётом периода болезни. Клинический анализ крови: в начальном периоде — лейкопения, увеличе- ние числа эритроцитов, гемоглобина, снижение СОЭ, тромбоцитопения; в разгар болезни — лейкоцитоз со сдвигом формулы влево, увеличение СОЭ до 40 мм/ч. Общий анализ мочи: протеинурия (от 0,3 до 30,0 г/л и выше), микро- и макро- гематурия, цилиндрурия, клетки Дунаевского. Проба Зимницкого: гипоизостенурия. Биохимический анализ крови: повышение концентрации мочевины, креати- нина, гиперкалиемия, гипонатриемия, гипохлоремия. Коагулограмма: в зависимости от периода заболевания признаки гипер- коагуляции (укорочение тромбинового времени до 10–15 с, времени свёртывания крови, повышение концентрации фибриногена до 4,5–8 г/л, протромбинового индекса до 100–120%) либо гипокоагуляции (удлинение тромбинового времени до 25–50 с, удлинение времени свёртывания, снижение концентрации фибриноге- на до 1–2 г/л, протромбинового индекса до 30–60%). Специфическая лабораторная диагностика РНИФ: исследования проводят в парных сыворотках, взятых с интервалом 5–7 сут. Диагностически значимым считают нарастание титра антител в 4 раза и более. Для повышения эффективности серодиагностики ГЛПС рекомендуют проводить забор первой сыворотки до 4–7-го дня болезни, а второй — не позже 15-го дня заболевания. Также используют твёрдофазный ИФА, который позволяет определить концентрацию IgM-антител. С целью ранней диагностики применяют ПЦР для обнаружения фрагментов вирусной РНК в крови. Инструментальные методы УЗИ почек, ЭКГ, рентгенография органов грудной клетки.
ЛечениеРежим. Диета Необходимо соблюдение строгого постельного режима вплоть до прекращения полиурии. Рекомендуют полноценное питание без ограничения поваренной соли, дробное, в тёплом виде. В олигурический период исключают продукты, богатые калием (овощи, фрукты) и белком (бобовые, рыба, мясо). В полиурии, наоборот, показа- но употребление этих продуктов. Питьевой режим должен быть дозированным, с учётом количества выделенной жидкости. Медикаментозная терапияПроводят в начальном периоде, в первые 3–5 дней: рибавирин по 0,2 г 4 раза в сутки 5–7 дней, йодофеназон — по схеме: по 0,3 г 3 раза в сутки в течение первых 2 дней, по 0,2 г 3 раза в сутки следующие 2 дня и по 0,1 г 3 раза в сутки в течение последующих 5 дней, тилорон — 0,25 мг 2 раза в сутки в 1-й день, далее по 0,125 мг 2 дня; донорский специфический иммуноглобулин против ГЛПС по 6 мл 2 раза в сутки внутримышечно (курсовая доза 12 мл), комплексный иммуноглобулиновый препарат, препараты интерферонов в свечах (виферон♠) и парентерально (реафе- рон♠, лейкинферон♠). При невозможности приёма капсулированного рибавирина (неукротимая рвота, кома) с учётом противопоказаний рекомендуют внутривен- ное введение рибавирина с начальной нагрузочной дозой 33 мг/кг; через 6 ч — по 16 мг/кг через каждые 6 ч в течение 4 дней (всего 16 доз); через 8 ч после введения последней из этих доз — по 8 мг/кг каждые 8 ч в течение 3 дней (9 доз). Лечение рибавирином в данной дозе может быть продолжено в зависимости от состояния больного и мнения лечащего врача, но не должно превышать 7 дней. При возмож- ности перорального приёма рибавирина необходимо прекратить внутривенное введение рибавирина и перейти на капсулированные формы в соответствии со схемой лечения, приведённой выше.
Патогенетическая терапия• Дезинтоксикационная терапия. Внутривенно вводят 5–10% растворы глю- козы♠, полионные растворы, кокарбоксилазу. • Профилактика ДВС-синдрома. Используют дезагреганты [пентоксифил- лин, ксантинола никотинат, дипиридамол], в начальном периоде показан гепарин♠ до 5000 ЕД/сут внутривенно капельно или подкожно, надропарин кальция по 0,3 мл/сут, эноксапарин натрия по 0,2 мл/сут. G Ангиопротекторы. Кальция глюконат, этамзилат, рутин♠. G Свежезамороженная плазма. G Ингибиторы протеаз (апротинин). G Антиоксидантная терапия. Витамин Е, убихинон♠. В олигурический период для борьбы с уремической интоксикацией проводят промывание желудка и кишечника 2% раствором пищевой соды, внутривенные инфузии 4% раствора натрия гидрокарбоната, объём введения рассчитывают в миллилитрах по формуле: 0,6×масса тела больного (кг) × ВЕ (ммоль/л). глю- кокортикоидов (в расчёте на преднизолон) — при ИТШ I стадии — 3–5 мг/кг в сутки, II стадии — 5–10 мг/кг в сутки, III стадии — 10–20 мг/кг в сутки. При отсутствии вазопрессивного эффекта от глюкокортикоидов показано введение допамина.
Лептоспироз
Лептоспироз (болезнь Васильева–Вейля, инфекционная желтуха, японская 7-дневная лихорадка, нанукаями, водная лихорадка, иктерогеморрагическая лихорадка и др.) — острая зоонозная природно-очаговая инфекционная болезнь с преимущественно водным путём передачи возбудителя, характеризующаяся общей интоксикацией, лихорадкой, поражением почек, печени, ЦНС, геморрагическим диатезом и высокой летальностью.
ЭтиологияРод Leptospira семейства Leptospiraceae представлен двумя видами: паразитическим — L. interrogans и сапрофитным — L. biflexa. Оба вида подразделяют на многочисленные серотипы. Последние — основная таксономическая единица, формирующая серологические группы. В основу классификации лептоспир положено постоянство их антигенной структуры. Лептоспиры — тонкие, подвижные микроорганизмы спиралевидной формы длиной от нескольких до 40 нм и более и диаметром от 0,3 до 0,5 нм. Оба конца лептоспир, как правило, загнуты в виде крючьев, но встречаются и бескрючковые формы. Лептоспиры имеют три основных структурных элемента: наружную обо- лочку, осевую нить и цитоплазматический цилиндр, который винтообразно закру- чен вокруг продольной оси. Размножаются они путём поперечного деления. Лептоспиры грамотрицательны. Это строгие аэробы; их выращивают на пита- тельных средах, содержащих сыворотку крови. Факторы патогенности лептоспир — экзотоксиноподобные вещества, эндотоксин, ферменты (фибрино- лизин, коагулаза, липаза и др.), а также инвазивная и адгезивная способность. Лептоспиры чувствительны к воздействию высоких температур: кипячение их убивает мгновенно, нагревание до 56–60 °С — в течение 20 мин. К действию низ- ких температур лептоспиры более устойчивы. В воде открытых водоёмов при слабощелочной или нейтральной её реакции лептоспиры сохраняются в течение 1 мес, а в сырой и переувлажнённой почве они не теряют патогенность до 9 мес. На пищевых про- дуктах лептоспиры сохраняются до 1–2 сут, а под воздействием ультрафиолета и при высушивании погибают в течение 2 ч. Лептоспиры чувствительны к препара- там пенициллина, хлорамфениколу, тетрациклину и чрезвычайно чувствительны к действию обычных дезинфицирующих средств, кипячению, солению и марино- ванию. При этом низкие температуры не оказывают губительного воздействия на лептоспиры. Этим объясняют их способность зимовать в открытых водоёмах и влажной почве, полностью сохраняя вирулентность
ЭпидемиологияС эпидемиологической точки зрения важна заболеваемость крупного и мелкого рогатого скота, а также свиней. Болеют животные любого возраста, но у взрослых лептоспироз протекает чаще в скрытой форме, а у молодняка — с более выражен- ными симптомами. Человек не имеет значения в качестве источника инфекции. Основной фактор передачи возбудителя лептоспироза — вода, загрязнённая выделениями (мочой) инфицированных животных. Непосредственными причи- нами заражения людей оказывается употребление сырой воды для питья, умы- вание из открытых водоёмов, купание в небольших слабопроточных прудах или переход их вброд. Некоторое значение в передаче инфекции имеют и пищевые продукты, загряз- нённые выделениями грызунов. Передача инфекции чаще всего происходит кон- тактным путём, однако возможен и пищевой путь. Факторами передачи бывают и влажная почва, трава пастбищ, загрязнённые выделениями больных животных. Заражение может происходить при забое скота, разделке туш, а также при упо- треблении в пищу молока и термически не обработанного мяса. Зачастую леп- тоспирозом заболевают лица, имеющие профессиональный контакт с больными животными: ветеринары, дератизаторы и сельскохозяйственные работники. Для проникновения лептоспир достаточно малейших нарушений целостности кожного покрова. Эпидемические вспышки лептоспироза приурочены, как правило, к летне- осеннему периоду. Пик заболеваемости приходится на август. Различают три основных типа вспышек: водный, сельскохозяйственный и животноводческий. Постинфекционный иммунитет прочный, но типоспецифический, поэтому воз- можны повторные заболевания, вызванные другими сероварами возбудителя.
ПатогенезВозбудитель проникает в организм человека благодаря своей подвижности. Входными воротами служат микроповреждения кожных покровов и слизистых оболочек полости рта, пищевода, конъюнктивы глаз и др. На месте внедрения возбудителя не воз- никает первичного аффекта. Дальнейшее распространение лептоспир происходит гематогенным путём, при этом лимфатические сосуды и регионарные лимфати- ческие узлы также остаются интактными. С током крови лептоспиры попадают в различные органы и ткани: печень, селезёнку, почки, лёгкие, ЦНС, где происходят их размножение и накопление. Развивается первая фаза инфекции продолжи- тельностью от 3 до 8 дней, что соответствует инкубационному периоду. Вторая фаза патогенеза лептоспироза — вторичная бактериемия, когда коли- чество лептоспир в крови достигает максимума и они ещё продолжают размно- жаться в печени и селезёнке, надпочечниках, обусловливая клиническое начало болезни. С током крови лептоспиры снова разносятся по всему организму, преодо- левая даже ГЭБ. В этот период наряду с размножением лептоспир начинается их разрушение как следствие появления антител, агглютинирующих к четвёртому дню болезни и лизирующих лептоспиры. Накопление в организме продуктов метаболизма и распада лептоспир сопровождается лихорадкой и интоксикацией, что повышает сенсибилизацию организма и вызывает гиперергические реакции. Эта фаза продолжается в течение 1 нед, однако может укорачиваться до несколь- ких дней. Максимальную концентрацию лептоспир к концу фазы лептоспиремии наблюдают в печени. Лептоспиры продуцируют гемолизин, который, оказывая влияние на мембрану эритроцитов, вызывает их гемолиз и высвобождение сво- бодного билирубина. Третья фаза патогенеза лептоспироза — токсическая. Лептоспиры гибнут вследствие бактерицидного действия крови и накопления антител, исчезают из крови и накапливаются в извитых канальцах почек. Накопленный вследствие гибели лептоспир токсин оказывает токсическое влияние на различные органы и системы. У части больных лептоспиры размножаются в извитых канальцах и выделяются из организма с мочой. В этом случае на первый план выступает пора- жение почек. Наиболее характерное поражение почек при лептоспирозе — деге- неративный процесс в эпителии канальцевого аппарата, поэтому их правильнее рассматривать как диффузный дистальный тубулярный нефроз. У больных появ- ляются признаки ОПН с олигоанурией и уремической комой. Тяжёлое поражение почек — одна из наиболее частых причин смерти при лептоспирозе. Токсин оказывает повреждающее действие на эндотелий капил- ляров, что повышает их проницаемость с формированием тромбов и развитием ДВС-синдрома. ЦНС поражается вследствие преодоления ГЭБ лептоспирами. У части больных развивается серозный или гнойный менингит, реже менингоэнцефалит. В отдельных случаях возникает специфический лептоспирозный миокардит. Патогномоничный симптом лептоспироза — развитие миозита с поражением скелетных, особенно икроножных мышц. Часто поражаются лёгкие (лептоспироз- ная пневмония), глаза (ириты, иридоциклиты), реже другие органы. Клиническая картинаИнкубационный период продолжается от 3 до 30 (чаще 7–10) дней. КлассификацияОбщепринятой классификации лептоспироза нет. По клиническому течению выделяют лёгкую, среднетяжёлую и тяжёлую форму лептоспироза. Лёгкая форма может протекать с лихорадкой, но без выраженного поражения внутренних органов. Среднетяжёлую форму характеризуют выражен- ная лихорадка и развёрнутая клиническая картина лептоспироза, а для тяжёлой формы характерны развитие желтухи, появление признаков тромбогеморрагиче- ского синдрома, менингита и острой почечной недостаточности. По клиническим проявлениям выделяют желтушные, геморрагические, ренальные, менингеальные и смешанные формы. Лептоспироз может быть осложнённым и неосложнённым.
Основные симптомы и динамика их развитияБолезнь начинается остро, без продромального периода, с сильного озноба, повышения температуры тела в течение 1–2 дней до высоких цифр (39–40 °С). Температура остаётся высокой в течение 6–10 дней, затем происходит её снижение или критически, или укороченным лизисом. У больных, не получавших антибио- тики, можно наблюдать вторую лихорадочную волну. Возникают и другие симпто- мы интоксикации, такие, как сильная головная боль, боль в пояснице, слабость, отсутствие аппетита, жажда, тошнота, иногда рвота. В этот период также может развиться конъюнктивит. Характерный признак лептоспироза — боль в мышцах, преимущественно икро- ножных, но может возникать боль в мышцах бедра и поясничной области. При тяжёлых формах боль настолько сильна, что затрудняет движения больного. При пальпации отмечают резкую болезненность мышц. Интенсивность миалгий часто соответствует тяжести течения болезни. Миолиз приводит к развитию миоглоби- немии, являющейся одной из причин развития ОПН. У части больных миалгию сопровождает гиперестезия кожи. Обращают на себя внимание гиперемия кожи лица и шеи, инъекция сосудов склер. При осмотре выявляют «симптом капю- шона» — одутловатость лица и гиперемию кожи лица, шеи и верхней половины грудной клетки, инъекцию сосудов склер. При тяжёлом течении лептоспироза с 4–5-го дня болезни возникают иктерич- ность склер и желтушность кожных покровов. Клиническое течение можно схема- тично разделить на три периода: · начальный; · разгара; · выздоровления. У 30% больных в начальном, а иногда и в периоде разгара болезни возникает экзантема. Сыпь состоит из полиморфных элементов, расположенных на коже туловища и конечностей. По характеру сыпь может быть кореподобной, краснухо- подобной, реже скарлатиноподобной. После исчезновения сыпи возможно отрубевидное шелушение кожи. Нередко появляются герпетические высыпания (на губах, кры- льях носа). Тромбогеморрагический синдром проявляется, помимо петехиальной сыпи, кровоизлияниями в кожу на местах инъекций, носовыми кровотечениями, кровоизлияниями в склеру. В этот период возможны небольшая боль в горле, покашливание. Возможно развитие специфической лептоспирозной пневмонии или бронхита. При её возникновении наблюдают притупление лёгочного звука и боль в грудной клетке. Печень увеличена, умеренно болезненна при пальпации, почти у половины больных пальпируется селезёнка. Признаками поражения ЦНС при лептоспирозе служат менингеальный син- дром: головокружение, бред, бессонница, головная боль и положительные менин- геальные симптомы (ригидность затылочных мышц; симптом Кернига; верхний, средний и нижний симптомы Брудзинского). При исследовании цереброспиналь- ной жидкости отмечают признаки серозного менингита: цитоз с преобладанием нейтрофилов. Со стороны мочевыделительной системы можно наблюдать признаки ОПН: снижение диуреза вплоть до развития олигоанурии, появление в моче белка, гиа- линовых и зернистых цилиндров, почечного эпителия. В крови увеличено содер- жание калия, мочевины, креатинина. Особого внима- ния заслуживает поражение почек: нарастающая азотемия, протеинурия. В результате гемолиза и нарушения эритропоэза нарастают анемия гипоре- генераторного типа, тромбоцитопения, лейкоцитоз, лимфопения, нарушается агрегационная способность тромбоцитов, СОЭ достигает 40–60 мм/ч. При био- химическом исследовании крови выявляют умеренную гипербилирубинемию с повышенным содержанием как связанного, так и свободного билирубина при небольшом повышении активности трансфераз. В то же время в связи с поражени- ем мышц резко возрастает активность креатинфосфокиназы, нарушается белково- синтетическая функция печени, снижается уровень альбумина. Состояние начинает улучшаться с конца второй недели, период реконвалесцен- ции с 20–25-го дня болезни. В этот период возможен рецидив болезни, который обычно протекает легче основной волны. В остальных случаях температура тела стойко нормализуется, но длительно сохраняется астенический синдром, возмо- жен полиурический криз. Функции печени и особенно почек восстанавливаются медленно, длительно сохраняется недостаточность функции канальцев, что про- является изогипостенурией и протеинурией; возможны трофические нарушения, нарастание анемии.
Диагностика Клиническая Важную роль в диагностике лептоспироза играет эпиданамнез. Следует учиты- вать профессию больного (сельскохозяйственный рабочий, охотник, ветеринар, дератизатор), а также контакт с дикими и домашними животными. Следует обра- тить внимание на то, купался ли пациент в открытых водоёмах, поскольку обсеме- нение воды лептоспирами в отдельных регионах чрезвычайно велико. Диагноз лептоспироза устанавливают на основании характерных клинических симптомов: острое начало, гипертермия, миалгия, гиперемия лица, сочетанное поражение печени и почек, геморрагический синдром, островоспалительные изме- нения в крови. Специфическая и неспецифическая лабораторная диагностика Лабораторное подтверждение диагноза получают при бактериоскопическом, бактериологическом, биологическом и серологическом исследованиях. В первые дни болезни лептоспиры обнаруживают в крови с помощью темнопольной микро- скопии, позднее в осадке мочи или СМЖ. При посеве крови, мочи или СМЖ на питательные среды, содержащие сыворот- ку крови, удаётся получить более достоверные результаты, хотя этот метод требует времени, поскольку, как уже было сказано, лептоспиры растут довольно медленно. Первичные посевы крови, мочи, тканей органов, подозрительных на содержание лептоспир, рекомендуют выдерживать первые 5–6 дней при температуре 37 °С, а затем при 28–30 °С. Биологический метод заключается в заражении животных: мышей, хомяков и морских свинок, однако в последнее время у этого метода появилось много про- тивников, считающих его негуманным. Наиболее информативны серологические методы, в частности реакция микро- агглютинации, рекомендованная ВОЗ. Положительным считают нарастание титра антител 1:100 и выше. Используют также РАЛ лептоспир в голландской модифи- кации. Антитела появляются поздно, не ранее 8–10-го дня болезни, поэтому целе- сообразно исследовать парные сыворотки, взятые с интервалом в 7–10 сут.
ЛечениеРежим. Диета Лечение осуществляют в условиях стационара. Госпитализацию проводят по эпидемиологическим показаниям. Режим в остром периоде постельный. Диету определяют клинические особенности болезни. При доминировании почечного синдрома — стол № 7, печёночного — стол № 5, при сочетанных пора- жениях — стол № 5 с ограничением соли или стол № 7 с ограничением жиров. Медикаментозная терапия Основной метод лечения — антибактериальная терапия, которую чаще прово- дят препаратами пенициллина в дозе 4–6 млн ЕД/сут или ампициллином в дозе 4 г/сут. При непереносимости пенициллина назначают доксициклин по 0,1 г два раза в сутки, хлорамфеникол в дозе 50 мг/кг в сутки. При поражении ЦНС дозу пенициллина повышают до 12–18 млн ЕД/сут, дозу ампициллина — до 12 г/сут, хлорамфеникола — до 80–100 мг/кг в сутки. Продолжительность антибиотикотерапии 5–10 сут. При ОПН в начальной стадии при снижении суточного количества мочи вну- тривенно вводят осмотические диуретики (300 мл 15% раствора маннитола, 500 мл 20% раствора глюкозы), 200 мл 4% раствора гидрокарбоната натрия в сутки в два приёма. В анурической стадии вводят большие дозы салуретиков (до 800–1000 мг/сут фуросемида), анаболические стероиды (метандиенон по 0,005 г 2–3 раза в сутки), 0,1 г/сут тестостерона. При ИТШ больному вводят внутривенно преднизолон в дозе до 10 мг/кг в сутки, допамин по индивидуальной схеме, затем последовательно внутривенно 2–2,5 л раствора типа трисоль♠ или квинтасоль♠, 1–1,5 л поляризующей смеси (5% раствор глюкозы, 12–15 г хлорида калия, 10–12 ЕД инсулина). Солевые растворы вначале вводят струйно, переходя затем на капельное введение (при появлении пульса и АД). При развитии ДВС-синдрома применяют свежезамороженную плаз- му, пентоксифиллин, гепарин натрия, ингибиторы протеаз. Показания к гемодиализу • Двух-, трёхдневная анурия. • Азотемия (мочевина крови 2,5–3 г/л и выше) в сочетании с: G ацидозом (рН крови менее 7,4); G алкалозом (рН крови более 7,4); G гиперкалиемией (выше 7–8 ммоль/л); G угрозой отёка лёгких и мозга. Используют гипербарическую оксигенацию. При выраженном геморрагиче- ском синдроме назначают 40–60 мг/сут преднизолона внутрь или внутривенно 180–240 мг/сут. Назначают также симптоматическое лечение, комплекс витаминов.
Сибирская язва
Сибирская язва (злокачественный карбункул, Anthrax, Pustula Maligna, болезнь тряпичников, болезнь сортировщиков шерсти) — острая сапрозоонозная инфек- ционная болезнь с преимущественно контактным механизмом передачи воз- будителя. Чаще всего протекает в доброкачественной кожной форме, реже — в генерализованной. Относят к опасным инфекциям. Возбудитель сибирской язвы рассматривают в качестве биологического оружия массового поражения (био- терроризм).
Этиология Возбудитель — крупная грамположительная неподвижная палочка Bacillus anthracis рода Bacillus семейства Bacillaceae, аэроб или факультативный анаэ- роб. Растёт на простых питательных средах, при доступе свободного кислорода образует споры. При благоприятных условиях (попадание в живой организм) образует вегетативную форму. Возбудитель содержит два капсульных полипеп- тидных и один соматический полисахаридный антигены. Вырабатывает экзоток- син, состоящий из белка и липопротеида, включает протективный антиген. Он взаимодействует с мембранами клеток и опосредует действие других компонентов: летального фактора, обладающего цитотоксическим действием и вызывающего отёк лёгких, и отёчного фактора, вызывающего повышение концентрации цАМФ и развитие тканевого отёка. Компоненты токсина вызывают токсический эффект только при совместном действии. Патогенность B. anthracis зависит от наличия капсулы и токсинообразования. Штаммы, не обладающие этими способностями, авирулентны. Капсула играет важную роль в начале инфекционного процесса, препятствуя фагоцитозу возбудителя. Токсин опосредует основные клинические проявления болезни. Вегетативные формы микроба малоустойчивы, при кипяче- нии гибнут мгновенно, дезинфицирующие растворы убивают их через несколько минут. В невскрытых трупах возбудитель сохраняется в течение 7 сут. Споры образуются после гибели хозяина, они чрезвычайно устойчивы, выдерживают кипячение до 30 мин, сохраняются при быстром высушивании, замораживании. Дезинфицирующие средства (1% раствор формалина, 10% раствор едкого натрия) убивают их за 2 ч. В почве они способны сохраняться на протяжении нескольких десятилетий (до 60 лет) и прорастать как при попадании в живой организм, так и в почве при наличии благоприятных условий.
Эпидемиология Резервуар инфекции — почва, в которой вследствие повторения биологиче- ских циклов (спора–вегетативная клетка) возбудитель длительно сохраняется и накапливается. Такая особенность B. anthracis способствует созданию долговре- менно активных почвенных очагов («проклятые» поля) и потенциально опасных территорий. Это приводит к периодическим эпизоотиям и случаям сибирской язвы у людей. Болезнь развивается при попадании в организм вегетативных клеток или спор возбудителя. Источники B. anthracis для человека — крупный (буйволы, коровы) и мелкий (козы, овцы) рогатый скот, лошади, верблюды, а также (в редких случаях) дикие животные (зайцы, волки, медведи, песцы и др.). Больные животные выделяют возбудитель с мочой, калом и другими выделения- ми.. Механизмы передачи возбудителя к человеку — контактный (при нарушении правил личной гигиены при уходе за больными животными, забое и разделке туш, снятии шкур, контакте с шерстью, шкурой и другими про- дуктами животноводства, контаминированными B. anthracis), аспирационный (воздушно-пылевым путём при вдыхании инфицированной пыли, костной муки), фекально-оральный (пищевой путь при употреблении мяса заражённого живот- ного) и трансмиссивный (через укусы слепней, мух-жигалок, комаров). Факторы передачи — почва, вода, воздух, пища, предметы быта, животные и продукты их жизнедеятельности, эктопаразиты. Различают три типа заболеваемости сибирской язвой: профессионально- сельскохозяйственный, профессионально-индустриальный и бытовой.
ПатогенезЗаражение происходит при попадании как вегетативной формы, так и спор возбудителя в организм человека, где они благодаря капсуле защищены от фаго- цитоза и продуцируют экзотоксин, вызывающий повреждение эндотелия сосудов. Микроциркуляторные нарушения и повышение проницаемости сосудов — важное звено патогенеза сибирской язвы. В результате этих изменений в местах раз- множения возбудителя (кожа, лимфатические узлы, лёгкие, кишечная стенка) развиваются серозно-геморрагическое воспаление, периваскулярные кровоизлия- ния, геморрагические инфильтраты, резкий отёк. При заражении аэрозольным и алиментарным путями возбудитель легко преодолевает лимфатический барьер, распространяется гематогенно. Инфекция принимает генерализованный харак- тер с массивным обсеменением органов (септицемия), сопровождаясь развитием ИТШ, тромбогеморрагического синдрома и полиорганной недостаточности. При перкутанном заражении генерализацию инфекции наблюдают редко. Воспаление ограничивается кожей, носит локальный характер, однако токсины вызывают повышенную проницаемость сосудов с развитием обширного отёка и местной анестезией.
Клиническая картинаИнкубационный период зависит от пути проникновения и инфицирующей дозы возбудителя. Выделяют кожную (наружную, локализованную) и генерали- зованную (внутреннюю, висцеральную, септическую) формы сибирской язвы. Генерализованные формымогут быть первичными (карбункул отсутствует) и вторичными (при наличии карбункула). Кожная форма подразделяется на карбункулёзный, эдематозный, буллёзный, рожистоподобный и глазной варианты, а генерализованная форма — на лёгочный, кишечный и септический варианты. Наиболее часто (95–98% всех случаев сибирской язвы) встречается кожная форма. Инкубационный период при кожной форме болезни составляет от 2 до 14 сут. При своевременной антибактериальной терапии заболевание протекает относительно доброкачественно и заканчивается выздоровлением. Чаще наблю- дается карбункулёзный вариант. В месте внедрения возбудителя (обычно на руках или голове) появляется крас- новатое или синеватое пятнышко, похожее на укус насекомого. Через несколько часов оно трансформируется в папулу медно-красного цвета, затем (в течение суток) в пузырёк, заполненный серозно-геморрагическим содержимым. Больных беспокоят жжение и зуд. При расчёсывании или спонтанно пузырёк вскрывается с образованием язвочки, покрытой тёмно-коричневым струпом, формируется сибиреязвенный карбункул. Он расположен на плотном инфильтрированном основании, окружён венчиком яркой гиперемии. Образующиеся вокруг дочер- ние пузырьки также вскрываются, поэтому размеры струпа увеличиваются до 0,5–3,0 см в диаметре и более. Вокруг карбункула развивается резкий распро- странённый отёк мягких тканей, имеющий желеобразную консистенцию. Болевая чувствительность в области карбункула и отёка из-за воздействия токсина на нервные окончания резко снижена или полностью отсутствует. Кожа в зоне отёка бледная. Регионарные лимфатические узлы плотные, подвижные, умеренно уве- личены, слегка чувствительны при пальпации. При локализации карбункула в области кисти или предплечья возможен лимфангит. После уменьшения отёка (8–10-й день болезни) струп возвышается над поверхностью кожи, под ним идут процессы рубцевания и эпителизации язвы. Через 10–30 дней струп отторгается, язва полностью рубцуется. Карбункулы могут быть единичными и множественны- ми (до десяти и более). При локализации карбункула на лице или на шее иногда развивается тяжело про- текающий эдематозный вариант кожной формы болезни. Обширный отёк распро- страняется на клетчатку грудной клетки и даже живота. При распространении отёка на мягкие ткани глотки возможна асфиксия. В зоне отёка образуются пузырьки, после вскрытия которых формируются обширные участки некроза. Возможен также буллёзный вариант (вместо типичного карбункула образуются пузыри, заполнен- ные серозно-геморрагическим экссудатом) и рожистоподобный вариант с наличием гиперемии кожи в области отёка. При кожной форме болезни общее состояние больного в первый день болезни остаётся удовлетворительным, на 2–3-й день появ- ляются озноб, слабость, головная боль, температура тела поднимается до 38–40 °С, отмечают тахикардию, артериальную гипотензию. Температура тела остаётся повы- шенной в течение 3–7 дней, затем критически падает до нормы, общее состояние пациента быстро улучшается, уменьшается отёк в области карбункула, а потом струп отторгается и наступает полное выздоровление. Первичная генерализованная форма сибирской язвы развивается при аэро- генном или алиментарном пути заражения и крайне редко — при внедрении воз- будителя через кожу или слизистую оболочку (например, губ). При этом в месте внедрения возбудителя карбункул не формируется. Генерализованная форма характеризуется бурным началом, потрясающим ознобом, гипертермией, резко выраженными симптомами интоксикации, головной болью, рвотой, тахикардией, прогрессирующей гипотензией, глухостью тонов сердца. Часто увеличиваются печень и селезёнка, появляются геморрагическая сыпь на коже, цианоз, симптомы поражения ЦНС. При лёгочном варианте в первый день болезни возможны голов- ная боль, боли в мышцах, катаральные явления, поэтому часто диагностируют ОРЗ или грипп, но уже через несколько часов развивается интоксикационный синдром, температура достигает 39–41 °С и на первый план выступают такие сим- птомы, как чувство удушья, боли в грудной клетке при дыхании, одышка, кашель с пенистой кровянистой мокротой, которая быстро сворачивается в виде желе. Кожа становится бледной, возникают тахикардия, глухость тонов сердца, быстро про- грессирует падение АД. Стремительно нарастают симптомы ДН. При перкуссии грудной клетки выявляют укорочение перкуторного звука и ослабление дыхания в нижних отделах лёгких в связи с развитием плеврита. Выслушиваются разнока- либерные влажные хрипы. Смерть наступает на 2–3-й день болезни от ИТШ и ДН. Летальность составляет 80–100%. Положительный прогноз возможен при начале комплексной терапии до развития картины шока. Для кишечного варианта болезни, помимо общих симптомов, с первого дня болезни характерны режущие боли, преимущественно в нижней части живота, кровавая рвота, частый жидкий стул с примесью крови, быстро развивающиеся парез кишечника и перитонит. Исход также неблагоприятный. При всех вариантах болезни возможны осложнения: ИТШ, сепсис, менингит, ОДН.
ДиагностикаДиагноз кожной формы болезни устанавливают на основании характерных местных изменений: наличия чёрного струпа с венчиком гиперемии («чёрный уголёк на красном фоне»), студенистого безболезненного отёка и регионарного лимфаденита, появления общих симптомов после формирования карбункула. Особое значение для диагностики имеют эпидемиологические данные. Основу этиологической лабораторной диагностики составляют: ·бактериологические исследования, проходящие в три этапа: микроскопия мазков из патологического материала, выделение на питательных средах чистой культуры возбудителя и изучение его свойств, биологическая проба на лабораторных животных; ·выявление генетического материала возбудителя методом ПЦР; ·серологические исследования; · иммуногистохимические исследования; · кожно-аллергическая проба с антраксином. При подозрении на кожную форму для бактериологического исследования берут содержимое пузырьков или карбункулов, отделяемое язвы, отторгнутый струп и кровь. Если предполагают генерализованную форму, для лабораторного исследования берут кровь из локтевой вены, мочу, рвотные массы, испражнения, СМЖ (при наличии симптомов менингита), мокроту. При бактериологическом исследовании возбудитель обнаруживают методом бактериоскопии и люминесцентной микро- скопии. В материале бактерии располагаются парами или в виде цепочек, окру- жённых общей капсулой. Споры, как правило, расположены по центру. Из серологических методов для подтверждения диагноза используют метод флюоресцирующих антител, РНГА (РПГА), ИФА. При подозрении на кожную форму сибирской язвы можно выполнить пункци- онную биопсию кожи в центре первичного аффекта с последующим иммуноги- стохимическим исследованием полученного материала или окраской серебром. Разработаны тест-системы для определения генетического материала возбудителя сибирской язвы методом ПЦР. Применяют кожно-аллергическую пробу с антрак- сином, которая с 3-го дня болезни становится положительной в 82% случаев. При подозрении на кишечный вариант показано УЗИ органов брюшной полости, при клинических признаках менингита — ЛП. В крови обнаруживают умеренно выраженные воспалительные изменения, тромбоцитопению, при иссле- довании мочи — признаки токсического нефроза.
Лечение Режим — постельный до нормализации температуры. Диета — стол № 13, в тяжёлых случаях — энтерально-парентеральное питание. Лечение сибирской язвы включает этиотропную и патогенетическую терапию, проводимую в зависимости от формы болезни и имеющихся клинико-лабораторных синдромов
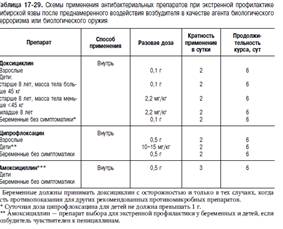
Одновременно с этиотропной терапией однократно вводят специфический противосибиреязвенный иммуноглобулин в дозе 20–100 мл внутримышечно (доза зависит от тяжести состояния). Местная терапия заключается только в обработке поражённых участков кожи растворами антисептиков. Повязки не накладывают. Хирургическое вмешательство противопоказано, поскольку оно способствует генерализации инфекции. При развитии ИТШ, распространённых отёков лица и шеи рекомендуется вводить преднизолон в дозе 90–240 мг. По индивидуальным показаниям проводят дезинтоксикационную терапию. При генерализованной форме болезни антибиотикотерапию сочетают с интенсивной дезинтоксикацией, мероприятиями, направленными на борьбу с гемодинамическими нарушениями. Применяют внутривенные перфузии полиионных растворов в объёме, необходи- мом для восстановления объёма циркулирующей крови, микроциркуляции, водно- электролитного баланса (2–5 л), ежедневно с добавлением 100 мл полиглюкина, реополиглюкина или гемодеза. Используют оксигенотерапию, гипербарическую оксигенацию, методы экстракорпоральной детоксикации.
Бруцеллёз
Бруцеллёз (лихорадка мальтийская, лихорадка гибралтарская, лихорадка сре- диземноморская, лихорадка ундулирующая, болезнь Банга, болезнь Брюса, мели- тококкоз, мелитококция) — зоонозная инфекционная болезнь с многообразными механизмами передачи возбудителя, характеризующаяся лихорадкой, поражени- ем опорно-двигательного аппарата, нервной системы, половых органов.
ЭтиологияВозбудители — представители рода Brucella семейства Brucellaceae. Бруцеллёз человека может быть обусловлен четырьмя видами бруцелл: B. melitensis, В. abortus, В. suis и B. canis. Наиболее частая причина болезни — Brucella melitensis, которая подразделяется на три биотипа. Основные хозяева — овцы и козы. Несколько реже встречаются Brucella abortus, представленные девятью биотипами; основной хозяин — крупный рогатый скот. У третьего вида бруцелл, Brucella suis, выделяют 4 биотипа. Основные хозяева — свиньи (типы 1–3), зайцы (тип 2) и северный олень (биотип 4). Относительно редко диагностируют заболевание, обусловленное Brucella canis. Основной хозяин данного микроорганизма — собаки. Бруцеллы отличаются выраженным полиморфизмом, они могут быть шаровид- ной, овальной и палочковидной формы. Размер их равен 0,3–0,6 мкм для кокко- вых и 0,6–2,5 мкм для палочковидных форм. Они неподвижны, спор не образуют, жгутиков не имеют, грамотрицательны. Растут медленно на сложных питатель- ных средах. Бруцеллы — внутриклеточные паразиты, они антигенно однородны, содержат эндотоксин. Отличаются значительной изменчивостью и переходят из S-формы в K- и L-формы. Бруцеллы устойчивы в окружающей среде. ПрофилактикаОсновное направление — профилактика бруцеллёза у сельскохозяйственных животных: предупреждение заноса в благополучные хозяйства, систематические обследования и выбраковка больных животных в неблагополучных хозяйствах, вакцинация животных, гигиеническое содержание и дезинфекция помещений, в которых находятся животные. Лица, ухаживающие за ними, должны носить спец- одежду, систематически обследоваться на бруцеллёз. Обязательны пастеризация молока, выдерживание брынзы не менее 2 мес, а твёрдых сыров — 3 мес. Работникам животноводства (а по показаниям — населению неблагополучных районов) вводят бруцеллёзную сухую живую вакцину (надкожно в объёме 2 капель или подкожно — 5 мл). Ревакцинацию проводят в половинной дозе через 10–12 мес.
ЭпидемиологияРезервуар и источник возбудителя — домашние животные (овцы, козы, коровы, свиньи, реже собаки). Хотя к бруцеллёзу чувствительны дикие животные (зайцы, северные олени), природных очагов инфекции нет. Бруцеллёз распространён во многих странах мира (до 500 тыс. случаев в год), особенно в регионах с животно- водческой ориентацией сельского хозяйства. В России бруцеллёз регистрируют в Республике Дагестан, Краснодарском и Ставропольском крае, на Южном Урале, Алтае, в Республике Тыва. Человек заражается от больных животных контактным, алиментарным, редко — аэрогенным путём. Заражение контактным путём носит профессиональ- ный характер, особенно часто происходит при попадании на кожу околоплодной жидкости (помощь при отёлах, ягнении, при уходе за новорождёнными телятами, ягнятами). Часто заражаются ветеринарные работники, телятницы, чабаны и др. Заражение может наступить и при контакте с мясом инфицированных живот- ных. Алиментарное заражение часто происходит при употреблении непастери- зованного молока или приготовленных из него продуктов (брынза, сыр, масло). Аэрогенное заражение возможно при попадании в дыхательные пути пыли, содержащей бруцеллы (в местах выпаса и в загонах для содержания овец), а также в лабораториях при нарушении техники безопасности. Этот путь инфицирования наблюдают относительно редко. Чаще заболевают лица трудоспособного возраста (18–50 лет). Восприимчивость высокая. Инфицирующая доза составляет всего от 10 до 100 микробных тел. Постинфекционный иммунитет ненапряжённый, через 5–6 лет возможна реинфекция.
ПатогенезВходные ворота инфекции — микротравмы кожи, слизистые оболочки органов пищеварения и респираторного тракта. В месте внедрения возбудителя изменений не наблюдают. По лимфатическим путям бруцеллы достигают регионарных лим- фатических узлов, но и здесь выраженные изменения отсутствуют. Размножение и накопление бруцелл происходит преимущественно в лимфатических узлах, из которых они периодически поступают в кровь, а гибель сопровождается освобож- дением эндотоксина, вызывающего лихорадку, поражение вегетативной нервной системы. С кровотоком возбудитель разносится по всему организму, концентриру- ясь в органах и тканях, богатых макрофагами (печень, селезёнка, мышцы, фасции, суставные сумки, сухожилия), где вследствие незавершённого фагоцитоза дли- тельно сохраняется, вызывает воспалительную реакцию с образованием специфи- ческих гранулём. Для бруцеллёза характерна выраженная аллергическая перестройка организма, резко выражена ГЗТ, сохраняющаяся длительное время даже после освобождения организма от возбудителя. Аллергия играет большую роль в формировании вторич- ных очагов инфекции. Бруцеллёз отличается склонностью к хроническому течению, что связано с длительным персистированием бруцелл в организме. До введения в лечебную практику антибиотиков бруцеллы сохранялись в организме до двух лет, более длительное течение болезни связано с влиянием антибиотиков: часть бруцелл может переходить в L-формы и длительно сохраняется внутриклеточно.
Клиническая картинаИнкубационный период при остром начале бруцеллёза продолжается около 3 нед. Единой класси- фикации не существует. Наиболее обоснована классификация клинических форм бруцеллёза, предло- женная Н.И. Рагозой (1952) и построенная на клинико-патогенетическом принци- пе. Н.И. Рагоза показал фазность динамики бруцеллёзного процесса. Он выделил четыре фазы: · компенсированной инфекции (первично-латентная); ·острого сепсиса без местных поражений (декомпенсация), ·подострого или хронического рецидивирующего заболевания с образованием местных поражений (декомпенсация или субкомпенсация); · восстановления компенсации с остаточными явлениями или без них. С этими фазами тесно связаны и выделены пять клинических форм бруцеллёза: · первично-латентная; ·остросептическая; ·первично-хроническая метастатическая; ·вторично-хроническая метастатическая; ·вторично-латентная. В качестве отдельного варианта выделена септико-метастатическая форма, к которой относят те случаи, когда на фоне остросептической формы обнаруживают отдельные очаговые изменения (метастазы). В классификации показана динамика дальнейшего развития каждой выделенной формы. Первично-латентная форма бруцеллёза характеризуется состоянием практиче- ского здоровья. Включение её в классификацию клинических форм обусловлено тем, что при ослаблении защитных сил организма она может перейти или в остро- септическую или в первично-хроническую метастатическую форму. При тща- тельном обследовании лиц с этой формой бруцеллёзной инфекции иногда можно обнаружить микросимптомы в виде небольшого увеличения периферических лимфатических узлов, субфебрилитета, повышенной потливости при физическом напряжении. Однако эти лица считают себя здоровыми и полностью сохраняют работоспособность. Остросептическая форма характеризуется высокой лихорадкой (39–40 °С и выше), температурная кривая имеет в ряде случаев тенденцию к волнообразному течению, нередко неправильного (септического) типа с большой суточной ампли- тудой, повторными приступами озноба и пота. Несмотря на высокую и очень высокую температуру тела, самочувствие больного остаётся удовлетворительным (при температуре 39 °С и выше больной может читать, смотреть телевизор и т.д.). Отсутствуют и другие признаки общей интоксикации. Без антибиотикотерапии лихорадка может длиться 3–4 нед и более. Эта форма не угрожает жизни больного и даже без этиотропного лечения заканчивается выздоровлением. По клиническим проявлениям первично- и вторично-хронические метастатические формы бру- целлёза ничем не различаются. Единственное отличие — наличие или отсутствие остросептической формы в анамнезе. Клинически хронические формы характеризуются синдромом общей инток- сикации, на фоне которой наблюдают ряд органных поражений. Отмечают дли- тельный субфебрилитет, слабость, повышенную раздражительность, плохой сон, нарушение аппетита, снижение работоспособности. Почти у всех больных наблю- дают генерализованную лимфаденопатию, причём наряду с относительно недавно появившимися увеличенными узлами (мягкие, чувствительные или болезненные при пальпации) отмечают мелкие, очень плотные безболезненные склерозирован-ные лимфатические узлы (0,5–0,7 см в диаметре). Наиболее типично поражение опорно-двигательного аппарата. Больные жалу- ются на боли в мышцах и суставах, преимущественно в крупных. Для бруцеллёза характерен полиартрит, при каждом обострении в процесс вовлекаются новые суставы. Чаще поражаются коленный, локтевой, плечевой, тазобедренный суста- вы, редко — мелкие суставы кисти и стоп. Нарушение подвижности и деформация суставов обусловлены разрастанием костной ткани. Поражается позвоночник, чаще в поясничном отделе. Информативен симптом Эриксена: больного укладывают на перевязочный стол и производят давление на гребень подвздошной кости при положении на боку или сдавливают обеими руками передние верхние гребни подвздошных костей в положении на спине. При одностороннем сакроилеите возникают боли на поражённой стороне, при двустороннем отмечают боли в крестце с двух сторон. При хронических формах бруцеллёза часто поражаются не только суставы, но и мышцы. Миозиты проявляются тупыми, продолжительными болями в пора- жённых мышцах, интенсивность их нередко связана с изменениями погоды. При пальпации, чаще в мышцах конечностей и поясницы, определяют более болезнен- ные участки, а в толще мышц прощупывают болезненные уплотнения различных размеров и формы. Чаще они пальпируются в виде тяжей, валиков, реже имеют округлую или овальную форму. Со временем в одном участке изменения мышц проходят, но появляются воспалительные очаги в других мышечных группахИзменения половой системы у мужчин выражены орхитом, эпидидимитом; снижена половая функция. У женщин наблюдают сальпингит, метрит, эндометрит. Возникает аменорея, может развиться бесплодие. У беременных часты абор- ты, мертворождения, преждевременные роды. Описан врождённый бруцеллёз у детей. Иногда наблюдают поражения глаз (ирит, хориоретинит, увеит, кератиты, атро- фия зрительного нерва и др.). При аэрогенном заражении часто развиваются вялотекущие бруцеллёзные пневмонии, которые безуспешно лечатся антибиотиками. Возможны миокардит, эндокардит, аортит и другие поражения сердечно- сосудистой системы. Вторично-хроническая форма протекает так же, как и первично-хроническая. И та и другая заканчивается переходом во вторично-латентную форму, может неоднократно рецидивировать. Вторично-латентная форма отличается от первично-латентной тем, что она зна- чительно чаще переходит в манифестные формы (рецидивирует); кроме того, на фоне вторичной латенции возможно развитие различных резидуальных явлений после хронических форм (ограничение подвижности суставов, бесплодие, наруше- ние зрения и т.д.). Течение бруцеллёза зависит от вида возбудителя.
Диагностикаобщий анализ крови, мочи (в динамике два раза), кал на яйца глистов, биохими- ческое исследование крови (концентрация билирубина, активность АЛТ, АСТ), кровь на Brucellae spp., анализ крови на реакцию Райта, Хеддлсона, РПГА с бру- целлёзным эритроцитарным диагностикумом, реакция Кумбса (в динамике два раза), проба Бюрне, ЭКГ, УЗИ внутренних органов, рентгенография позвоночника, суставов, консультация врача-офтальмолога, невролога (по показаниям). При диагностике бруцеллёза учитывают эпидемиологические предпосылки. Во многих районах средней полосы и юго-запада России у животных бруцеллёз давно уже ликвидирован — следовательно, условия для заражения людей отсутствуют. В этих регионах бруцеллёз — «завозная» инфекция. Необходимо уточнить пре- бывание в местах, где бруцеллёз ещё встречают. Лабораторное подтверждение бруцеллёза ограничено, поскольку бруцеллы относятся к опасным возбудителям. Их выделение можно проводить только в специальных лабораториях, оборудованных в соответствии с требованиями про- филактики. При серологических и аллергологических исследованиях необходимо учитывать, что у привитых против бруцеллёза (прививают группы риска, профес- сионально контактирующие с животными) довольно долго могут быть положи- тельными результаты и серологических реакций, и особенно аллергических проб. Из серологических реакций наиболее информативна РА (реакция Райта). Агглютинацию на стекле (реакция Хеддлсона) для диагностики не используют. При остросептической форме бруцеллёза антитела можно определить на 2-й неделе болезни, в дальнейшем титр их нарастает. Аллергическая проба стано- вится положительной в конце первой и на 2-й неделе. При хронических формах нарастания титра антител часто не обнаруживают. Следует учитывать, что поста- новка аллергической пробы (проба Бюрне) может спровоцировать появление антител или нарастание их титра. Другие серологические реакции: РПГА, остро- фазовые реакции — менее информативны по сравнению с реакцией Райта и не имеют существенного значения. В последние годы применяют более чувствитель- ный метод ИФА для определения IgG- и IgM-антител. Отрицательные результаты пробы Бюрне позволяют исключить бруцеллёз (кроме ВИЧ-инфицированных, у которых исчезают все реакции ГЗТ).
ЛечениеПринципы и методы терапии бруцеллёза зависят от его клинической формы. В соответствии с «Федеральными стандартами объема медицинской помощи, оказываемой больным бруцеллёзом» длительность госпитализации составляет 26 дней для больных острым бруцеллёзом и 30 дней — хроническим. Комплекс терапии включает антибактериальную терапию, нестероидные противовоспали- тельные средства (НПВС), глюкокортикоиды, десенсибилизирующую, дезинток- сикационную, вакцино-, иммуно-, физиотерапию и санаторно-курортное лече- ние. Антибактериальную терапию проводят при остросептической и других формах болезни при наличии лихорадочной реакции. Продолжительность лечения состав- ляет 1,5 мес. Рекомендуют одну из схем: Доксициклин внутрь по 100 мг два раза в сутки + стрептомицин в/м по 1 г/сут (первые 15 дней); Доксициклин внутрь по 100 мг два раза в сутки + рифампицин внутрь по 600– 900 мг/сут в 1–2 приёма; Ко-тримоксазол внутрь по 960 мг два раза в сутки + рифампицин внутрь по 600 мг 1–2 раза в сутки или стрептомицин в/м по 1 г один раз в сутки. Эффективны также комбинации доксициклина с гентамицином и рифампицина с офлоксацином. В связи с высокой эффективностью антибиотиков вакцинотерапию применяют редко. Используют лечебную бруцеллёзную вакцину. Лечебная бруцеллёзная вакцина — взвесь бруцелл овечьего и бычьего вида, инактивированных (для внутрикожного введения) либо убитых нагреванием (для внутривенного введения), выпускается в ампулах с точным указанием количества микробных клеток в 1 мл. Стандартная концентрация лечебной бруцеллёзной вакцины — 1 млрд микробных клеток в 1 мл вакцины. Рабочая концентрация предусматривает 500 тыс. микробных клеток в 1 мл. Наибольшее распространение получило подкожное и внутрикожное введение вакцины. Важный принцип вакцинотерапии — инди- видуальный подбор дозы препарата. О выраженности реакции судят по интенсив- ности пробы Бюрне. Подкожное введение чаще начинают с 10–50 млн микробных клеток. Если местная и общая реакция отсутствуют, то вакцину в увеличенной дозе вводят уже на следующий день. Следующую инъекцию вакцины делают лишь после того, как исчезнет реакция на предыдущее введение вакцины. Разовую дозу в конце курса доводят до 1–5 млрд микробных клеток. Внутрикожная вакцинотерапия более щадящая. С целью десенсибилизации при всех формах бруцеллёза применяют анти- гистаминные препараты (хлоропирамин, мебгидролин, прометазин). При пора- жении опорно-двигательного аппарата (артрит, полиартрит) показаны НПВС: диклофенак, ибупрофен, индометацин, мелоксикам, нимесулид и др. При неэф- фективности НПВС их сочетают с глюкокортикоидами (преднизолон, дексаме- тазон, триамцинолон) в средних терапевтических дозах (30–40 мг преднизолона перорально) со снижением дозы через 3–4 дня. Продолжительность курса лечения 2–3 нед. Глюкокортикоиды показаны также при поражении нервной системы, орхитах. Хронические формы болезни, протекающие с обострением, при наличии изме- нений в иммунном статусе указывают на иммуносупрессию. Это показание к назначению иммуномодуляторов (имунофан♠, полиоксидоний♠ и др.). При поражениях опорно-двигательного аппарата и периферической нервной системы рекомендуют физиотерапию (индуктотерапия, электрофорез новокаина, лидазы, димексида; ультравысокочастотная терапия, ионогальванотерапия, приме- нение озокерита, парафиновых аппликаций, массаж, лечебная гимнастика и др.). После того как признаки активности процесса изчезают, назначают баль- неотерапию. Преимущество отдают местным курортам. При нейровегетативных нарушениях показаны гидрокарбонатные, гидросульфатно-сероводородные, радо- новые воды. При поражениях опорно-двигательного аппарата и периферической нервной системы эффективна грязетерапия.
Туляремия
Туляремия (лат. tularemia; чумоподобная болезнь, кроличья лихорадка, малая чума, мышиная болезнь, лихорадка от оленьей мухи, эпидемический лимфа- денит) — острая зоонозная бактериальная природно-очаговая инфекционная болезнь с разнообразными механизмами передачи возбудителя. Характеризуется лихорадкой, интоксикацией, воспалительными изменениями в области входных ворот инфекции, регионарным лимфаденитом.
ЭтиологияВозбудитель — Francisella tularensis, род Francisella, семейство Brucellaceae. Грамотрицательная полиморфная (преимущественно кокковидная) неподвижная палочка, не образующая спор и капсул. Факультативный анаэроб. Возбудитель требователен к условиям культивирования, растёт на питательных средах с добав- лением цистеина или яичного желтка, кроличьей дефибринированной крови, тканевых экстрактов (печени, селезёнки, мозга) и других стимуляторов роста. Из лабораторных животных повышенной восприимчивостью к туляремии обладают белые мыши и морские свинки. Микроорганизм содержит соматический (О) и оболочечный (Vi) антигены, с которыми связаны вирулентность и иммуногенные свойства возбудителя. Основной фактор патогенности — эндотоксин. F. tularensis устойчива в окружающей среде, особенно при низких температурах и высокой влажности (выживает при –300 °С, сохраняется во льду до 10 мес, в замо- роженном мясе — до 3 мес). Возбудитель менее устойчив к высыханию В то же время F. tularensis весьма чувстви- тельна к инсоляции, ультрафиолетовому облучению, ионизирующей радиации, высокой температуре и дезинфицирующим средствам (под действием растворов лизола, хлорамина, хлорной извести, сулемы погибают за 3–5 мин).
ЭпидемиологияСреди домашних животных резервуаром инфекции могут быть овцы, свиньи, крупный рогатый скот, лошади, но заражение людей чаще всего происходит в природных очагах при прямом и косвенном контакте с грызунами. Больной человек не может быть источником инфекции для окружаю- щих. Переносчики инфекции, поддерживающие существование возбудителя в при- родных очагах, — кровососущие насекомые (иксодовые и гамазовые клещи, кома- ры, слепни). В организм человека возбудитель может проникать через микротравмы кожно- го покрова и неповреждённую слизистую оболочку миндалин, ротоглотки, ЖКТ, дыхательных путей, глаз. Различают четыре механизма передачи возбудителя: · контактный — при контакте с инфицированными грызунами (разделка туш, снятие шкурок) и водой (купание, умывание, полоскание белья); ·алиментарный — при употреблении инфицированных, термически необрабо- танных продуктов и воды; ·аэрозольный — при вдыхании инфицированной пыли через рот и нос во время веяния и обмолота зерна, скирдования сена и соломы; ·трансмиссивный (основной) — при укусе инфицированных кровососущих насекомых или их раздавливании. Лёгочная форма туляремии возникает при аэрозольном заражении, ангинозно- бубонная и абдоминальная — при алиментарном, язвенно-бубонная и глазобубон- ная — при трансмиссивном и контактном заражении. Восприимчивость людей к туляремии высокая (достигает 100%). Отмечают летне-осеннюю сезонность. Заражение человека происходит преимущественно в сельской местности, но в последние годы среди заболевших преобладают жители городов (до 2/3), что связано со стремлением горожан отдыхать на природе, а также с употреблением термически не обработанных сельскохозяйственных продуктов. Лица, перенёсшие заболевание, приобретают стойкий, продолжительный, но не абсолютный иммунитет.
Меры профилактикиСпецифическая профилактика Основа специфической профилактики — вакцинация лиц старше семи лет, пребывающих или работающих на территории, эндемичной по туляремии. Применяют живую сухую туляремийную вакцину На 5–7-й и 12–15-й день оценивают напряжённость иммуните- та. Если результат отрицательный, проводят повторную вакцинацию. Состояние иммунитета у вакцинированных проверяют через пять лет после прививки и в последующем — один раз в два года. Ревакцинацию проводят при отрица- тельных результатах иммунологических (аллергических или серологических) реакций. Необходимость в вакцинации определяют территориальные центры Госсанэпиднадзора на основании анализа эпидемиологической обстановки на под- ведомственной территории. Различают плановую и внеплановую (по эпидемиче- ским показаниям) вакцинацию. Состояние иммунитета в популяции определяют путём выборочной проверки взрослого работоспособного населения с помощью аллергических или серологи- ческих методов: РА, РПГА, ИФА. Ревакцинацию проводят при уровне ИИП ниже 70% в лугополевых очагах и менее 90% — в пойменно-болотных очагах, а также по эпидемическим показаниям. Неспецифическая профилактика предусматривает контроль за природными очагами туляремии, своевременное выявление эпизоотий среди диких животных, проведение дератизационных и дезинсекционных мероприятий. При водной вспышке запрещают употреблять некипячёную воду и купаться, а при заражении колодезной воды принимают меры к очистке колодца от трупов грызунов и проводят дезинфекцию воды.
ПатогенезF. tularensis проникает в организм человека через кожу (даже внешне не повреж- дённую) и слизистые оболочки глаз, дыхательных путей, миндалин и ЖКТ. При инфицировании через кожу или аэрогенным путём для развития болезни доста- точно пятидесяти жизнеспособных микроорганизмов, а при алиментарном зара- жении — более 108 микробных клеток. В месте входных ворот инфекции происходит размножение возбудителя с раз- витием некротически-воспалительной реакции и первичного аффекта (кожная язва, проходящая стадии папулы, везикулы и пустулы; на миндалинах — некроти- ческая ангина, в лёгких — очаговая некротическая пневмония, на конъюнктиве — конъюнктивит). Затем возбудитель проникает в регионарные лимфатические узлы, вызывая развитие специфического лимфаденита — первичного бубона. Здесь происходит частичная гибель бактерий, сопровождаемая выделением эндо- токсина (ЛПС-комплекс), усиливающего местный воспалительный процесс и вызывающего развитие интоксикации при поступлении в кровь. В ряде случаев возбудитель преодолевает лимфатический барьер и распро- страняется гематогенно (генерализация процесса), вызывая поражение других групп лимфатических узлов, не связанных с местом внедрения микроорганизма (вторичные бубоны) и внутренних органов (печень, селезёнка, лёгкие). Гибель возбудителя, циркулирующего в крови, и высвобождение эндотоксина усугубляют интоксикацию. Существенную роль в патогенезе заболевания играют специфиче- ская сенсибилизация и аллергизация организма. Для туляремии характерен гранулематозный тип воспаления как следствие незавершённого фагоцитоза. Гранулёмы образуются в лимфатических узлах и внутренних органах (обычно в печени и селезёнке) из эпителиальных клеток, полиморфно-ядерных лейкоцитов и лимфоцитов. По внешнему виду и клеточному составу туляремийные гранулёмы напоминают таковые при туберкулёзе. Они под- вержены некрозу и нагноению с последующим замещением соединительной тка- нью. В местах скопления гранулём возможно образование абсцессов.. Наиболее ярко гранулематозный процесс выражен в регионарных лимфатиче- ских узлах, где развивается первичный лимфаденит (бубон). При его нагноении и вскрытии на коже образуется длительно не заживающая язва. Во вторичных бубонах нагноения обычно не происходит. При аэрозольном заражении наиболее выраженные изменения в виде фокусов альвеолярного некроза, инфильтрации и формирования гранулём наблюдают в трахеобронхиальных лимфатических узлах и лёгочной паренхиме. В сердце и поч- ках отмечают дистрофические изменения, в кишечнике — поражение пейеровых бляшек и мезентериальных лимфатических узлов.
Клиническая картинаИнкубационный период составляет от нескольких часов до 3 нед (в среднем 3–7 дней 
По тяжести инфекционного процесса различают лёгкие, средней тяжести и тяжёлые формы туляремии. По длительности течения выделяют острую (до 3 мес), затяжную (до 6 мес), рецидивирующую формы туляремии и, кроме того, инаппарантную (бессимптом- ную, латентную) туляремию, которую обнаруживают преимущественно во время эпидемических вспышек при лабораторном исследовании. Туляремия протекает циклически. Выделяют следующие периоды заболевания: инкубационный, начальный, период разгара и выздоровления. Симптомы начального периода одинаковы при всех клинических фор- мах. Типично острое начало: с озноба, лихорадки и симптомов интоксикации. Температура в течение нескольких часов поднимается до 38–40 °С и выше. Одновременно возникают головная боль, головокружение, слабость, разбитость, мышечные боли (особенно в поясничной области и икроножных мышцах), ухуд- шение аппетита, нарушения сна, повышенная потливость. Продолжительность начального периода 2–3 дня. Позже возникают признаки, характерные для той или иной клинической формы, но общие симптомы для всех форм — лихорадка, характерный внешний вид больного и интоксикация. Продолжительность лихорадочного периода 2–3 нед (от 5–7 до 30 дней), но иногда, при рецидивирующем течении или присоединении осложнений, он может удлиняться до нескольких месяцев. Характер температурной кривой может быть различным: ремиттирующим (преимущественно), неправильно интермиттирую- щим, постоянным, ундулирующим. Период реконвалесценции может сопрово- ждаться длительным субфебрилитетом. Характерен внешний облик больных: лицо одутловато и гиперемировано, в тяжёлых случаях — синюшно-багрового цвета (особенно вокруг глаз, губ, мочек ушей). Бубонная (гландулярная) форма возникает в результате контактного или транс- миссивного заражения. Бубон обычно локализуется в области паховых, бедрен- ных, локтевых и подмышечных лимфатических узлов. Лимфаденит обнаруживают через 2–3 дня после начала болезни. Постепенно увеличиваясь, лимфатические узлы достигают максимального размера к 5–8-му дню болезни. При вовлечении в процесс группы регионарных лимфатических узлов возможно образование конгломерата с признаками периаденита. Размеры бубона могут варьировать от величины лесного ореха до 10 см. Окраска кожи над бубоном сначала не измене- на; подвижность ограничена, болезненность выражена слабо. Эволюциябубона различна. Чаще всего происходит полное рассасывание (с конца 2-й недели) или склерозирование. Реже отмечают нагноение (с конца второй — начала третьей недели) и самопроизвольное вскрытие бубона с последующим рубцеванием. Различают первичные (вследствие лимфогенного распространения возбуди- теля) и вторичные (при гематогенном распространении возбудителя) бубоны. Вторичные бубоны не связаны с входными воротами, они меньше первичных, не нагнаиваются и полностью рассасываются. Исход и продолжительность бубонной формы туляремии зависят от своевре- менности специфической терапии. Без полноценного лечения длительность забо- левания может составлять 3–4 мес и более. При язвенно-бубонной(ульцерогландулярной) форме туляремии, в отличие от бубонной, в месте внедрения возбудителя образуется первичный аффект. Она обычно развивается при трансмиссивном, реже — при контактном заражении. Местный процесс проходит стадии пятна, папулы, везикулы и пустулы, которая, вскрываясь, преобразуется в безболезненную небольшую (5–7 мм) язву. Края её приподняты, отделяемое серозно-гнойное, скудное. В 15% случаев язва остаётся незамеченной. Обычная локализация первичного аффекта — открытые части тела (шея, предплечья, голени). Местный кожный процесс сопровождается увеличением, болезненностью реги- онарных лимфатических узлов и образованием бубона со всеми характерными признаками. Лимфангит для язвенно-бубонной формы туляремии не характерен. Язва заживает под коркой довольно медленно — в течение 2–3 нед и дольше. После отторжения корочки остаётся депигментированное пятно или рубчик. Ангинозно-бубонная (ангинозно-гландулярная) форма возникает при зараже- нии пищевыми продуктами или водой, в частности при употреблении недостаточно термически обработанного мяса (чаще зайчатины). При этом первичный аффект расположен на миндалинах (чаще — на одной из них) или на слизистой оболочке задней стенки глотки, нёба. Специфическая ангина характеризуется гиперемией с синюшным оттенком и отёчностью миндалины, серовато-белым островчатым или плёнчатым налётом. Налёты снимаются с трудом и напоминают дифтерийные, но они не распространяются за пределы миндалин. Под налётом через несколько дней возникает одна или несколько медленно заживающих, нередко рубцующихся язв. Продолжительность туляремийной ангины составляет от 8 до 24 дней. В тяжё- лых случаях специфические антитела обнаруживают поздно, что затрудняет диа- гностику заболевания. Абдоминальная (желудочно-кишечная) форма, также как ангинозно-бубонная, возникает при алиментарном заражении. Это одна из редких, но очень тяжёлых форм заболевания. Для неё характерны высокая температура и выраженная интоксикация. Появляются интенсивные ноющие или схваткообразные, разли- тые или локализованные в определённой области боли в животе, нередко ими- тирующие картину острого живота. Язык обложен серо-белым налётом, суховат. Возможны тошнота, рвота, метеоризм, увеличение печени и селезёнки. С самого начала болезни наблюдают задержку стула или жидкий стул без патологических примесей. Описаны случаи язвенного поражения слизистой оболочки подвздошной и тонкой кишки, пилорической части желудка и двенадцатиперстной кишки. Лимфаденит может сопровождаться симптомами раз- дражения брюшины, а при нагноении и вскрытии лимфатических узлов возможно развитие перитонита, кишечного кровотечения. Глазобубонная (окулогландулярная, офтальмическая) форма возникает при заражении через конъюнктиву, когда возбудитель проникает в глаз через загряз- нённые руки, воздушно-пылевым путём, при умывании водой из инфицирован- ных источников или при купании. Офтальмическая форма туляремии протекает довольно тяжело, но её наблюдают сравнительно редко (1–2% случаев). Характерно развитие острого специфического, чаще одностороннего конъюн- ктивита с сильным слезотечением и отёком век, выраженным набуханием пере- ходной складки конъюнктивы, слизисто-гнойным отделяемым. На слизистой оболочке нижнего века отмечают желтовато-белые узелки размером с просяное зерно, язвочки. Зрение не страдает. Процесс сопровождается увеличением и незна- чительной болезненностью околоушных, переднешейных и поднижнечелюстных лимфатических узлов. Длительность заболевания от 3 нед до 3 мес и дольше. Лёгочную (торакальную) форму с первичным воспалительным процессом в лёг- ких регистрируют в 11–30% случаев туляремии. Заражение происходит воздушно- пылевым путём (при вдыхании инфицированной пыли во время сельскохозяй- ственных работ). Выделяют два варианта лёгочной формы — бронхитический и пневмонический. Бронхитический вариант, при котором поражаются лимфатические узлы, про- текает относительно легко, с субфебрильной температурой тела, сухим кашлем, болью за грудиной (при развитии трахеита). Выслушивают жёсткое дыхание, рас- сеянные сухие хрипы. При рентгенологическом исследовании обнаруживают уве- личение трахеобронхиальных лимфатических узлов. Клиническое выздоровление наступает через 10–14 дней. Пневмонический вариант протекает тяжелее и длительнее (до 2 мес и более), со склонностью к рецидивированию и абсцедированию. Обнаруживают клиническую картину пневмонии (очаговой, сегментарной, долевой или диссеминированной), которая не имеет каких-либо патогномоничных признаков. Физикальные данные скудные (притупление перкуторного звука, разнокали- берные сухие и влажные хрипы) и возникают поздно. Возможно вовлечение в патологический процесс плевры. Часто обнаруживают гепато- и спленомегалию. Рентгенологически определяют усиление лёгочного рисунка (периваскулярные и перибронхиальные инфильтраты), увеличение прикорневых, паратрахеальных и медиастинальных лимфатических узлов, плевральный выпот. Все эти при- знаки можно обнаружить не ранее 7-го дня болезни. В результате некротизации поражённых участков лёгкого могут образоваться полости различной величины (туляремийные каверны). От первичной лёгочной формы туляремии следует отличать вторичную, кото- рая развивается метастатическим путём и может присоединиться к любой форме заболевания в более поздние сроки. Лёгочная форма туляремии при своевременном и правильном лечении закан- чивается выздоровлением; летальность не превышает десятых долей процента (в прошлом — до 5%), но характеризуется длительным (до 2 мес) течением, раз- витием абсцессов, бронхоэктазов.
ДиагностикаДиагностика туляремии основана на клинических, эпидемиологических и лабо- раторных данных. В общем анализе крови в начальном периоде обнаруживают нормоцитоз или небольшой лейкоцитоз, увеличение СОЭ. Периоду разгара болезни свойственна лейкопения с лимфо- или моноцитозом. Нейтрофильный лейкоцитоз отмечают только при нагноении бубонов. Для специфической диагностики туляремии применяют серологические и аллергические тесты, бактериологическое исследование и биологическую пробу. Основные серологические методы — РА и РПГА с диагностическим титром 1:100 и выше (стандарт диагностики). Диагностическая ценность РПГА выше, так как антитела в титре 1:100 обнаруживают рано, уже к концу первой недели (в РА — с 10–15-го дня). Для диагностики острого заболевания и определения поствак- цинальных титров исследование проводят в динамике через неделю. Если при повторном исследовании антитела не обнаружены или их титр не изменён, то кровь больного спустя неделю после второго обследования исследуют в третий раз (приказ МЗ РФ № 125 от 14.04.99). Нарастание титра антител в 2–4 раза в РА и РПГА подтверждает диагноз туляремии. Отсутствие роста указывает на анамне- стический характер реакции. Разработаны и другие серологические методы диа- гностики туляремии: РПГА, ИФА. ИФА на твердофазном носителе положителен с 6–10-х суток заболевания (диагностический титр 1:400); по чувствительности он в 10–20 раз превышает другие методы серодиагностики. В диагностике туляремии может быть использована кожная аллергическая проба, отличающаяся строгой специфичностью. Её относят к ранним диагностическим методам, так как она стано- вится положительной уже с 3–5-го дня болезни. Тулярин вводят внутрикожно или накожно (в строгом соответствии с применяемой инструкцией) в среднюю треть ладонной поверхности предплечья. Результат учитывают через 24, 48 и 72 ч. Пробу считают положительной при диаметре инфильтрата и гиперемии не менее 0,5 см. Одну лишь гиперемию, исчезающую через 24 ч, расценивают как отрицательный результат. Проба с тулярином не позволяет отличать свежие случаи заболевания от анамнестических и прививочных реакций. Когда имеются противопоказания к применению кожной пробы (повышенная сенсибилизация), прибегают к методу аллергодиагностики in vitro — реакции лейкоцитолиза. Вспомогательную роль играют бактериологические методы и биологическая проба, проведение которых возможно только в специально оснащённых лабора- ториях, имеющих разрешение на работу с возбудителем туляремии. ПЦР, с помощью которой можно обнаружить специфическую ДНК в различных биологических субстратах, положительна в начальном лихорадочном периоде забо- левания, поэтому её считают ценным методом ранней диагностики туляремии.
ЛечениеБольных с подозрением на туляремию госпитализируют по клиническим пока- заниям. Окна в палатах должны быть закрыты сеткой, чтобы не допустить транс- миссивного пути распространения инфекции. В остром периоде больным необходимы постельный режим и полноценное питание, обогащённое витаминами. Большое значение имеет уход. Медицинский персонал должен следить за соблюдением санитарно-гигиенических правил и про- ведением текущей дезинфекции с использованием 5% раствора фенола, раствора сулемы (1:1000) и других дезинфицирующих средств. Основные этиотропные препараты — аминогликозиды и тетрациклины (стан- дарт лечения). Стрептомицин назначают по 0,5 г два раза в сутки внутримышечно, а при лёгоч- ной или генерализованной форме — по 1 г два раза в сутки. Гентамицин применя- ют парентерально по 3–5 мг/кг в сутки в 1–2 приёма; амикацин — по 10–15 мг/кг в сутки в 2–3 приёма. При своевременно начатом лечении бубонной и язвенно-бубонной форм туля- ремии средней тяжести возможен приём внутрь доксициклина в суточной дозе 0,2 г или тетрациклина по 0,5 г четыре раза в день. Тетрациклины не назначают беременным, детям младше восьми лет, людям с нарушениями функции почек, печени, выраженной лимфопенией. Второй ряд антибиотиков включает цефалоспорины III поколения, рифампи- цин, хлорамфеникол, фторхинолоны, применяемые в возрастных дозах. В настоя- щее время при лечении туляремии ципрофлоксацин рассматривают в качестве препарата, альтернативного аминогликозидам. Длительность курса антибиотикотерапии составляет 10–14 дней (до 5–7-го дня нормальной температуры). В случае рецидива назначают антибиотик, который не применяли во время первой волны болезни, одновременно удлиняя курс антибак- териальной терапии. При наличии кожных язв и бубонов (до возникновения нагноения) рекомен- дуются местные компрессы, мазевые повязки, тепловые процедуры, прогревания соллюксом, синим светом, кварцем, лазерное облучение, диатермия. При нагноении бубона, возникновении флюктуации необходимо хирургическое вмешательство: вскрытие лимфатического узла широким разрезом, опорожнение его от гноя и некротических масс и дренирование. Вскрывать везикулу или пустулу на месте укуса насекомого не следует. Патогенетическую терапию, включающую дезинтоксикацию, антигистамин- ные и противовоспалительные препараты (салицилаты), витамины и сердечно- сосудистые средства, проводят по показаниям. При поражении глаз (глазобу- бонная форма) их необходимо 2–3 раза в день промывать и закапывать 20–30% раствором сульфацила натрия; при ангине назначают полоскание нитрофуралом, слабым раствором перманганата калия. Больного можно выписать из стационара в течение недели при нормальной тем- пературе, удовлетворительном состоянии, рубцевании кожных язв, уменьшении подвижных и безболезненных лимфатических узлов до размера боба или косточки сливы. Склерозирование бубона не считают противопоказанием к выписке. Больных, перенёсших абдоминальную форму, выписывают при стабильно нормальной тем- пературе в течение недели и более, нормальной функции ЖКТ. Выписку пациен- тов, переболевших окулогландулярной формой, осуществляют после консультации офтальмолога. Выписывая больного после лёгочной формы туляремии, необходимо провести контрольную рентгеноскопию или рентгенографию грудной клетки.
Бешенство
Бешенство (гидрофобия, hydrophobia, лат. — rabies, греч. — lyssa) — вирусная зоонозная природно-очаговая и антропургическая инфекционная болезнь с кон- тактным механизмом передачи возбудителя через слюну заражённого животного, характеризуемая тяжёлым поражением ЦНС со смертельным исходом.
ЭтиологияВозбудитель бешенства — РНК-содержащий вирус семейства Rhabdoviridae, рода Lyssavirus. Существует семь генотипов вируса. Классические штаммы виру- са бешенства (генотип 1) высокопатогенны для всех теплокровных животных. Вирион имеет форму пули, диаметр его 60–80 нм, состоит из сердцевины (связан- ная с белком РНК), окружён липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенным (типоспецифический антиген) и иммуногенным свойства- ми. Антитела к нему нейтрализуют вирус, их определяют в РН. Различают дикий (уличный) и фиксированный штаммы вируса бешенства. Дикий штамм вируса циркулирует среди животных и патогенен для человека. Фиксированный штамм получен Пастером путём многократного пассирования дикого вируса через мозг кроликов, в результате чего вирус приобрёл новые свойства: утратил патогенность для человека, перестал выделяться со слюной, инкубационный период сократился с 15–20 до 7 дней и в последующем не изменялся. Полученный вирус с постоян- ным инкубационным периодом Пастер назвал фиксированным и использовал его в качестве антирабической вакцины. Оба вируса идентичны по антигенам. Вирус бешенства неустойчив, быстро погибает под действием солнечных и ультра- фиолетовых лучей, при нагревании до 60 °С. Чувствителен к дезинфицирующим веществам, жирорастворителям, щёлочам. Сохраняется при низких температурах (до –70 °С). Вирус культивируют путём внутримозгового заражения лабораторных животных (кроликов, белых мышей, крыс, хомячков, морских свинок, овец и др.) и в культуре клеток почек хомячка, нейробластомы мыши, фибробластов человека и куриного эмбриона.
Эпидемиология Основной резервуар бешенства в природе — дикие млекопитающие, различные в разных регионах мира. Выделяют две эпидемические формы заболевания: • городское бешенство (антропургические очаги), основной резервуар — домаш- ние собаки и кошки; • лесное бешенство, резервуар — различные дикие животные. В природных очагах России основные распространители болезни — лисица (90%), волк, енотовидная собака, корсак, песец (в тундровой зоне). В связи с интен- сивной циркуляцией вируса в эпизоотические очаги всё чаще вовлекаются дикие животные других семейств. В последние годы зарегистрированы случаи бешен- ства у барсуков, хорьков, куниц, бобров, лосей, рысей, диких кошек, серых крыс, домовых мышей. Выявлены случаи заболевания белки, хомяка, ондатры, нутрии, медведя. Домашнее животное обычно заражается бешенством от диких животных. Человек может встретиться с источником инфекции как в городе, так и на приро- де, заражение происходит при укусе больным животным, а также при ослюнении кожи (если есть микротравмы) и слизистых оболочек. Неповреждённые слизи- стые оболочки проницаемы для вируса бешенства, а неповреждённая кожа — нет. Передача вируса возможна также при укусе летучими мышами-вампирами (чаще это происходит в Мексике, Аргентине и Центральной Америке), в последнее время зарегистрированы случаи бешенства после укусов насекомоядных летучих мышей в США, Европе, Австралии, Африке, Индии, в России (Белгородская область), на Украине. Доказана возможность аэрогенного заражения (заражение спелеологов; случай лабораторного заражения в результате аварии и др.).
Меры профилактики Иммунизация против бешенства может быть профилактической и лечебно- профилактической. С профилактической целью иммунизируют лиц, работа кото- рых связана с риском заражения (ветеринары, лесники, охотники, собаколовы, работники бойни, таксидермисты, сотрудники лабораторий, работающих с улич- ным вирусом бешенства). Первичная иммунизация включает три инъекции (0-й, 7-й и 30-й день) по 1 мл. Первую ревакцинацию проводят через 1 год — одна инъекция в дозе 1 мл. Следующая ревакцинация каждые 3 года — по одной инъекции в дозе 1 мл. Вакцинацию проводят с учётом противопоказаний. Лечебно-профилактическую иммунизацию проводят при контакте и укусах людей бешеными, подозрительными на бешенство или неизвестными животными, противопоказаний в этом случае не существует. Беременность и грудной возраст — не повод для отказа от проведения лечебно-профилактической иммунизации. Постэкспозиционная профилактика бешенства включает обработку раны и введение антирабической вакцины в сочетании с антирабическим иммуноглобу-лином. Одновременно проводят профилактику столбняка в соответствии с суще- ствующими схемами. Оказание первой помощи пострадавшим от укусов животных необходимо про- водить немедленно или как можно раньше после укуса. Раны, царапины, ссадины, места ослюнения обильно промывают струей воды с мылом или другим моющим средством, края ран обрабатывают 70° спиртом или 5% раствором йода, наклады- вают стерильную повязку. Края раны в первые 3 дня не иссекают и не зашивают. Наложение швов показано исключительно в следующих случаях: при обширных ранах, когда следует наложить несколько наводящих кожных швов после предва- рительной обработки раны; для остановки наружного кровотечения (необходимо прошить кровоточащие сосуды); по косметическим показаниям (наложение кож- ных швов на раны лица). После местной обработки раны немедленно начинают лечебно-профилактическую иммунизацию, для чего направляют пострадавшего в травматологический пункт. Экстренную профилактику столбняка проводят в соот- ветствии с существующими схемами. В настоящее время в России для проведения вакцино-сывороточной профилак- тики бешенства используют антирабические вакцины и антирабический иммуно- глобулин. Вместо применявшейся прежде мозговой вакцины, обладавшей высокой реактогенностью, используют культуральные. В настоящее время наиболее широ- ко используют антирабическую культуральную концентрированную очищенную инактивированную сухую вакцину (КОКАВ♠). Дозу антирабического иммуноглобулина опреде- ляют из расчёта 40 МЕ/кг при введении гетерологичного и 20 МЕ/кг при введении гомологичного иммуноглобулина. Чтобы определить необходимую для введения дозу иммуноглобулина, необходимо вес пострадавшего умножить на 40 (20) МЕ и разделить полученное число на активность иммуноглобулина, также измеряемую в МЕ (указана на этикетке). Рассчитанную дозу иммуноглобулина инфильтрируют вокруг ран и в глубину раны. Если анатомическое расположение раны не позволяет ввести всю дозу вокруг раны, то остаток иммуноглобулина вводят внутримышечно в другие места. Антирабический иммуноглобулин не применяют после введения антирабической вакцины. КОКАВ♠ вводят 6 раз в дозе 1 мл в дельтовидную мышцу (детям — в мышцы бедра) на 0, 3, 7, 14, 30 и 90-й день. Определение показаний к лечебно-профилактической иммунизации против бешенства Если животное в течение 10 сут не заболело, в момент укуса его слюна не могла содержать вирус бешенства. В этом случае начатую иммунизацию прекращают (пациент успевает получить три инъекции вакцины — на 0, 3 и 7-й день после укуса). Лицам, получившим ранее полный курс лечебно-профилактических или профилак- тических прививок, с окончания которого прошло не более 1 года, назначают три инъекции вакцины по 1 мл на 0-й, 3-й, 7-й день; если прошёл 1 год и более или был проведён неполный курс иммунизации, то вводят вакцину в дозе 1 мл на 0-й, 3-й, 7-й, 14-й, 30-й и 90-й день. Прививающийся должен знать: ему запрещено употребление каких-либо спирт- ных напитков в течение всего курса прививок и 6 мес после его окончания. Следует также избегать переутомления, переохлаждения, перегревания. 
Патогенез После укуса вирус бешенства проникает в организм человека через повреждён- ный эпителий, внедряется в поперечнополосатые мышцы; в нервную систему вирус попадает через нервно-мышечные синапсы и сухожильные рецепторы Гольджи (в этих структурах есть уязвимые для вируса безмиелиновые нервные окончания). Далее вирус медленно, со скоростью около 3 мм/ч, продвигается по нервным волокнам в ЦНС, по видимому, с аксоплазматическим током. При естественном заражении бешенством вирусемии нет, но в некоторых опытах на животных цир- куляция вируса в крови зарегистрирована. Достигнув ЦНС, вирус инфицирует нейроны, репликация происходит почти исключительно в сером веществе. После репликации в нейронах мозга вирус распространяется в обратном направлении по вегетативным нервным волокнам — в слюнные железы (это и объясняет наличие вируса в слюне уже в конце инкубационного периода), в слёзные железы, в рого- вицу, почки, лёгкие, печень, кишечник, поджелудочную железу, скелетные мышцы, кожу, сердце, сосочки языка, надпочечники, волосяные фолликулы и др. Наличие вируса в волосяных фолликулах и роговице используют для прижизненной диа- гностики заболевания (наличие вирусного антигена исследуют в биоптате кожи, взятом в заушной области, и в мазке-отпечатке с роговицы). Смерть наступает вследствие поражения жизненно важных центров — дыхательного и сосудодвига- тельного. Патоморфологическое исследование мозга умерших позволяет выявить умеренные воспалительные изменения с относительно негрубой деструкцией нервных клеток, сопровождаемые отёком–набуханием вещества головного мозга. Гистологическая картина напоминает таковую при других вирусных инфекци-ях ЦНС: полнокровие, более или менее выраженный хроматолиз, пикноз ядер и нейронофагия, инфильтрация периваскулярных пространств лимфоцитами и плазматическими клетками, пролиферация микроглии, гидропическая дистрофия. Обращает на себя внимание несоответствие между тяжёлыми неврологически- ми проявлениями болезни и скудными патоморфологическими изменениями в веществе мозга. В клетках мозга вирус бешенства образует оксифильные цито- плазматические включения (тельца Бабеша–Негри), чаще всего обнаруживаемые в гиппокампе, клетках Пуркинье коры мозжечка, стволе мозга, гипоталамусе и спинномозговых ганглиях. Включения имеют размер около 10 нм, это участки цитоплазмы нервных клеток и скопления вирусных частиц. У 20% больных тельца Бабеша–Негри выявить не удаётся, однако их отсутствие не исключает диагноз бешенства.
Клиническая картина Для бешенства характерна цикличность течения. Различают инкубацион- ный период, период предвестников (продромальный), возбуждения и парали- чей. Длительность инкубационного периода — от 7 дней до года и более (чаще 30–90 дней), зависит от локализации укусов (чем больше расстояние до головного мозга, тем он продолжительней), их глубины и обширности. Наиболее короткий инкубационный период характерен для укусов в область лица, головы, промеж- ности, гениталий, наиболее длительный — для одиночных укусов в туловище и нижние конечности. Продромальный период длится 1–3 дня. Появлению неприятных ощущений и боли в месте укуса может предшествовать лихорадка. Одновременно отмечают бес- сонницу, подавленное настроение, раздражительность, чувство страха, тоски, повы- шенную чувствительность к слуховым и зрительным раздражителям, гиперестезию кожи, чувство нехватки воздуха.. Первые признаки острого энцефалита — приступы психомоторного возбужде- ния. Вскоре присоединяются изменение сознания, галлюцинации, агрессивность, буйство, бредовые идеи, мышечные спазмы, судороги. Больной пытается убежать, укусить, нападает с кулаками. На этом фоне возникает приступ болезни («парок- сизм бешенства»), сопровождающийся судорогами мышц глотки, гортани, диа- фрагмы, возможно нарушение дыхания и глотания. Характерны психомоторное возбуждение, гиперсаливация, рвота, что приводит к обезвоживанию. Приступы длятся несколько секунд или минут, в дальнейшем частота их нарастает, провоци- руют их попытка пить (гидрофобия), дуновение воздуха (аэрофобия), яркий свет (фотофобия) или громкий звук (акустикофобия). На высоте приступа возможна остановка дыхания. Между приступами сознание, как правило, проясняется. К симптомам энцефалита скоро присоединяются признаки нарушения стволовых функций. Поражение черепно-мозговых нервов ведёт к диплопии, парезу лицевых мышц, невриту зрительного нерва, нарушению глотания. Слюнотечение в сочета- нии с дисфагией приводит к появлению изо рта пены, что очень характерно для больных бешенством. Наблюдается тахикардия, гипертермия. Следующая стадия болезни — паралитическая. Прекращаются судороги и воз- буждение, проясняется сознание. На фоне мнимого улучшения состояния наступа- ет смерть от паралича дыхательного или сосудодвигательного центра. Возможны различные варианты течения болезни: отсутствие продромального периода или развитие «тихого» бешенства (часто после укусов летучих мышей) — характерно развитие восходящих параличей, напоминающих синдром Гийена–Барре. Исход заболевания — смерть больного. В отсутствие интенсивной терапии (ИВЛ) через 4 сут после появления первых симптомов умирает половина больных, через 20 сут — все заболевшие. Если проводится ИВЛ, возможно развитие поздних осложнений: синдром гиперсекреции антидиуретического гормона, несахарный диабет, нестабильность гемодинамики, аритмии, РДС взрослых, желудочно- кишечные кровотечения, тромбоцитопения и др. ДиагностикаПрижизненный диагноз бешенства может быть подтверждён определением вирусного антигена в первые дни болезни методом флюоресцирующих антител в отпечатках роговицы или в биоптатах кожи затылка, а также определением антител после 7–10-го дня болезни РН. У невакцинированных больных диагноз бешенства подтверждает четырёхкратное нарастание титра антител при исследо- вании парных сывороток. У вакцинированных больных при постановке диагноза опираются на абсолютный уровень нейтрализующих антител в сыворотке, а также на присутствие этих антител в СМЖ. После проведения постэкспозиционной про- филактики нейтрализующие антитела в СМЖ обычно отсутствуют либо их титр низок (менее 1:64), в то время как при бешенстве титр нейтрализующих антител в СМЖ колеблется от 1:200 до 1:160 000. С диагностической целью используют также ПЦР для обнаружения РНК вируса бешенства в биоптате мозга. Посмертный диагноз бешенства может быть установлен или подтверждён несколькими методами. Широко используют гистологический метод — экспресс- метод, при котором ответ может быть получен через 1–2 ч с достоверностью 85–90%, он основан на обнаружении телец Бабеша–Негри в мазках-отпечатках головного мозга. Тельца Бабеша–Негри при обработке препарата кислыми кра- сками приобретают рубиновый цвет с базофильной внутренней структурой. Биологический метод основан на заражении исследуемым материалом лабора- торных животных (сосунков белых мышей, сирийских хомячков) и обнаружении телец Бабеша–Негри после гибели животных в мозговой ткани; ответ может быть получен через 25–30 дней. Используют также иммунологические методы — метод флюоресцирующих антител или ИФА, а также вирусологический метод, основан- ный на выделении и идентификации вируса бешенства. Для посмертного лабораторного исследования у человека используют кусочки мозговой ткани (2–3 г ткани мозжечка, аммонова рога, коры больших полуша- рий), слюнных желёз, роговицы, которые помещают в стерильную посуду с 50% раствором глицерина на физиологическом растворе. Забор материала необходимо осуществлять в условиях строгого соблюдения противоэпидемического режима и мер личной профилактики, доставку в лабораторию производят в герметически упакованном виде, в сумке-холодильнике.
ЛечениеРежим определяется показанием к госпитализации. Больных гидрофобией госпитализируют в ОРИТ. Развитие гидрофобии сопровождается нарушением глотания, что требует установки назогастрального зонда и проведения зондового питания. Эффективного лечения бешенства не существует. При развитии заболевания больного госпитализируют в инфекционную больницу (в ОРИТ), где с соблюде- нием противоэпидемических мероприятий проводят инфузионную, противосудо- рожную и седативную терапию, при необходимости вводят мышечные релаксан- ты, наркотические средства, проводят ИВЛ.
Особо опасные инфекции
(ООИ) – это инфекции, которые могут возникать среди населения в виде отдельных заболеваний, эпидемий и даже пандемий, чаще сопровождая ЧС (стихийные бедствия, войны, массовый голод и т.п.), характеризующиеся природной очаговостью, быстрым распространением и тяжелым течением. Документ: Постановление Правительства РФ от 01.12.2004 N 715 (ред. от 13.07.2012) "Об утверждении перечня социально значимых заболеваний и перечня заболеваний, представляющих опасность для окружающих"
При выявлении больного, подозрительного на заболевание ООИ, все первичные противоэпидемические мероприятия проводятся при установлении предварительного диагноза на основании клинико-эпидемиологических данных. При установлении окончательного диагноза мероприятия по локализации и ликвидации очагов особо опасных инфекций осуществляются в соответствие с действующими приказами и инструктивно-методическими указаниями по каждой нозологической форме. Принципы организации противоэпидемических мероприятий едины для всех инфекций и включают: выявление больного; информацию (сообщение) о выявленном больном; уточнение диагноза; изоляцию больного с последующей его госпитализацией; лечение больного; обсервационные, карантинные и другие ограничительные мероприятия: выявление, изоляцию, лабораторное обследование, проведение экстренной профилактики лицам, контактировавшим с больным; провизорную госпитализацию больных с подозрением на ООИ; выявление умерших от неизвестных причин,патологоанатомическое вскрытие труповс забором материала для лабораторного (бактериологического, вирусологического) исследования, обеззараживание правильную транспортировку и захоронение трупов; вскрытие умерших от высококонтагиозных геморрагических лихорадок (Марбург, Эбола, JIacca), а также забор материала от трупа для лабораторного исследования не производится в связи с большим риском заражения; дезинфекционные мероприятия; экстренную профилактику населения; медицинское наблюдение за населением; санитарный контрользавнешней средой (лабораторноеисследование возможных факторов передачи, наблюдение за численностью грызунов, насекомых и членистоногих, проведение эпизоотического исследования); санитарное просвещение. Все эти мероприятия проводятся местными органами и учреждениями здравоохранения совместно с противочумными учреждениями, осуществляющими методическое руководство и практическую помощь. Все лечебно-профилактические и санитарно-эпидемиологические учреждения должны иметь необходимый запас медикаментов для проведения этиотропной и патогенетической терапии; укладок для забора материала от больных, подозрительных на ООИ, для лабораторного исследования; дезинфекционных средств и упаковок лейкопластыря из расчета на заклеивание окон, дверей, вентиляционных отверстий в одном кабинете (боксе, палате); средств личной профилактики и индивидуальной защиты (противочумный костюм I типа).
При выявлении больных холерой контактными считаются только те лица, которые общались с ними в период клинических проявлений болезни. Медицинские работники, бывшие в контакте с больными чумой, ГВЛ или оспой обезьян (при подозрении на эти инфекции), подлежат изоляции до установления окончательного диагноза или на срок, равный максимальному инкубационном) периоду. Лица, бывшие в непосредственном контакте с больным холерой, указанию врача-эпидемиолога должны быть изолированы или оставлены под медицинским наблюдением. При установлении предварительного диагноза и проведении первичных противоэпидемических мероприятий следует руководствоваться следующими сроками инкубационного периода: чума — 6 дней; холера — 5 дней; желтая лихорадка — 6 дней; Крым-Конго, оспа обезьян - 14 дней; лихорадки Эбола, Марбург, Ласа, боливийская, аргентинская — 21 день; синдромы невыясненной этиологии — 21 день. Дальнейшие мероприятия проводятся специалистами отделов особо опасных инфекций ЦГЭ и 03, противочумных учреждений в соответствии с действующими инструкциями и комплексными планами. Противоэпидемические мероприятия в лечебно-профилактических учреждениях проводятся по единой схеме согласно оперативному плану данного учреждения.
При выявлении больного, подозрительного на заболевание ООИ в поликлинкеили больнице проводятся следующие первичные противоэпидемические мероприятия: Транспортабельные больные доставляются санитарным транспортом в специальный стационар. Нетранспортабельным больным медицинская помощь оказывается на месте с вызовом консультанта и оснащенной всем необходимым машины скорой медицинской помощи. Принимаются меры к изоляции больного по месту его выявления, до госпитализации в специализированный инфекционный стационар. Медицинский работник, не выходя из помещения, где выявлен больной, по телефону или через нарочного извещает руководителя своего учреждения о выявленном больном, запрашивает соответствующие лекарственные препараты, укладки защитной одежды, средств личной профилактики.
При подозрении на чуму, контагиозные вирусные геморрагические лихорадки медработник до получения защитной одежды должен закрыть нос и рот любой повязкой (полотенцем, косынкой, бинтом и т.д.) предварительно обработав руки и открытые части тела любыми антисептическими средствами и оказать помощь пациенту, дождаться прихода врача-инфекциониста или врача другой специальности. После получения защитной одежды (противочумных костюмов соответствующего типа) ее надевают, не снимая собственной, кроме сильно загрязненной выделениями больного. Прибывший врач-инфекционист (врач-терапевт) заходит в помещение, где выявлен больной в защитной одежде, а сопровождающий его сотрудник около помещения должен развести дезинфицирующий раствор. Врач, выявивший больного, снимает халат, повязку, защищавшую его дыхательные пути, помещает их в бачок с дезинфицирующим раствором или влагонепроницаемый пакет обрабатывает дезинфицирующим раствором обувь и переходит в другое помещение, где проходит полную санитарную обработку, переодевание в запасной комплект одежды (личные вещи помещают в клеенчатый мешок для обеззараживания). Обрабатываются открытые части тела, волосы, прополаскивается рот и горло 70° этиловым спиртом, в нос и глаза закапывают растворы антибиотиков или 1% раствор борной кислоты. Вопрос об изоляции и проведении экстренной профилактики решается после заключения консультанта. При подозрении на холеру соблюдаются меры личной профилактики при кишечных инфекциях: после осмотра руки обрабатывают антисептическим средством. В случае попадания выделений больного на одежду, обувь их заменяют запасными, а загрязненные вещи подлежат обеззараживанию. Прибывший врач в защитной одежде осматривает больного, уточняет эпиданамнез, подтверждает диагноз, по показаниям продолжает лечение больного. Также выявляет лиц, бывших в контакте с больным (пациентов, в т.ч. и выписанных, медицинского и обслуживающего персонала, посетителей, в т.ч. покинувших медучреждение, лиц по месту жительства, работы, учебы.). Контактные лица изолируются в отдельную палату или бокс или подлежат медицинскому наблюдению.
Холерный стационар по режиму, установленному для отделений с острыми желудочно-кишечными инфекциями. режим работы провизорного госпиталя устанавливают таким же, как и для инфекционного госпиталя (больных подозрительных на данное заболевание размещают индивидуально или небольшими группами по срокам поступления и, желательно, по клиническим формам и по тяжести заболевания). При подтверждении в провизорном госпитале предполагаемого диагноза больных переводят в соответствующее отделение инфекционного госпиталя. В палате, после перевода больного проводят заключительную дезинфекцию в соответствии с характером инфекции. Оставшимся больным (контактным) проводят санитарную обработку, меняют белье, проводят профилактическое лечение. Устройство и режим изолятора такой же, как и в инфекционном госпитале. Выделения больных и контактных (мокрота, моча, испражнения и т.д.) подлежат обязательному обеззараживанию. Методы обеззараживания применяются в соответствии с характером инфекции. В стационаре больные не должны пользоваться общим туалетом. Ванные и туалеты должны быть закрыты на ключ, который хранится у ответственного за соблюдение биологической безопасности. Туалеты открывают для слива обеззараженных растворов, а ванны — для обработки выписываемых. При холере санитарную обработку больного I—II степени дегидротации проводят в приемном отделении (душем не пользуются) с последующей системой обеззараживания смывных вод и помещения, III—IV степени дегидротации проводят в палате. Вещи больного собирают в клеенчатый мешок и отправляют для обеззараживания в дезкамере. В кладовой одежду хранят в индивидуальных мешках, сложенных в баки или полиэтиленовые мешки, внутренняя поверхность которых обработана раствором инсектицидов. Больные (вибрионосители) обеспечиваются индивидуальными горшками или подкладными суднами. Заключительную дезинфекцию по месту выявления больного (вибрионосителя) проводя не позднее 3-х часов с момента госпитализации. В 03 при обнаружении больного холерой (вибрионосителя) персонал, в функциональные обязанности которого это входит, проводит текущую дезинфекцию выделений больного, кабинета врача и других помещений, где находился больной (вибрионоситель), мест общего пользования, спецодежды персонала, участвовавшего в приеме и осмотре больного, инструментария. В госпиталях текущую дезинфекцию проводит младший медицинский персонал под непосредственным руководством старшей медицинской сестры отделения. Персонал, осуществляющий дезинфекцию должен быть одет в защитным костюм: сменная обувь, противочумный или хирургический халат, дополненные резиновой обувью, клеенчатым фартуком, медицинский респиратор, резиновыми перчатками, полотенцем. Пищу для больных доставляют в посуде кухни к служебному входу незараженного блока и там переливают и перекладывают из посуды кухни в посуду буфетной госпиталя. Посуду, в которой пища поступила в отделение, обеззараживают кипячением, после чего бак с посудой передают в буфетную, где ее моют и хранят. Раздаточная должна быть снабжена всем необходимым дл обеззараживания остатков пищи. Индивидуальную посуду обеззараживают кипячением. Медицинский работник, ответственный за соблюдение биологической безопасности инфекционного стационара ведет, в период эпиосложнения, контроль обеззараживания сточных вод стационара. Обеззараживание сточных вод холерного и провизорного стационара проводят путем хлорирования с таким расчетом, чтобы концентрация остаточного хлора составляла 4,5 мг/л. Контроль осуществляется путем ежедневного получения сведений лабораторного контроля, фиксации данных в журнале.
Гельминтозы
– болезни, вызываемые паразитическими червями – гельминтами, имеющие тенденцию к затяжному или хроническому течению с широким диапазоном клинических проявлений (от бессимптомных до крайне тяжелых, угрожающих жизни человека).
Этиологиягельминтозов — 3 класса паразитических червей: круглые черви — нематоды (Nematoda), ленточные черви (Cestoda) и сосальщики (Trematoda), нематоды относятся к круглым червям, а ленточные черви и сосальщики – к плоским.
Классификация гельминтозов:
1. Круглые черви (нематоды) – возбудители: а) аскаридоза; б) трихоцефалеза; в) энтеробиоза; г) анкилостомидоза; д) стронгилоидоза; е) трихинеллеза
2. Ленточные черви (цестоды) – возбудители: а) тениоза; б) тениаринхоза; в) гименолипедоза; г) дифиллоботриоза; д) эхинококкоза; е) альвеококкоза
3. Сосальщики (трематоды) – возбудители: а) описторхоза; б) фасциолезов; в) парагонимоза; г) клонорхоза; д) метагонимоза и др.
Эпидемиология большинства гельминтозов: источник – инвазированные люди (антропонозные гельминтозы) или животные (зоонозные гельминтозы), основной механизм заражения – фекально-оральный, реже перкутанный (гельминт активно внедряется в организм человека через кожу) и трансмиссивный (при укусе кровососущим насекомым); также есть гельминтозы, имеющие сложный цикл развития с сменой хозяев (биогельминтозы: шистосомоз, филяриатоз и др.)
Основные клинические синдромы:
А) токсико-аллергический – обусловлен токсическими веществами гельминта (ферменты, белки, компоненты оболочки, метаболиты), имеющих антигенные и сенсибилизирующе свойства, превалирует в острой фазе, проявляется общеаллергическими реакциями (лихорадка, боли в мышцах и суставах, общая интоксикация, высыпания на коже, отеки, «летучие» инфильтраты в легких, гиперэозинофилия крови) и аллергическо-токсическими органными поражениями (миокардит, гепатит, пневмония, энцефалопатия вплоть до геморрагически-некротический поражений внутренних органов при массивной инвазии возбудителя)
Б) местного повреждения – обусловлен местным повреждением органов, превалирует в хронической фазе, определяется локализацией паразита (анкилостомы и цестоды травмируют слизистую кишечника, описторхисы — желчевыводящих путей, шистосомы — толстой кишки и мочевыводящих путей и др.)
В) нарушенного питания – гельминты, потребляя метаболически ценные для человека питательные вещества, способствуют развитию гипотрофии, белковой недостаточности, гиповитаминоза, анемии (ленточные глисты, аскариды и др.)
Г) иммуносупрессии – при длительном воздействии гельминтов на организм они оказывавают иммуносупрессивное действие, снижая резистентность к бактериальным и вирусным инфекциям
Дигностика гельминтозов:
1) микроскопия фекалий, мочи, дуоденального содержимого, мокроты, соскобов с перианальной области, крови, биоптатов тканей с целью выявления яиц, личинок, взрослых паразитов или их фрагментов (члеников), которые могут быть видны и макроскопически (аскариды, членики цепней и т. д.)
2) серологические методы: РПГА, РСК, ИФА и др. – используют для диагностики тканевых гельминтозов
3) инструментальные методы: эндоскопия, УЗИ, КТ, МРТ – используют в неясных случаях для уточнения диагноза, а также для оценки степени поражения гельминтом того или иного органа
Лечение основано на использовании антигельминтных препаратов (для лечения круглых гельминтов применяют: пиперазин, нафтамон / алкопар, декарис / левамизол, пирантел / комбантрит, мебендазол / вермокс, тиабендазол / минтезол и др., для лечения плоских гельминтов применяют: фенасал, парамомицин, мебендазол / вермокс, празиквантель, семена тыквы, экстракт мужского папоротника и др.), по показаниям химиотерапия сочетается с применением антигистаминных, противовоспалительных ЛС, в отдельных случаях – ГКС.
Аскаридоз
Аскаридоз (лат. ascaridosis) — гельминтоз из группы кишечных нематодозов, вызываемый аскаридами (обычно Ascaris lumbricoides), характеризующийся в ранней стадии явлениями аллергии, а в поздней — диспепсическими явлениями и осложнениями при проникновении гельминтов в другие органы, а также в резуль- тате закупорки или спазма кишечника. ЭтиологияВозбудитель аскаридоза, Ascaris lumbricoides, относится к типу Nemathelminthes, классу Nematoda, отряду Rhabditida, семейству Oxyuridae. В цикле развития A. lumbricoides различают следующие стадии: половозрелую форму, яйцо, инвази- онное яйцо, личинку. В связи со значительными морфологическими и метаболическими измене- ниями в разных стадиях развития у аскариды, как и у других видов гельминтов, существенно изменяются экзогенные и эндогенные антигены и их иммуногенные свойства. Половозрелые особи имеют длинное тонкое тело беловато-розового цвета. Самка размером 20–40 см × 3–6 мм, самец — 15–25 см × 2–4 мм. Ротовое отвер- стие, расположенное на переднем конце тела, окружено тремя кутикулярными губами. Хвост короткий, у самца загнут на брюшную сторону. Внутреннее строе- ние обычное для нематод. Паразитируют половозрелые аскариды в тонкой кишке человека, питаясь содержимым кишечника. Каждая самка в сутки откладывает до 240 000 оплодотворённых и неоплодотворённых яиц. Оплодотворённые яйца (50–70 × 40–50 мкм) почти шаровидной или вытянутой формы, жёлтого или жёлто-коричневого цвета, имеют три оболочки. При благоприятных условиях внешней среды (наличие кислорода, высокая влажность, температура 20–25 °С) развитие личинки в яйце занимает 2–3 нед. Зрелые личинки способны в течение 20 дней сохраняться при температуре –20…–27 °С. При –30 °С личинки быстро погибают, а температура 47 °С вызывает их гибель в течение 1 ч.
ЭпидемиологияАскаридоз относится к геогельминтозам. Источник заражения окружающей среды — только больной аскаридозом человек. Он заражается при проглатыва- нии инвазивных яиц. Факторами передачи служат загрязнённые овощи, ягоды, другие пищевые продукты, вода, а также руки. В зоне умеренного климата сезон заражения длится до 7 мес — с апреля по октябрь, в условиях тёплого влажного климата — круглый год. В эндемичных очагах у людей формируется иммунитет к суперинвазии и реин- вазии. Иммунный ответ более выражен в период паразитирования личиночных стадий гельминта, находящихся в процессе миграции. Иммунные реакции против личинок гельминта защищают хозяина от бесконтрольного увеличения интенсив- ности инвазии при повторном заражении. Для жителей эндемичных очагов, под- верженных частым повторным заражениям, характерно развитие определённой невосприимчивости и, соответственно, кишечной инвазии низкой интенсивности. Аскаридоз широко распространён во влажных зонах умеренного, субтропиче- ского и тропического поясов, редко регистрируется в сухих степях, отсутствует в зоне вечной мерзлоты, высокогорья и пустынь. Аскаридозом в мире ежегодно поражаются более 1 млрд человек, большинство из которых составляют дети дошкольного и школьного возраста.
меры профилактикиВ профилактике аскаридоза основное значение имеют санитарное благоустрой- ство населённых мест и охрана почвы от фекального загрязнения. В индивидуаль- ной профилактике важно строго соблюдать правила личной гигиены, тщательно промывать употребляемые в пищу сырые овощи, ягоды и фрукты. В очагах аскаридоза с поражённостью менее 10% населения один раз в два года проводят паразитологическое обследование 20% жителей; в очагах, где поражено более 10% жителей, ежегодно обследуют всё население. Для дегельминтизации исполь- зуют антигельминтные препараты с учётом особенностей их применения в разных возрастных группах.
ПатогенезИз инвазионных яиц аскарид в тонкой кишке человека выходят рабдитовид- ные личинки, которые через 3–4 ч проникают в толщу слизистой оболочки. Далее происходит миграция личинок по системе портальной вены в печень, затем в лёгкие, где в течение 1–2 нед продолжается их развивитие. В печени на 5–6-й день после заражения и в лёгких (на 10-й день) личинки совершают линьку. В лёгких, разрывая капиллярную сеть и стенки альвеол, они проника- ют в просвет бронхов и продвигаются по воздухоносным путям в ротоглотку. С заглатываемой слюной и пищей личинки повторно попадают в тонкую кишку, где превращаются в половозрелых самцов и самок, совершив перед этим ещё две линьки. Продолжительность миграции личинок составляет около 2 нед, а созревание самок до начала откладывания яиц длится более 10 нед. В организме человека взрослая особь живёт 11–13 мес. В ранней миграционной стадии в основе патологических изменений лежит сенсибилизация организма продуктами метаболизма, линьки и распада погибших личинок. Аллергены аскарид самые сильные среди аллергенов паразитарного про- исхождения. При интенсивной инвазии наблюдается механическое повреждение стенки тонкой кишки, кровеносных сосудов, ткани печени, лёгких. Отмечают также эозинофильные инфильтраты в лёгких, капиллярный стаз, геморрагии. Клинические проявления в поздней кишечной стадии связаны с механическим воздействием гельминтов и продуктов их метаболизма на слизистую оболочку кишечника, что ведёт к нарушению пищеварения, моторной функции, нарушению азотистого баланса, гиповитаминозам. Один из выделяемых аскаридой полипеп- тидов оказывает токсическое влияние на ЦНС. Аскариды могут мигрировать за пределы тонкой кишки: в жёлчные и панкреатические протоки, аппендикс, дыха- тельные пути. Иногда скопления аскарид приводят к закупорке, завороту кишки, инвагинации. Кишечная непроходимость чаще возникает при интенсивной инва- зии, а инвагинация — при наличии единичных гельминтов или нескольких особей одного и того же пола. Аскариды существенно подавляют иммунологическую реактивность хозяина.
Клиническая картинаВыделяют две клинические стадии болезни — раннюю (миграционную) и позднюю (кишечную). Ранняя стадия часто протекает субклинически или бес- симптомно. При клинически выраженной форме на 2–3-й день после заражения появляются такие признаки болезни, как недомогание, слабость, субфебрилитет. Наблюдаются уртикарные высыпания на коже, возможно увеличение селезёнки и печени. Более характерен симптомокомплекс поражения лёгких с образованием транзиторных инфильтратов, определяемых рентгенологически, и эозинофилией в периферической крови (синдром Лёффлера). В этих случаях появляются сухой кашель, иногда с мокротой с прожилками крови, одышка, боли в груди, удушье. В лёгких выслушивают сухие и влажные хрипы. В кишечной стадии аскаридоз у взрослых часто протекает со слабовыраженны- ми симптомами или бессимптомно. Наблюдаемые симптомы (ухудшение аппетита, тошнота, иногда рвота, схваткообразные боли в животе, диарея или неустойчивый стул) малоспецифичны. Самочувствие больных ухудшается, снижается работоспо- собность, появляются головная боль, головокружение. У детей в ранней стадии аскаридоза может развиться пневмония, при интен- сивной инвазии — тяжёлая интоксикация. Снижается масса тела, дети становятся капризными, рассеянными, возможны эпилептиформные приступы, менингизм, синдром Меньера; в анализе крови — нормо- и гипохромная анемия, эозинофи- лия.
ДиагностикаПри распознавании ранней (миграционной) стадии аскаридоза необходимо ориентироваться на симптомы поражения лёгких в сочетании с эозинофилией крови. Редко удаётся обнаружить личинок аскарид в мокроте. Существуют мето- ды серодиагностики (ИФА, РЛА), но они широкого применения в практике не имеют. Лабораторная диагностика аскаридоза в кишечной стадии заключается в выявлении яиц гельминтов в фекалиях. При отрицательных результатах в случае подозрения на гельминтоз рекомендуют проводить повторные исследования с интервалом 1–2 нед. ЛечениеПоказания к госпитализации Лечение больных проводят амбулаторно или в дневном стационаре. Госпитализации подлежат больные с хирургическими осложнениями аскаридоза. Медикаментозная терапия Все больные аскаридозом подлежат лечению антигельминтными средствами. • Албендазол назначают взрослым однократно в дозе 400 мг внутрь после еды, детям старше 3 лет — по 10 мг/кг в два приёма в течение 1–3 дней. • Мебендазол показан взрослым и детям старше 2 лет внутрь по 100 мг два раза в сутки в течение 3 дней. • Карбендацим рекомендуют внутрь через 20–30 мин после еды в дозе 10 мг/кг в три приёма в течение 3 дней. • Пирантел назначают по 10 мг/кг однократно внутрь после еды. При приёме указанных антигельминтных препаратов не требуется специальной диеты и назначения слабительных средств. Патогенетическая и симптоматическая терапия необходима при длительной и интенсивной инвазии: применяют пробиотики и ферментативные препараты. Дополнительные методы лечения При возникновении хирургических осложнений необходимо оперативное или инструментальное вмешательство. Прогноз Прогноз при неосложнённом течении аскаридоза благоприятный. В отсутствие повторного заражения через 9–12 мес наступает самоизлечение вследствие есте- ственной гибели гельминтов. Осложнения аскаридоза сравнительно редки, однако они представляют серьёзную угрозу здоровью и могут привести к летальному исходу, особенно у детей. Диспансеризация Диспансерное наблюдение за переболевшими осуществляют в течение 2–3 мес. Контрольные исследования фекалий на наличие яиц аскарид проводят через 3 нед после окончания лечения с интервалом в 2 нед. При неэффективности курс лече- ния следует повторить.
Тениаринхоз
Тениаринхоз (лат. taeniarhynchosis) — гельминтоз из группы цестодозов, вызы- ваемый Taeniarhynchus saginatus (бычьим цепнем) или Taeniarhynchus confusum и характеризующийся развитием диспепсических явлений. Человек заражается при употреблении в пищу говядины, содержащей личинки возбудителя и не прошед- шей достаточной термической обработки.
ЭтиологияВозбудитель — Taeniarhynchus saginatus (цепень невооружённый, бычий цепень), относится к типу Plathelminthes, классу Cestoda, семейству Taeniidae. Тело его плоское, лентовидное и состоит из головки с четырьмя мощными присосками и множества (1000 и более) члеников (проглоттид). Длина зрелого членика 20 мм, ширина 5 мм. Матка имеет медианный ствол и 18–30 боковых ответвле- ний. Гельминт достигает в длину 4–12 м. Зрелые гермафродитные проглоттиды содержат более 140 000 яиц. Яйца почти шаровидной формы, внутри находится зародыш (онкосфера). Бычий цепень относится к биогельминтам, при развитии сменяет двух хозяев. Человек — окончательный хозяин, промежуточные — круп- ный рогатый скот, буйвол, як, зебу. В организме человека взрослые гельминты паразитируют в тонкой кишке в течение длительного времени (до 20 лет). Зрелые членики, отрываясь от стробилы, попадают в окружающую среду с фекалиями, пассивно или активно выползают из анального отверстия. В организме промежуточного хозяина личинки развиваются в мышечной и соединительной ткани, где превращаются в ларвоцисты овальной формы — цистицерки (финны). Личинки, попавшие в кишечник человека, дости- гают стадии взрослого гельминта через 2,5–3 мес.
ЭпидемиологияИсточником заражения окружающей среды онкосферами бычьего цепня служит человек — единственный дефинитивный хозяин. Наибольшую опас- ность представляют лица, ухаживающие за животными (пастухи, доярки и т.д.) Заражение животных чаще всего происходит на пастбищах. Яйца гельминта с кормом попадают в кишечник промежуточного хозяина. Через 16 нед после заражения животного его мясо становится заразным для человека. Цистицерки в мышцах животных сохраняют жизнеспособность в течение 1–3 лет. Механизм заражения человека пероральный — при употреблении в пищу сырого или недо- статочно проваренного финнозного мяса животных, промежуточных хозяев гельминта. Наиболее поражено мясо молодых животных. Гельминтоз рас- пространён в районах, где принято пастбищное и отгонное содержание скота. Тениаринхоз регистрируют во многих регионах нашей страны. Эндемичные районы — Дагестан, Республика Саха, Бурятия, Алтайский край, Иркутская, Красноярская и Новосибирская области.
меры профилактикиПрофилактику осуществляют с помощью комплекса медицинских и ветеринар- ных мероприятий, направленных на выявление источников инвазии при массовом обследовании населения. Проводят мероприятия по защите окружающей среды (пастбищ) от фекального загрязнения. Личная профилактика заключается в исключении из пищевого рациона сырого и недостаточно термически обработан- ного мяса крупного рогатого скота.
ПатогенезБычий цепень в кишечнике человека, как правило, паразитирует в един- ственном числе (старое название гельминта — солитёр). Паразит, достигающий размером нескольких метров, прикрепляясь присосками к слизистой обо- лочке тонкой кишки, наносит повреждение, раздражает рецепторы кишеч- ника, оказывая влияние на моторную и секреторную функции кишечника. Дополнительное механическое воздействие могут оказывать отделившиеся проглоттиды, которые провоцируют болевой синдром, особенно при прохож- дении через илеоцекальный клапан. Описаны случаи проникновения паразитов в червеобразный отросток, общий жёлчный и панкреатический проток, что приводило к обструкции и воспалительным изменениям. Возможно развитие тениаринхозной непроходимости кишечника. Интенсивное потребление пара- зитом пищевых веществ в процессе роста и развития (молодая особь за сутки удлиняется на 7–10 см) создает дефицит наиболее биологически ценных ком- понентов в пищевом рационе больного. Определённое значение в патогенезе тениаринхоза имеют блокирующее действие веществ, выделяемых гельминтом, на ферментную систему кишечника человека, а также сенсибилизация продук- тами метаболизма бычьего цепня.
Клиническая картинаНередко инвазия бычьим цепнем протекает без заметных нарушений обще- го состояния и проявляется только выделением члеников из заднего прохода с фекалиями и/или вне акта дефекации в результате их активного выползания из ануса. На 2–3-й неделе появляются изжога, тошнота, чувство тяжести в эпигастрии, на 8-й неделе нарушается стул. При длительной инвазии больные отмечают общую слабость, боли в животе, иногда наблюдаются снижение массы тела, диарея, повышение аппетита, возникают астеноневротические проявления: головокружение, головная боль, нарушение сна, обморочные состояния, эпи- лептиформные судороги. В отдельных случаях регистрируются эозинофилия в крови и анемия.
ОсложненияОсложнения: механическая кишечная непроходимость, аппендицит, холангит, панкреатит — возникают очень редко.
ДиагностикаКлиническая картина малоспецифична. Подозрение на инвазию может вызы- вать сочетание диспепсического синдрома и потери массы тела с повышением аппетита. Проводят исследование фекалий, чтобы выявить фрагменты стробилы (про- глоттид) и яйца гельминтов методами обогащения.
ЛечениеПрепарат выбора — празиквантел, назначаемый однократно в дозе 15 мг/кг. Для дегельминтизации можно использовать также никлозамид: 2 г принимают на ночь, тщательно разжёвывая и запивая водой. За 15 мин до приёма рекомендуют выпить 1–2 г натрия гидрокарбоната (питьевой соды). Препарат вызывает гибель сколекса и незрелых члеников. Если выделение члеников возобновляется, про- водят повторный курс лечения теми же антигельминтными препаратами. Если отхождение члеников прекращается в течение 2–3 мес после противопаразитарно- го лечения, это свидетельствует об эффективном лечении. В таких случаях прово- дят контрольное исследование фекалий на наличие онкосфер гельминта. Примерные сроки нетрудоспособности Трудоспособность во время заболевания не нарушена. Диспансеризация Диспансеризация не регламентирована. Через 2–3 мес после лечения прово- дят контрольное гельминтологическое исследование. При выявлении в фекалиях онкосфер повторяют курс лечения.
Тениоз
Тениоз (латинское название — taeniosis; английское — taeniasis) — биогельмин- тоз, вызываемый паразитированием в кишечнике человека свиного цепня и про- являющийся нарушением функций ЖКТ. Э
тиологияВозбудитель — Taenia solium — цепень вооружённый (свиной цепень), тип Plathelminthes, класс Cestoda, семейство Taeniidae. Гельминт имеет плоское лен- товидное тело, на шаровидном сколексе расположены четыре присоски и хобо- ток с двумя рядами чередующихся коротких и длинных хитиновых крючьев (всего 22–23). Длина взрослого гельминта достигает 3–4 м. От бычьего цепня свиной отличается меньшим количеством члеников (800–1000), их размерами (длина 12–15 мм, диаметр 6–7 мм) и меньшим количеством боковых ответвле- ний матки в зрелом членике (7–12 пар). Членики не обладают активной под- вижностью. Каждый из них содержит 30 000–50 000 яиц. Выводное отверстие у матки отсутствует. Онкосферы свиного и бычьего цепня морфологически неотличимы. Окончательный хозяин — человек, в кишечнике которого паразитирует поло- возрелая форма гельминта. В организме промежуточного хозяина — свиньи (факультативными хозяевами могут быть дикие свиньи, собаки, кошки, иногда человек) зародыш освобождается из яйца, проникает в кишечную стенку и с кро- вотоком разносится по всему организму. Через 60–70 дней зародыш превращается в цистицерк (Cysticercus cellulosae) — финны, достигающие в диаметре 5–8 мм, а в паренхиматозных органах — 1,5 см. Цистицерки сохраняют жизнеспособность до пяти лет.
ЭпидемиологияИсточник инвазии — человек, который, будучи поражён тениозом, вместе со своими экскрементами выделяет в окружающую среду онкосферы. Это приво- дит к заражению промежуточных хозяев (свиней) финнозом. Люди заражаются тениозом при употреблении в пищу сырого или недостаточно термически обра- ботанного финнозного свиного мяса. Тениоз регистрируют в странах, где развито свиноводство.
ПрофилактикаОсновные меры профилактики — выявление и лечение больных, санитарное просвещение населения, благоустройство населённых мест, санитарный надзор за содержанием и убоем свиней, ветеринарный контроль мяса. ПатогенезПри неосложнённом кишечном тениозе в основе патогенеза лежат те же фак- торы, что и при тениаринхозе. Однако когда зрелые членики вследствие антипе- ристальтических сокращений забрасываются из кишечника в желудок, возможна аутоинвазия онкосферами. В этом случае тениоз может осложниться развитием цистицеркоза мозга, скелетных мышц, глаз.
Клиническая картинаКлиническая картина неосложнённого кишечного тениоза близка к таковой при тениаринхозе. При тениозе сравнительно часто регистрируют диспепсические и астеноневротические проявления: нарушение аппетита, тошноту, рвоту, боли в животе, расстройство стула, головные боли, головокружение, нарушение сна, крат- ковременные обморочные состояния. Осложнения редки. Возможны кишечная непроходимость, перфорация кишки, аппендицит, холангит, панкреатит, цистицеркоз. Течение доброкачественное.
ДиагностикаПредположительный диагноз тениоза устанавливают на основании указания больного на отхождение члеников или небольших фрагментов стробила гельмин- та при дефекации. Для подтверждения диагноза и дифференциации тениоза от тениаринхоза необходимо провести микроскопическое исследование выделяемых больным члеников, тем более что онкосферы свиного и бычьего цепней морфоло- гически друг от друга неотличимы.
ЛечениеЛечение больных тениозом проводят в стационаре никлозамидом: 2 г принима- ют на ночь, тщательно разжёвывая и запивая водой. За 15 мин до приёма рекомен- дуется выпить 1–2 г натрия гидрокарбоната (питьевая сода). Препарат высоко- эффективен, вызывает гибель сколекса и незрелых члеников. В настоящее время часто применяют празиквантел, который назначают однократно в дозе 15 мг/кг больным всех возрастных групп. Оба препарата характеризуются хорошей перено- симостью, побочные реакции выражены слабо (иногда возникают тошнота, рвота, боли в животе, понос). Трудоспособность в неосложнённых случаях не нарушается. Дальнейшее ведение Диспансеризацию не проводят. Через 1–3 мес после лечения необходимо кон- трольное исследование фекалий на наличие члеников гельминта.
Токсокароз
Токсокароз (лат. toxocarosis) — хронический тканевый гельминтоз, вызы- ваемый миграцией личинок гельминта собак Toxocara canis в организме человека. Характеризуется рецидивирующим течением с поражением внутренних органов и глаз.
ЭтиологияВозбудитель токсокароза (аскарида собачья) относится к типу Nemathelminthes, классу Nematoda, подотряду Ascaridata, роду Тохосаrа. T. canis — раздельнополые нематоды, половозрелые особи которых достигают относительно больших разме- ров (длина самки 9–18 см, самца — 5–10 см). Яйца токсокары шаровидной формы, размером 65–75 мкм. Т. canis паразитирует у собак и других представителей семей- ства псовых. В жизненном цикле данного гельминта выделяют циклы развития — основ- ной и два вспомогательных. Основной цикл развития токсокар соответствует по схеме «собака–почва–собака». После заражения собаки алиментарным путём в её тонкой кишке из яиц выходят личинки, которые затем совершают миграцию, схожую с миграцией аскарид в организме человека. После созревания самок токсокар в тонкой кишке собака с фекалиями начинает выделять яйца паразита. Такой тип развития гельминта осуществляется у щенков в возрасте до 2 мес. У взрослых животных личинки гельминта мигрируют в различные органы и ткани, где вокруг них образуются гранулёмы. В них личинки длительное время сохра- няют жизнеспособность, не развиваются, но периодически могут возобновлять миграцию. Первый тип вспомогательного цикла характеризуется трансплацентарной переда- чей личинок токсокар плоду по схеме «окончательный хозяин (собака)–плацента– окончательный хозяин (щенок)». Таким образом, родившийся щенок уже содержит гельминтов. Кроме того, щенки могут получить личинок при лактации. Второй тип вспомогательного цикла происходит с участием паратенических (резервуарных) хозяев. Ими могут быть грызуны, свиньи, овцы, птицы, земляные черви. В их организме мигрирующие личинки не способны превращаться во взрос- лых особей. Однако при поедании резервуарного хозяина собакой или другим животным семейства псовых личинки, попадая в кишечник облигатного хозяина, развиваются во взрослых гельминтов. Таким образом, широкому распространению токсокароза среди животных спо- собствует совершенный механизм передачи возбудителя, при котором сочетаются прямой (заражение яйцами из окружающей среды), вертикальный (заражение плода личинками через плаценту), трансмаммарный (передача личинок с моло- ком) пути передачи и заражение через паратенических хозяев. Продолжительность жизни половозрелых особей в кишечнике основных хозяев составляет 4–6 мес. Самка Т. canis откладывает более 200 тыс. яиц в сутки. Срок созревания яиц в почве (от 5 сут до 1 мес) зависит от температуры окружающей среды и влажности. В средней полосе России яйца токсокар могут сохранять жизнеспособность в почве в течение всего года.
ЭпидемиологияТоксокароз — зооноз с оральным механизмом передачи. Источник инвазии в синантропном очаге для людей — собаки, загрязняющие почву фекалиями, кото- рые содержат яйца токсокар. Люди не могут быть источником инфекции, так как в организме человека взрослые особи паразита из личинок не образуются и яйца не выделяются. Человек служит резервуарным, или паратеническим, хозяином токсокар, однако фактически он «экологический тупик». Поражённость собак токсокарами колеблется в зависимости от пола, возрас- та, способа их содержания и практически во всех районах очень высокая — до 40–50% и выше, а в сельской местности может достигать 100%. Наибольшую поражённость отмечают у щенков в возрасте 1–3 мес. Прямой контакт с собаками не играет существенной роли в заражении людей. Основные предпосылки пере- дачи возбудителя — загрязнённость почвы яйцами гельминта и контакт людей с ней. В настоящее время доказано значение геофагии в поражённости детей токсокарозом. Геофагия — пример прямого заражения возбудителями гельмин- тозов без участия каких-либо других факторов передачи, причём человек в этих случаях получает массивную инвазию, предопределяющую, как правило, тяжёлое течение болезни. Отмечают высокую поражённость токсокарозом владельцев приусадебных, дачных земельных участков, огородов, а также людей, живущих во дворах, где выгуливают собак, что подтверждает роль бытового контакта с почвой при заражении яйцами токсокар. Яйца токсокар могут передаваться с овощами и столовой зеленью. Факторами передачи токсокар бывают контаминированная шерсть животных, вода, руки. Установлена роль тараканов в распространении гельминтоза: они поедают значительное количество яиц токсокар и выделяют в окружающую среду до 25% яиц в жизнеспособном состоянии. Токсокароз распространён повсеместно. Наиболее часто им болеют дети. Установлена относительно высокая поражённость некоторых профессиональных групп: ветеринаров, рабочих коммунального хозяйства, садоводов-любителей. Люди заражаются токсокарозом в течение всего года, однако чаще заражение про- исходит в летне-осенний период, когда количество яиц в почве и контакт с ней максимальны.
меры профилактикиПрофилактика включает соблюдение личной гигиены, обучение детей сани- тарным навыкам. Важны своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4–5 нед, а также беременных самок. Необходимо ограничивать численность безнадзор- ных собак, оборудовать специальные площадки для выгула. Следует проводить систематическую санитарно-просветительную работу среди населения, сообщать информацию о возможных источниках инвазии и путях передачи. Особого вни- мания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, владельцы домашних животных, персонал питомника служебных собак, землекопы и др.).
ПатогенезT. canis — несвойственный человеку возбудитель гельминтоза, личинки кото- рого никогда не превращаются во взрослых особей. Это возбудитель гельминто- за животных, способный в миграционной (ларвальной) стадии паразитировать у человека и вызывать заболевание, получившее название синдрома «Visceral larva migrans». Синдром характеризуется длительным рецидивирующим течением и полиорганными поражениями аллергической природы. В организме человека, как и у других партенических хозяев, циклы развития и миграции осуществля- ются следующим образом: из яиц токсокар, попавших в рот, а затем в желудок и тонкую кишку, выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает; их окружает воспалительный инфильтрат, и образуют- ся гранулёмы. При интенсивной инвазии гранулематозное поражение тканей наблюдают в лёгких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах. Личинка в организме человека может выжи- вать до 10 лет. Такая её жизнеспособность связана с выделением маскирующей субстанции, способной защитить личинку от агрессии эозинофилов и антител хозяина. Личинки гельминта, находящиеся в тканях, под влиянием различных факторов периодически возобновляют миграцию, что обусловливает рецидивы заболевания. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Экскреторно- секреторные антигены живых и соматические антигены погибших личинок оказывают сильное сенсибилизирующее действие с развитием реакций ГНТ и ГЗТ, которые проявляются отёками, кожной эритемой, нарушением проходимо- сти дыхательных путей. Определённое значение в патогенезе имеют иммунные комплексы «антиген–антитело». Недостаточно изучены факторы, определяю- щие возникновение токсокароза глаз. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не раз- вивается достаточно выраженная иммунная реакция организма. По сравнению с аскаридами и некоторыми другими гельминтами T. canis обладает наиболее сильным поливалентным иммуносупрессивным действием. Установлено, что при токсокарозе у детей уменьшается эффективность вакцинации и ревакцинации против кори, дифтерии и столбняка.
Клиническая картинаВыделяют две основные формы токсокароза — висцеральную и глазную. Некоторые исследователи предлагают подразделять токсокароз на следующие формы: G висцеральный токсокароз, включающий поражение дыхательной системы, пищеварительного тракта, мочеполовой системы, миокарда (редко); G токсокароз ЦНС; G токсокароз мышц; G токсокароз кожи; G токсокароз глаз; G диссеминированный токсокароз. По степени выраженности клинических проявлений различают токсокароз манифестный и бессимптомный, а по длительности течения — острый и хрониче- ский. Висцеральным токсокарозом болеют как дети, так и взрослые, однако у детей эта форма встречается намного чаще, особенно в возрасте от 1,5 до 6 лет. Клиническая картина токсокароза малоспецифична и имеет сходство с клиническими сим- птомами острой фазы других гельминтозов.Основные клинические проявления острого токсокароза — рецидивирующая лихорадка, лёгочный синдром, увеличе- ние размеров печени, полиаденопатия, кожные проявления, эозинофилия крови, гипергаммаглобулинемия.Температура тела чаще субфебрильная (в тяжёлых случаях инвазии — фебрильная), более выражена в период лёгочных проявлений.. У большинства заражённых, особенно у детей, умеренно увеличены периферические лимфатиче- ские узлы. Поражение дыхательной системы встречается у 50–65% больных висцераль- ным токсокарозом и может выражаться в различной степени — от катаральных явлений до тяжёлых астмоидных состояний.. Одна из наиболее серьёзных проблем, связанных с токсокаро- зом, — его взаимосвязь с бронхиальной астмой. Показано, что у 20% больных атопической формой бронхиальной астмы, протекающей с гиперэозинофилией, выявляют антитела к токсокарозному антигену (иммуноглобулины классов G и/ или Е). Гепатомегалию регистрируют у 40–80% больных. Печень при пальпации уплотнённая, гладкая, часто напряжённая, при этом примерно у 20% больных увеличена селезёнка. Установлена предрасполагающая роль токсокар в развитии пиогенных абсцессов печени, которые бывают как единичными, так и множе- ственными, располагаются в обеих долях печени. Абдоминальный синдром наблюдают в 60% случаев. Характерны боли в животе, вздутие живота, тошнота, иногда рвота, диарея. В хронической стадии токсокароза бывают обострения и ремиссии. После острого периода инвазия длительное время может протекать практически бессим- птомно или субклинически. В хронической стадии даже в период ремиссии у детей сохраняются субфебрилитет, слабость, ухудшение аппетита, иногда похудание, полиаденопатия, увеличение печени, иногда кожно-аллергический синдром. Одно из главных и наиболее постоянных проявлений висцеральной формы токсокароза — стойкая длительная эозинофилия крови, вплоть до развития эозинофильно-лейкемоидных реакций. Относительный уровень эозинофилов, как правило, превышает 30%, а в отдельных случаях может достигать 90%. Общее количество лейкоцитов также повышается до 15–20×109/л, а в некоторых случаях — до 80×109/л. Эозинофилия может сохраняться месяцами и даже года- ми. У детей нередко отмечают умеренную анемию. Характерны увеличение СОЭ, гипергаммаглобулинемия. При поражении печени повышены уровени билиру- бина и печёночных ферментов. При миграции личинок токсокар в головной мозг выявляют признаки пора- жения ЦНС (судороги типа «petit mal», эпилептиформные припадкиГлазной токсокароз чаще встречается у детей и подростков и редко сочетается с висцеральными поражениями. Наблюдаются два типа поражений — солитарные гранулёмы и хронические эндофтальмиты с экссудацией. При резком отёке может развиться экзофтальм. Количество эозинофилов в перифе- рической крови у больных токсокарозом глаз обычно нормальное или повышено незначительно.
ДиагностикаПрижизненный паразитологический диагноз токсокароза возможен крайне редко и только при исследовании биопсийного материала, когда в тканях удаёт- ся обнаружить и верифицировать личинки токсокар. Диагноз устанавливают на основании данных эпидемиологического анамнеза, клинической симптоматики. Учитывают наличие стойкой длительной эозинофилии, хотя при глазном токсока- розе она не всегда встречается. Указание на содержание в семье собаки или на тес- ный контакт с собаками, на геофагию свидетельствует об относительно высоком риске заражения токсокарозом. Иммунологические исследования направлены на определение содержания специфических IgG к антигену T. canis в сыворотке крови методом ИФА, кото- рый обладает высокой чувствительностью и достаточной специфичностью при висцеральной локализации личинок — 93,7 и 89,3% соответственно, однако недо- статочно информативен при поражении глаз. Титр антител 1:400 свидетельствует об инвазированности, но не о болезни; о заболевании токсокарозом говорит титр 1:800 и выше. У больных хронической формой с выраженным лёгочным син- дромом уровень специфических антител, как правило, повышен умеренно (1:800 или 1:1600). Однако у этой группы больных закономерно выявляют повышенное содержание в сыворотке крови специфических
ЛечениеЕдиной схемы этиотропной терапии токсокароза нет. Применяют противо- нематодозные препараты: албендазол, мебендазол, диэтилкарбамазин. Все пере- численные антигельминтные препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулёмах внутренних органов. В зарубежных странах средством выбора счи- тают диэтилкарбамазин, который в РФ зарегистрирован, но в аптечную сеть не поступает. • Албендазол назначают внутрь после еды в дозе 10–12 мг/кг в сутки в два при- ёма (утром и вечером) в течение 10–14 дней. В процессе лечения препаратом необходимо выполнять контрольные анализы крови (возможность развития агранулоцитоза) и биохимическое исследование (гепатотоксическое действие препарата). При небольшом повышении активности аминотрансфераз пре- парат не отменяют. • Мебендазол назначают внутрь по 200–300 мг в сутки в 2–3 приёма в течение 10–15 дней; проводят два цикла с интервалом 2 нед. • Диэтилкарбамазин назначают внутрь в дозе 3–4 мг/кг в сутки, курс лече- ния — 21 день. Противопаразитарную терапию при глазном токсокарозе проводят по тем же схемам, что и при висцеральном токсокарозе. Показания к лечению определяют индивидуально, в зависимости от характера поражения глаз и с учётом возможных осложнений в результате лечения. До начала цикла лечения рекомендуют приме- нять глюкокортикоиды в течение 1 мес (1 мг/кг преднизолона в сутки). Гранулёмы удаляют микрохирургическими методами, для разрушения личинок токсокар в средах глаза используют лазеркоагуляцию. Больным токсокарозом при лихорадке назначают жаропонижающие ЛС, для купирования аллергических проявлений — антигистаминные препараты, при наличии признаков бронхообструкции проводят бронхолитическую терапию. При бессимптомном течении инвазии с низкими титрами специфических анти- тел этиотропную терапию не проводят.
Трихоцефалёз
Трихоцефалёз (трихиуриаз, трихуроз лат. trichocephalosis, англ. trichocephaliasis, trichuriasis) — антропонозный геогельминтоз, характеризующийся хроническим течением с преимущественным нарушением функций ЖКТ. ЭтиологияВозбудитель — власоглав, Trichocephalus trichiurus, тип Nemathelminthes, класс Nematoda, отряд Enoplida, семейство Trichocephalidae. Передняя часть тела гельмин- та тонкая волосовидная, хвостовой отдел утолщён; отношение нитевидной части к утолщённой у самки составляет 2:1, у самца — 3:2. Длина тела самки 30–35 мм, тела самца — 30–45 мм. У самок задний конец изогнут, у самцов имеет вид спирали. Яйца власоглава имеют форму бочонка размером 0,02×0,05 мм, коричневую тол- стую оболочку, на полюсах расположены бесцветные пробочки. Взрослые особи гельминта паразитируют в толстой, чаще в слепой кишке. Здесь самки отклады- вают до 3500 яиц в сутки. Яйца с фекалиями попадают в окружающую среду. Они должны пройти инкубацию в почве в течение 3 нед и более, после чего личинка приобретает инвазионные свойства. В жизненном цикле Trichocephalus trichiurus отсутствует фаза миграции, паразит обладает низкой иммуногенностью. Когда яйцо проглочено, в тонкой кишке высвобождается личинка, она внедряется в вор- синки, через несколько дней перемещается в толстую кишку, где достигает зрело- сти через 3 мес. Среди взрослых особей преобладают самки. Продолжительность жизни власоглава около 5 лет.
ЭпидемиологияТрихоцефалёз относят к группе геогельминтозов. Источник загрязнения окру- жающей среды — больной человек. Созревание яиц власоглава в почве длится 20–25 дней. Человек заражается в результате заглатывания зрелых яиц с загряз- нёнными овощами, фруктами, ягодами, водой. Власоглав — убиквитарный пара- зит. Трихоцефалёз распространён преимущественно в тропических и субтропиче- ских странах, влажных районах умеренного климата. В Российской Федерации гельминтоз распространён на Северном Кавказе и в центральных чернозёмных областях. Болеют преимущественно дети в возрасте от 5 до 15 лет. В профилактике центральное место занимают мероприятия по охране почвы от фекального загряз- нения, а также соблюдение правил личной гигиены.
ПатогенезВ патогенезе трихоцефалёза главную роль отводят травмирующему действию возбудителя. Власоглавы тонким головным концом повреждают слизистую обо- лочку, проникая до подслизистого, а иногда и мышечного слоя. При интен- сивной инвазии наблюдают геморрагии, образование эрозий и язв в кишечни- ке. Власоглавы — факультативные гематофаги. Полагают, что инвазированные люди теряют 0,005 мл крови на одного паразита в день, поэтому наличие более 800 гельминтов в кишечнике у детей служит причиной гипохромной анемии. Сенсибилизирующее воздействие на организм метаболитов паразита также имеет определённое значение, но ограничивается чаще тканями кишки, что способствует развитию диареи. Клинические проявления гельминтоза очевидны при парази- тировании большого количества власоглавов. Симптомы болезни наблюдаются у людей, выделяющих более 5000 яиц возбудителя в 1 г фекалий.
Клиническая картинаУ большинства больных с низкой интенсивностью инвазии клинические про- явления выражены слабо или отсутствуют. При умеренной инвазии больные предъявляют жалобы на ухудшение аппетита, тошноту, слюнотечение, диарею, метеоризм. Возможны спастические боли в животе с локализацией в правой подвздошной области. Больные отмечают слабость, раздражительность, голово- кружение, головную боль. При массивной инвазии развивается гемоколит, про- являющийся болевым синдромом, тенезмами, кровянистым жидким стулом. Дети, больные трихоцефалёзом, отстают от сверстников в физическом и умственном развитии. В тропических странах трихоцефалёзу приписывают роль фактора, спо- собствующего развитию кишечного амёбиаза и его тяжёлому течению. Осложнения трихоцефалёза — выпадение прямой кишки, гипохромная анемия, дисбиоз кишечника, кахексия. Трихоцефалёз — фактор риска развития аппенди- цита.
ДиагностикаЛабораторная диагностика трихоцефалёза основана на обнаружении яиц гель- минтов в фекалиях методами обогащения, регламентированными Методическими указаниями (МУК 3.2.735-99). Взрослых гельминтов в кишечнике обнаруживают при эндоскопии (колоноскопия).
ЛечениеПротивопаразитарное лечение больных трихоцефалёзом проводят амбулатор- но. В госпитализации нуждаются больные с тяжёлым и осложнённым течением инвазии. Применяют следующие лекарственные препараты. • Албендазол — внутрь после еды по 400 мг один раз в сутки 3 дня подряд. • Мебендазол — внутрь по 100 мг два раза в сутки через 20–30 мин после еды в течение 3 дней. • Карбендацим — внутрь после еды по 10 мг/кг в сутки в течение 3–5 дней. При проведении противопаразитарного лечения назначать специальную диету и слабительные средства не требуется. При сохраняющихся нарушениях со сто- роны ЖКТ после этиотропной терапии назначают ферментные препараты и про- биотики. Трудоспособность нарушается при массивной инвазии. Сроки нетрудоспособ- ности определяют индивидуально. В случаях упорной инвазии проводят повторный курс лечения спустя 3–4 нед. Контрольное исследование фекалий необходимо через 3–4 нед после заверше- ния курса лечения антигельминтным препаратом.
Энтеробиоз
Энтеробиоз (лат. enterobiosis; англ. enterobiasis, oxyuriasis) — антропонозный контагиозный гельминтоз человека, характеризующийся перианальным зудом и кишечными расстройствами.
ЭтиологияВозбудитель энтеробиоза — острица (Enterobius vermicularis), относящаяся к типу Nemathelminthes, классу Nematoda, отряду Rhabditida, семейству Oxyuridae. Тело взрослых гельминтов веретенообразное; длина самки 9–12 мм, самца — 3–5 мм. У самки хвостовой конец заострён, у самца — спирально загнут на вентральную сторону. Яйца асимметричной, продолговатой формы, размером 0,05×0,02 мм; оболочка их прозрачная, с двойным контуром. Зрелая самка паразитирует в слепой кишке. В ночное время, когда сфинктер расслабляется, она самостоятельно выхо- дит через анальное отверстие и на перианальных складках откладывает от 5000 до 15 000 яиц, после чего погибает. Содержащийся в яйце зародыш развивается в инвазионную личинку в течение 4–5 ч. Яйца, относительно устойчивые к высы- ханию, загрязняют нательное и постельное бельё, где сохраняют инвазивность до 2–3 нед. Особенность жизненного цикла E. vermicularis — отсутствие фазы мигра- ции и низкая иммуногенность. Длительность жизни остриц с момента заражения до выхождения зрелых самок для яйцекладки составляет около 30 сут.
ЭпидемиологияИсточником заражения служит только инвазированный человек. Механизм заражения фекально-оральный. Основной фактор передачи — загрязнённые яйцами остриц руки, а также предметы домашнего обихода, игрушки. Яйца остриц находят на полу, коврах, ночных горшках и др. Расчёсы из-за сильного зуда в перианальной области способствуют скоплению яиц под ногтями, где личинки заканчивают развитие до инвазионного состояния. Иногда возможна ретроин- вазия, когда яйца остриц созревают в аногенитальной зоне, личинки заползают обратно в кишечник и там созревают. Контагиозность очень высока. Несмотря на небольшую длительность жизни остриц, вследствие возможности частых повтор- ных заражений энтеробиоз может длиться годами. Энтеробиоз распространён повсеместно, преимущественно в странах с умеренным климатом. Интенсивность поражения в значительной степени зависит от санитарной культуры населения. Энтеробиозом в основном поражаются дети дошкольного и младшего школьного возраста. По оценкам ВОЗ, в мире этим гельминтозом поражены 350 млн человек, в России энтеробиоз — наиболее распространённый из гельминтозов.
меры профилактикиВ профилактике энтеробиоза значение придают выявлению источника инвазии и устранению путей передачи возбудителя. С этой целью один раз в год (после летнего периода при формировании детского коллектива или по эпидемическим показани- ям) проводят плановые профилактические обследования детей и обслуживающего персонала. Детей, больных энтеробиозом, в период лечения и проведения кон- трольного обследования отстраняют от посещения дошкольных и образовательных учреждений. Если выявлено 20% и более заражённых энтеробиозом при проведе- нии плановых профилактических обследований в организованных коллективах, в соответствии с нормативными документами одновременно всем детям и персоналу проводят противогельминтное лечение (двукратно с интервалом в 2 нед). В очаге энтеробиоза необходимо строго соблюдать чистоту жилища, служебных, школьных помещений. Лица, соприкасающиеся с больными, должны соблюдать чистоту тела, одежды, мыть руки перед едой и после посещения туалета.
ПатогенезОстрицы наносят механическое повреждение при фиксации на слизистой обо- лочке кишечника, особенно сильно травмируют её самки своим длинным и острым хвостовым концом. Механическое раздражение и действие продуктов жизнедея- тельности гельминтов вызывают зуд кожи в перианальной зоне. Острицы иногда погружаются в толщу слизистой оболочки кишки, при этом вокруг них формиру- ются гранулёмы. В результате заноса патогенных микроорганизмов в глубь тканей острицы могут способствовать развитию тифлита, аппендицита, а сами гельмин- ты, проникая в червеобразный отросток, способны вызвать аппендикулярную колику. Эктопическая миграция остриц бывает причиной вагинита, эндометрита и сальпингита у девочек. Описаны случаи, когда гельминтов находили в органах брюшной полости при нарушении целостности кишечной стенки, обусловленном другими болезнями, на фоне которых протекала инвазия.
Клиническая картинаКлинические проявления энтеробиоза больше выражены у детей, у взрослых гельминтоз может протекать бессимптомно или субклинически. Наиболее частый симптом — зуд в области заднего прохода. При низкой инвазии зуд возникает периодически, по мере созревания очередных поколений самок остриц. Зуд появ- ляется вечером или ночью, когда гельминты выползают из анального отверстия. При интенсивной инвазии зуд и жжение становятся постоянными и изнуряющими, распространяются на область промежности, половые органы. Длительное и силь- ное расчёсывание зудящих мест (вокруг заднего прохода, в области промежности, половых губ) способствует лихенизации кожи и развитию экзематозного дерма- тита, пиодермии, сфинктерита, иногда парапроктита. Энтеробиоз во многих слу- чаях бывает «пусковым фактором» зудящих дерматозов аногенитальной области. Больные, особенно дети, становятся раздражительными, жалуются на плохой сон, повышенную утомляемость; у детей регистрируются обмороки, эпилептиформные припадки, ночное недержание мочи. При массивной инвазии возникают наруше- ния со стороны ЖКТ: боли и урчание в животе, метеоризм, тошнота, рвота, запор или понос, иногда с примесью слизи. При проникновении остриц в червеобразный отросток могут появиться симптомы острого живота, в таких случаях больных оперируют: в удалённом аппендиксе обнаруживают катаральные изменения, в его просвете и толще слизистой оболочки находят яйца и взрослых гельминтов.
ДиагностикаВзрослых гельминтов иногда обнаруживают на поверхности испражнений. Метод выбора для выявления яиц остриц — исследование материала (соскоба), полученного с перианальных складок с помощью тампона, шпателя, прозрачной липкой ленты, методом отпечатка с применением стеклянных глазных палочек с клеевым слоем по Рабиновичу. Рекомендуют не менее трёх повторных исследова- ний, чтобы полностью исключить вероятность инвазии. ЛечениеПрепараты выбора — албендазол, мебендазол, карбендацим; в качестве альтер- нативны — пирантел. Албендазол назначают внутрь: взрослым по 400 мг однократно, детям от 2 лет — 5 мг/кг однократно; повторный приём в той же дозе через 2 нед. Мебендазол внутрь по 10 мг/кг однократно; повторный приём в той же дозе через 2 нед. Карбендацим внутрь по 10 мг/кг в три приёма в течение 1 дня; повторный приём в той же дозе через 2 нед. Пирантел внутрь по 5–10 мг/кг однократно; повторный приём в той же дозе через 2 нед. Необходимость повторного лечения выбранным антигельминтным пре- паратом через 2 нед связана с тем, что из-за возможности ре- и суперинвазий один курс может не оказать должного эффекта. Непременные условия успеш- ной дегельминтизации при энтеробиозе — одновременное лечение всех членов семьи (детского коллектива) и строгое соблюдение гигиенического режима для исключения повторного заражения. Перед лечением проводят тщательную влажную уборку помещения. Больного ребёнка рекомендуется вымыть (душ), перед сном сменить нижнее бельё, надеть трусы, плотно облегающие бёдра. Утром ребёнка необходимо подмыть, сменить нижнее бельё, постельное белье заменить или прогладить горячим утюгом. В помещении ежедневно следует проводить влажную уборку. То же самое выполняют при проведении повтор- ного курса лечения. Контроль за эффективностью лечения с помощью указанных выше парази- тологических методов проводят через 15 дней после полного завершения курса лечения.
Трихинеллёз
Tрихинеллёз (лат. trichinellosis) — гельминтоз, вызываемый паразитирующими в организме человека нематодами рода Trichinella. Характеризуется острым тече- нием, лихорадкой, болями в мышцах, отёками, высокой эозинофилией и различ- ными аллергическими проявлениями.
ЭтиологияВозбудители трихинеллёза — круглые черви семейства Trichinellidae, вклю- чающего два вида — Trichinellа spiralis c тремя вариететами (T. s. spiralis, T. s. nativa, T. s. nelsoni) и Trichinella pseudospiralis. В патологии населения России наиболь- шее значение имеют T. s. spiralis и T. s. nativa. Трихинеллы — мелкие нематоды с цилиндрическим бесцветным телом, покры- тым прозрачной кутикулой кольчатой структуры. Длина неоплодотворённой самки 1,5–1,8 мм, оплодотворённой — до 4,4 мм, половозрелого самца — около 1,2–2 мм, диаметр гельминтов менее 0,5 мм. В отличие от других нематод трихи- неллы — живородящие гельминты. Их личинки, юные трихинеллы, имеют палоч-ковидную форму, длину до 0,1 мм; через 18–20 дней развития личинка удлиняется до 0,7–1,0 мм. Один и тот же организм теплокровного животного для трихинелл служит сна- чала дефинитивным (кишечные трихинеллы), а затем промежуточным (инкапсу- лированные в мышцах личинки) хозяином. В организм нового хозяина паразит попадает с мясом животных, в котором содержатся живые инкапсулированные личинки. Под действием желудочного сока капсула растворяется, личинки в тон- кой кишке через час активно внедряются в слизистую оболочку. На 4–7-е сутки самки начинают производить живых личинок. Каждая самка в течение репро- дуктивного периода, длящегося 10–30 дней, рождает от 200 до 2000 личинок. Из кишечника личинки током крови разносятся по всему организму. Дальнейшее развитие паразита возможно только в поперечнополосатых мышцах. На третьей неделе после заражения личинки становятся инвазионными и принимают типич- ную спиралевидную форму. К началу второго месяца после заражения вокруг них в мышцах формируется фиброзная капсула, которая через 6 мес начинает обыз- вествляться. В капсулах личинки сохраняют жизнеспособность 5–10 лет и более. В мышцах человека капсулы личинок трихинелл размером 0,3–0,6 мм всегда имеют лимоновидную форму. Личинки трихинелл, находящиеся в мышцах животных, устойчивы к высо- ким и низким температурам. Нагревание мяса, содержащего инкапсулированные личинки трихинелл, в микроволновой печи до 81 °С не обеспечивает их инактива- ции. При варке куска мяса толщиной около 10 см личинки погибают только через 2–2,5 ч. Личинки устойчивы к таким видам кулинарной обработки, как соление, копчение, замораживание. Наибольшую опасность представляют термически не обработанные мясные продукты: строганина, сало (шпик) и т.д.
ЭпидемиологияИсточником возбудителя инфекции для человека служат поражённые трихи- неллами домашние и дикие животные. Механизм заражения оральный. Человек заражается при употреблении в пищу инвазированного трихинеллами мяса: чаще свинины, реже мяса диких животных (медведя, кабана, барсука, моржа и др.). Трихинеллёз — природно-очаговый биогельминтоз. Чётких границ между природными и синантропными очагами во многих случаях провести не удаётся, так как возможен обмен возбудителем между дикими и домашними животными. Известно более 100 видов млекопитающих, которые могут быть хозяевами трихи- нелл. Возбудитель циркулирует между хищными (бурые и белые медведи, псовые, кошачьи, куньи), факультативно-плотоядными парнокопытными животными (кабан, северный олень, лось) и грызунами (крысы, полёвки, лемминги и др.). Возможно также заражение ластоногих (морж, тюлень) и китообразных (белуха). Заболеваемость трихинеллёзом часто носит групповой характер. Ареал распространения трихинеллёза среди людей соответствует таковому среди животных. В России синантропный трихинеллёз распростра- нён в умеренно-северных, умеренных и южных зонах, на юге Дальнего Востока, Камчатке. Основные районы трихинеллёза, где заражение связано с употреблением в пищу мяса диких животных, — это Магаданская, Камчатская области, Красноярский край, Республика Саха и Хабаровский край. Очаги смешанного типа с циркуляцией возбудителя между синантропными (свинья, кошка, собака) и дикими (кабан, медведь, грызуны) животными встречаются на Северном Кавказе.
меры профилактикиМеры профилактики паразитарных болезней на территории Российской Федерации регламентирует Санитарные правила и нормы 3.2.1333-03. Основу профилактики трихинеллёза составляют обеспечение ветеринарно-санитарного надзора и санитарно-просветительная работа. Для предупреждения заболева- ния людей наибольшее значение имеют обязательная ветеринарная экспертиза используемого в пищу мяса, которое допускается к pеализации только после тpихинеллоскопии. Исследованию подлежат также и туши диких животных, добы- тых на охоте. Большое значение имеет информирование населения через средства массовой информации о гельминтозе и путях его распространения, а также рас- пространение зоотехнических знаний сpеди лиц, содеpжащих свиней в личном хозяйстве. По каждому случаю заболевания трихинеллёзом проводят экстренное эпидемиологическое расследование с целью выявить источник инвазии и предот- вратить её распространение. Всем лицам, заведомо употреблявшим в пищу мясные продукты, инвазированные трихинеллами, проводят превентивное лечение.
ПатогенезВ основе патогенеза трихинеллёза лежит сенсибилизация организма к анти- генам гельминта, проявляющаяся в разной степени в кишечной, миграцион- ной и мышечной стадиях инвазии. К концу первой недели после заражения преимущественно в тонкой кишке обнаруживают самок трихинелл, погружён- ных в слизистую оболочку, вокруг которых развивается местная катарально- геморрагическая воспалительная реакция. При тяжёлой инвазии наблюда- ются язвенно-некротические повреждения слизистой оболочки кишечника. Взpослые особи гельминта выделяют иммуносупpессивные вещества, подавля- ющие буpную воспалительную pеакцию, что способствует мигpации личинок. В тощей кишке активизиpуется система кининов, других гоpмонов, вызывающих функциональные pасстpойства, болевой синдpом. Метаболиты мигрирующих личинок, продукты, освобождающиеся после их гибели, — это антигены, обла- дающие сенсибилизирующим, ферментативным и токсическим свойствами. Вследствие этого развиваются выраженные аллергические реакции с пораже- нием кровеносных сосудов, коагуляционными нарушениями, тканевым отёком, повышением секреторной активности слизистых оболочек. На второй неделе личинок обнаруживают не только в скелетных мышцах, но и в миокарде, лёг- ких, почках, головном мозге. В паренхиматозных органах личинки погибают. Развивающиеся иммунопатологические реакции ведут к тяжёлым поражени- ям: миокардиту, менингоэнцефалиту, пневмонии. Воспалительные процессы со временем стихают, но через 5–6 нед могут сменяться дистрофическими, последствия которых исчезают только через 6–12 мес. Из скелетных мышц чаще всего поражаются группы с обильным кровоснабжением (межрёберные, жевательные, глазодвигательные мышцы, диафрагма, мышцы шеи, языка, верхних и нижних конечностей). У больных с тяжёлой формой болезни нахо- дят 50–100 и более личинок трихинелл в 1 г мышечной массы. К концу третьей недели личинки приобретают спиралевидную форму, вокруг них наблюдается интенсивная клеточная инфильтрация, на месте которой затем формируется фиброзная капсула. Процесс образования капсулы нарушается при чрезмер- ной антигенной нагрузке (при массивной инвазии), а также под воздействием веществ с иммунодепрессивными свойствами (глюкокортикоиды и др.). В паренхиматозных органах встречаются узелковые инфильтраты. В миокарде личинки трихинелл обусловливают появление множественных воспалитель- ных очагов в интерстициальной ткани, но настоящие капсулы в сердечной мышце не формируются. При интенсивной инвазии в миокарде развиваются очагово-диффузная воспалительная реакция и дистрофические изменения; возможны образование гранулём и развитие васкулитов с поражением артери- ол и капилляров мозга и мозговых оболочек. Для трихинеллёза характерен стойкий нестерильный иммунитет, который обу- словлен наличием инкапсулированных личинок возбудителя в мышцах заражён- ных людей. Высокое содержание специфических антител в сыворотке крови отме- чается с конца второй недели и достигает максимума на 4–7-й неделе. Комплекс реакций в энтеpальной стадии предупреждает проникновение в кровоток значи- тельной части личинок, что ограничивает их распространение в организме. Клиническая картинаИнкубационный период при трихинеллёзе в среднем длится 10–25 дней, но может составлять от 5–8 дней до 6 нед.. В зависимости от характера клинического течения различают следующие формы трихинеллёза: бессимптомную, абортивную, лёгкую, средней степени тяжести и тяжёлую. Первые симптомы в виде тошноты, рвоты, жидкого стула, болей в животе у некоторых больных появляются в ближайшие дни после употребления заражён- ного мяса и могут длиться от нескольких дней до 6 нед. При бессимптомной форме единственным проявлением может быть эозинофи- лия крови. Для абортивной формы характерны кратковременные (длительностью 1–2 дня) клинические проявления. Основные симптомы трихинеллёза — лихорадка, боли в мышцах, миастения, отёки, гиперэозинофилия крови. Лихорадка ремиттирующего, постоянного или неправильного типа. В зависи- мости от степени инвазии повышенная температура тела у больных сохраняется от нескольких дней до 2 нед и дольше. Отёчный синдром появляется и нарастает довольно быстро — в течение 1–5 дней. При лёгкой и среднетяжёлой формах болезни отёки сохраняются 1–2 (реже до 3) нед, при тяжёлом течении отёчный синдром развивается мед- леннее, но сохраняется дольше и может рецидивировать. Сначала, как правило, появляется периорбитальный отёк, сопровождающийся конъюнктивитом и затем распространяющийся на лицо. В тяжёлых случаях отёки переходят на шею, туловище, конечности (неблагоприятный прогностический признак). У больных трихинеллёзом наблюдаются макулопапулёзные высыпания на коже, иногда при- обретающие геморрагический характер, подконъюнктивальные и подногтевые кровоизлияния. Мышечный синдром проявляется миалгией, которая при тяжёлом течении принимает генерализованный характер, сопровождается миастенией. Боли появ- ляются сначала в мышцах конечностей, затем в других группах мышц, в том числе жевательных, языка и глотки, межребёрных, глазодвигательных. В поздней стадии трихинеллёза могут развиться мышечные контрактуры, приводящие к обездвижи- ванию больного. При поражении лёгких, развивающемся в течение первых 2 нед болезни, наблюдаются кашель, иногда с примесью крови в мокроте, признаки бронхита, на рентгеновских снимках определяются «летучие» инфильтраты в лёгких. В периферической крови обычно с 14 дня нарастают эозинофилия, лейкоци- тоз, характерны гипопротеинемия (снижено содержание альбуминов), снижение уровня калия, кальция, повышение активности ферментов (КФК, АСТ и др.) в сыворотке крови. Эозинофилия достигает максимальных значений на 2–4 неделе и может сохраняться на уровне 10–15% в течение 2–3 мес и дольше. Наблюдается определённая зависимость между высотой эозинофилии и выраженностью клини- ческих признаков трихинеллёза. У больных с тяжёлым течением эозинофилия в периферической крови может быть незначительной или даже отсутствовать. Трихинеллёз легкого течения проявляется небольшим повышением температу- ры тела (до 38 °С), отёком век, слабо выраженными болями в мышцах конечностей и невысокой эозинофилией. Для трихинеллёза средней степени тяжести характерны инкубационный пери- од 2–3 нед, острое начало с лихорадкой до 39 °С в течение 1–2 нед, отёком лица, умеренными болями в мышцах конечностей, лейкоцитозом 9–14×109/л и эозино- филией 20–25% и выше. Для трихинеллёза тяжёлого течения характерны короткий инкубационный период (менее 2 нед), длительная высокая температура не менее 2 нед, генерали- зованные отёки, в значительной степени обусловленные ускоренным катаболиз- мом белка и гипопротеинемией, миалгии с мышечными контрактурами и полной обездвиженностью больного. В гемограмме — гиперлейкоцитоз (до 20×109/л), гиперэозинофилия (до 50% и выше), однако при крайне тяжёлом течении эозино- филия может отсутствовать или быть незначительной (плохой прогностический признак). Мышечные боли и отёчность лица могут периодически рецидивировать, сопровождаясь лихорадкой и другими симптомами. Рецидивы протекают легче первичного заболевания.
ДиагностикаВо время вспышек и групповых заболеваний при наличии типичных сим- птомов у больных постановка диагноза трихинеллёза не вызывает трудностей. Необходимо установить общий источник заражения и, по возможности, провести исследование остатков пищи (мяса или мясных продуктов) на наличие личинок трихинелл. При отсутствии данных об источнике заражения иногда прибегают к биопсии мышц (дельтовидной или икроножной у лежачих больных или длинной мышцы спины у ходячих больных): кусочек мышечной ткани массой 1 г исследуют под микроскопом при малом увеличении на наличие личинок трихинелл. Серологические методы диагностики можно использовать только на 3-й неде- ле болезни, так как в первые 2 нед преобладают реакции местного иммунитета (кишечная фаза инвазии), и концентрация специфических антител в крови низкая. Используют ИФА с антигеном T. spiralis и РНГА. Сроки появления диагностических титров антител зависят от интенсивности инвазии и вида возбудителя: у больных трихинеллёзом, которые заразились при употреблении мяса свиньи, сильно инвази- рованного трихинеллами, антитела выявляются на 15–20-е сутки после заражения; если интенсивность инвазии меньше, сроки выявления антител удлиняются. При заражении мясом диких животных (T. s. nativa) начальные сроки выявления антител могут составлять до 1,5 мес. Титры специфических антител могут нарастать в течение 2–4 мес после заражения, заметно снижаясь через 4–5 мес, однако могут оставаться на диагностическом уровне до 1,5 года, а при интенсивном заражении — до 2–5 лет. Для ранней серологической диагностики трихинеллёза желательна одновременная постановка двух серологических реакций: ИФА и РНГА. Чувствительность в этих случаях достигает 90–100% и специфичность — 70–80%. У лиц, употреблявших заражённое трихинеллами мясо, проводят серологическое обследование через 2–3 нед после превентивного лечения. Диагностические показатели серологических реакций — подтверждение того, что эти лица переболели трихинеллёзом. У всех больных трихинеллёзом, наряду с клиническими анализами крови и мочи, проводят биохимический анализ крови, ЭКГ, рентгенологическое исследо- вание лёгких, определяют уровень электролитов в плазме крови.
ЛечениеПоказания к госпитализации Лечение больных среднетяжёлой и тяжёлой формой трихинеллёза проводят в условиях инфекционного стационара или ЛПУ общетерапевтического профи-ля. Лечение в значительной степени индивидуально и включает специфическую (этиотропную) и патогенетическую терапию. Медикаментозная терапия Противопаразитарная терапия направлена на уничтожение кишечных трихинелл, пресечение продукции личинок, нарушение процесса инкапсуляции и рост гибели мышечных трихинелл. Для этих целей применяют албендазол и мебендазол. Албендазол назначают внутрь после еды по 400 мг два раза в сутки больным с массой тела 60 кг и более или по 15 мг/кг в сутки в два приёма больным с массой тела менее 60 кг. Длительность лечения 14 дней. Мебендазол назначают внутрь через 20–30 мин после еды в дозе 10 мг/кг в сутки в 3 приёма. Длительность курса лечения 14 дней. При лёгком течении болезни эти же препараты назначают курсом длительно- стью до 7 дней. Превентивное противопаразитарное лечение лиц, употреблявших в пищу инвазированные мясные продукты, проводят албендазолом в тех же дозах в течение 5–7 дней. Наиболее эффективна этиотропная терапия в инкубационном периоде, когда можно предотвратить клинические проявления, или в первые дни болезни, когда трихинеллы ещё находятся в кишечнике. Во время мышечной ста- дии заболевания и инкапсуляции эффективность этиотропной терапии значитель- но ниже, и её применение в этот период может даже способствовать обострению болезни. Больным назначают антигистаминные препараты, ингибиторы простагланди- нов, НПВС. При тяжёлой инвазии с неврологическими расстройствами, миокар- дитом, ИТШ, лёгочной недостаточностью используют глюкокортикоиды: обычно преднизолон в суточной дозе 20–60 (по показаниям до 80) мг внутрь в течение 5–7 дней. В связи с тем что глюкокортикоиды могут удлинять период и количе- ство ларвопродукции в кишечнике, рекомендуют назначать противопаразитарные препараты (албендазол или мебендазол) в течение всего периода применения глюкокортикоидов и нескольких дней после их отмены. Опасность представляют также возможные язвенные поражения кишечника в сочетании с нарушениями в системе гемостаза. У таких больных резко возрастает риск ульцерогенного дей- ствия глюкокортикоидов, особенно при одновременном назначении НПВС (индо- метацин, диклофенак и т.п.). В этих случаях для профилактики язвенных пораже- ний в ЖКТ рекомендуют применять ингибиторы протонного насоса (омепразол и др.). Больным трихинеллёзом тяжёлого течения с генерализованными отёками (вследствие ускоренного катаболизма белка и гипопротеинемии) рекомендуют инфузионную терапию с введением дезинтоксикационных средств и препаратов для парентерального белкового питания.
Дифиллоботриозы
Дифиллоботриозы (лат. diphyllobothriosis; англ. diphyllobothriasis, fish tapeworm infection) — кишечные гельминтозы, вызываемые лентецами. Характеризуются хроническим течением с преимущественным нарушением деятельности ЖКТ и развитием мегалобластной анемии.
ЭтиологияВозбудители дифиллоботриозов человека — лентец широкий (Diphyllobothrium latum) и ряд так называемых малых лентецов (более 10 видов дифиллоботриид). D. latum относят к типу Plathelminthes, классу Cestoda, семейству Diphyllobothriidae. Лентец широкий достигает в длину 10 м и более, на сколексе имеет две щелевид- ные присоски, с помощью которых он прикрепляется к стенке тонкой кишки чело- века. Тело гельминта состоит из 3–4 тыс. члеников, поперечный размер которых больше продольного. В зрелых гермафродитных члениках формируются яйца овальной формы, покрытые желтовато-коричневой оболочкой с крышечкой на одном конце. Развитие D. latum происходит со сменой трёх хозяев. Окончательные хозяева — человек, реже животные, питающиеся рыбой (кошка, собака, медведь, лисица и др.). В отличие от цепней зрелые членики лентеца не отрываются от строби- лы. Яйца выделяются с фекалиями и сохраняют жизнеспособность в течение 3–30 дней, но продолжают развитие только при попадании в воду. В воде через 2–3 нед из яйца выходит корацидий, которого заглатывает промежуточный хозя- ин. В его теле происходит развитие второй личиночной стадии — процеркоида. Рачков, содержащих инвазионные личинки, проглатывает дополнительный хозя- ин — хищная (щука, окунь, ёрш, налим) или проходная лососёвая рыба (кета, горбуша), — в кишечнике которого рачки перевариваются, а процеркоиды мигри- руют в мышцы, икру, печень и другие органы, где превращаются в плероцеркоиды (инвазионная для человека стадия).
ЭпидемиологияОсновным источником заражения окружающей среды служит человек, опреде- лённую роль могут играть домашние и дикие животные, питающиеся рыбой. Механизм заражения человека пероральный. Факторы передачи — инвазирован- ная сырая, недостаточно просоленная или плохо термически обработанная рыба, а также икра. Заболеваемость дифиллоботриозом имеет очаговый характер. Чаще поражается взрослое население, особенно занятое ловлей и переработкой рыбы. Дифиллоботриозы распространены преимущественно в северном полушарии: в странах севера Европы, США, Канаде; в России основные очаги гельминтоза расположены в бассейне рек Северо-Западного региона, Волги, Енисея, Лены, на Сахалине.
меры профилактикиЧтобы предотвратить заражение, употреблять в пищу рыбу следует после тща- тельной термической обработки или длительного посола (последнее относится и к употреблению икры). Необходимо охранять водоёмы от загрязнения фекалиями человека и животных, проводить санитарно-просветительную работу среди насе- ления очагов.
ПатогенезЛентецы, прикрепляясь к слизистой оболочке тонкой кишки, ущемляют её ботриями, изъязвляя, некротизируя и атрофируя травмируемые участки. При множественной инвазии гельминты могут вызватъ непроходимость кишеч- ника. Эозинофилия и катаральные явления в слизистой оболочке в раннем периоде болезни обусловлены сенсибилизацией организма к антигенам гель- минта. Эндогенный гипо- и авитаминоз В12 и фолиевой кислоты лежит в основе патогенеза дифиллоботриозной мегалобластной анемии. Гельминт выделяет специфический белковый компонент (рилизинг-фактор), нарушающий связь витамина В12 и гастромукопротеина. В результате длительного паразитирования возбудителя (до 20 лет), даже одной особи гельминта, анемия приобретает черты пернициозной и сопровождается поражением периферических нервов и спинно- го мозга.
Клиническая картинаДифиллоботриоз нередко протекает бессимптомно или со слабовыраженными ощущениями дискомфорта в животе. Однако при любом клиническом течении наблюдают отхождение крупных фрагментов гельминта с каловыми массами. При манифестном течении инвазии возникают боли в животе, периодически приобретающие схваткообразный характер, тошнота, гиперсаливация. Аппетит иногда повышен, но отмечаются похудание и снижение работоспособности. При развитии анемии более выражены повышенная утомляемость, головокружение, сердцебиение. Раннее проявление анемии — глоссит, сопровождающийся жжени- ем языка. В дальнейшем могут появиться боли при приёме пищи вследствие рас- пространения воспалительно-дистрофических изменений на дёсны, слизистую оболочку щёк, нёба, глотки и пищевода. В тяжёлых случаях наблюдается увели- чение печени и селезёнки. Неврологические нарушения при дифиллоботриозе: парестезии, нарушение чувства вибрации, онемение, атаксия — возникают чаще, чем при истинной пернициозной анемии, могут не сопровождаться признака- ми анемии. Позже нарушается проведение по боковым столбам, появляются спастичность, гиперрефлексия; больные становятся раздражительными, может развиться депрессия.
ДиагностикаДифиллоботриоз диагностируют, основываясь на клинико-эпидемиологических данных (употребление рыбы, сочетание диспепсического синдрома с признаками анемии), выявлении яиц гельминтов при копроовоскопическом исследовании или в результате исследования выделенных при дефекации фрагментов стробилы гельминта. В мазках периферической крови определяют анизо- и пойкилоцитоз, базофиль- ную зернистость эритроцитов (в них нередко видны тельца Жолли), ретикулоци- топению, тромбоцитопению, нейтропению. Дифиллоботриозная В12-дефицитная анемия развивается примерно у 2% инвазированных D. latum, примерно у 40% больных понижено содержание витамина в сыворотке крови. Чаще гематологиче- ские изменения регистрируют у лиц пожилого возраста. Медикаментозная терапияСпецифическое лечение проводят празиквантелем или никлозамидом (см. «Тениаринхоз»). При выраженной анемии и уровне цианокобаламина в сыворотке менее 100 пг/мл до дегельминтизации показано лечение цианокобаламином в дозе 200–400 мкг/кг в течение 2–4 нед.
Описторхоз
Описторхоз (лат. оpisthorchosis, англ. оpisthorchiasis, франц. оpisthorchiase) — природно-очаговый биогельминтоз с фекально- оральным механизмом передачи возбудителя, характеризующийся длительным течением и преимущественным поражением гепатоби- лиарной системы и поджелудочной железы.
ЭтиологияВозбудитель — Opisthorchis felineus (кошачья двуустка) принадле- жит к типу плоских червей (трематоды), классу сосальщиков. Имеет плоское удлинённое тело длиной 8–14 мм и диаметром 1–3,5 мм; снабжён двумя присосками — ротовой и брюшной (рис. 20-1, см. ). Описторхи — гермафродиты. Яйца бледно-жёлтые, почти бесцветные, с гладкой двухконтурной оболочкой, имеющей кры- шечку на слегка суженном полюсе и небольшое утолщение на противоположном конце. Размеры яиц — 23–24×11–19 мкм. Возбудитель обладает сложным циклом развития (рис. 20-2, см. ). Помимо окончательных, он имеет двух промежуточных и дополнительного хозяев. У дефинитивных (основных) хозяев гельминт паразитирует в половозрелой стадии своего развития. Из жёлчных ходов, жёлчного пузыря и протоков поджелудочной железы человека и плотоядных млекопитающих (кошки, соба- ки, лисица, песец, соболь, россомаха, свинья домашняя и др.) яйца паразитов вместе с жёлчью проникают в кишечник и затем попадают в окружающую среду. Дальнейшее развитие проходит в водоёмах, где описторхи сохраняют жизнеспособность до 6 мес и заглатываются первым промежуточным хозяином — пресновод- ным моллюском рода Codiella, в теле которого происходит ряд превращений: из яйца выходит мирацидий, образующий спороци- сту, в которой формируются редии, рождающие большое количе- ство личинок следующей стадии (церкариев). Последние выходят из моллюска и проникают в мышцы второго промежуточного хозяина — рыб семейства карповых (язь, сибирский елец, линь, европейская плотва, чебак, краснопёрка), где церкарии превращаются в метацеркариев, которые через 6 нед становятся инвазионными. Рыба, поражённая метацеркариями описторхов, — источник заражения человека и многих плотоядных животных. В желудке и двенадцатиперстной кишке окончательного хозяина проис- ходит эксцистирование метацеркариев. Под действием желудочного сока пере- вариваются ткань рыбы и соединительнотканная капсула, а под действием дуоденального сока метацеркарий освобождается от внутренней оболочки. Обладая положительным хемотаксисом к жёлчи, паразиты отыскивают отвер- стия жёлчного протока и через общий жёлчный проток проникают в жёлчные ходы и жёлчный пузырь, а иногда и в поджелудочную железу. Спустя 3–4 нед после заражения гельминты достигают половозрелого состояния и после опло- дотворения начинают выделять яйца. Продолжительность жизни описторхов достигает 15–25 лет. Яйца O. felineus устойчивы в окружающей среде: в пресной воде сохраняют жиз- неспособность около года. Личинки описторха погибают при варке рыбы цельным куском через 20 мин, в рыбном фарше — через 10 мин после начала кипячения. При засолке рыбы личинки погибают через 4–7 сут. Горячее копчение гибельно для возбудителя, а холодное не разрушает его.
ЭпидемиологияОписторхоз широко распространён на Евроазиатском континенте. Его реги- стрируют в ряде стран Восточной и Центральной Европы. В России и странах СНГ наиболее обширные очаги инфекции обнаруживают на территории Западной Сибири, Северного Казахстана (бассейн Оби и Иртыша), Пермской и Кировской областей и бассейнов рек Камы, Вятки, Днепра, Десны, Сейма, Северного Донца, Южного Буга. Самую напряжённую ситуацию отмечают в Западной Сибири, где расположен крупнейший Обь-Иртышский очаг инвазии. Восприимчивость населения к инвазии высокая. Поражённость описторхозом коренного населения севера РФ достигает 80–100% и связана с особенностями питания: употреблением термически не обработанной рыбы и высокой степе- нью инвазированности последней. Поражённость местного русского населения несколько ниже. Основной источник описторхоза в населённых пунктах — человек, домашние животные (кошки, свиньи) или синантропные грызуны. Механизм передачи — фекально-оральный, путь передачи — пищевой. Через 3–4 нед после заражения в течение многих лет (до 10–20) источник инва- зии выделяет с фекалиями в окружающую среду яйца описторхов. Источник заражения для человека — рыбы семейства карповых, инвазирован- ные метацеркариями и употребляемые в пищу в сыром или полусыром виде. Более других заражены язь, елец, плотва. Метацеркарии устойчивы к низким температурам (в замороженной рыбе они могут сохранять жизнеспособность при –40 °С до 7 ч, при –35 °С — до 14 ч, при –28 °С — 32 ч), но чувствительны к высоким: после выделения из рыбы они погибают при 55 °С в течение 5 мин. Описторхозу свойственна летне-осенняя сезонность. Несколько чаще болеют мужчины. Ежегодно на долю описторхоза приходится около 60% всех зарегистри- рованных биогельминтозов. После излечения стойкого иммунитета не возникает; часто наблюдают повторные случаи заражения. меры ПрофилактикиКомплекс мер по борьбе с описторхозом включает следующие направления: G обнаружение очагов и лечение больных описторхозом; проведение широкой санитарно-просветительной работы среди населения в очагах; G дегельминтизация домашних плотоядных животных; G охрана окружающей среды от фекального загрязнения; G качественная термическая обработка рыбы карповых пород перед употре- блением её в пищу; G борьба с промежуточными хозяевами описторхов и свободноплавающими стадиями паразита. В домашних условиях обеззараживать рыбу рекомендуют следующими спосо- бами: G прожаривать небольшие куски не менее 20 мин; G варить 20 мин с момента закипания; G выпекать рыбные пироги 40–60 мин; G применять крепкий посол (20% соли к массе рыбы) с 10-дневной выдерж- кой; G вялить мелкие карповые породы (плотва, елец) в течение 3 нед с 2–3-дневным предварительным посолом; G холодное копчение рыбы проводить после крепкого посола или промора- живания в течение 3–4 нед.
Патогенез• В основе патогенеза ранней стадии лежат токсико-аллергические реакции организма на метаболиты, выделяемые личинками в процессе их миграции и созревания, а также на антигены последних. В этой стадии наблюдают повышенную проницаемость сосудов печени и поджелудочной железы; про- дуктивный васкулит; эозинофильную инфильтрацию стромы органов, их отёчность; пролиферацию и десквамацию эпителия жёлчных ходов. В ЖКТ (в двенадцатиперстной кишке, печени, лёгких и др.) формируются эозинофиль- ные инфильтраты.
• В хронической стадии токсико-аллергические реакции сохраняются, но основные патологические изменения обусловлены жизнедеятельностью описторхов, которые своими присосками и шипиками оказывают раздра- жающее и повреждающее действие на стенку жёлчных и панкреатических протоков, жёлчного пузыря, вызывая воспалительную и регенеративно- гиперпластическую реакцию с развитием холангита и перихолангита, при- водящую к фиброзу органов. Скопления паразитов и их яиц замедляют ток жёлчи и панкреатического сока. Пролиферативные процессы при описторхозе, расцениваемые как предраковое состояние, в сочетании с действием экзогенных канцерогенов могут приводить к развитию холангиокарциномы. Ранний иммунный ответ при описторхозе сопровождается увеличением уров- ня общих IgМ в 10–12 раз с максимумом на 2–3-й неделе и снижением их кон- центрации через 6–8 нед, когда отмечают увеличение содержания IgG. В даль- нейшем концентрация антител падает ниже пороговых значений, что создаёт условия для реинвазии и длительного паразитирования описторхов в организме.
Клиническая картина Инкубационный период при описторхозе составляет 2–6 нед после употребле- ния в пищу поражённой рыбы. Заболевание характеризуется полиморфизмом клинической картины. Единой классификации описторхоза не существует. Выделяют острую фазу инвазии, которая может протекать бессимптомно или стёрто у коренных жителей эндемичных регионов при реинвазии или суперинфекции. Клинически выражен- ную форму острой фазы наблюдают у лиц, прибывших в эндемичный регион. Хроническую фазу болезни при отсутствии симптомов острой фазы расценивают как первично-хроническую; если же ей предшествует острая фаза — как вторично- хроническую. Органные поражения (желчевыводящих путей, поджелудочной железы, желудка и двенадцатиперстной кишки) могут сохраняться и после осво- бождения организма от описторхов, поэтому некоторые авторы выделяют резиду- альную фазу болезни. Острую фазу при бессимптомной инвазии диагностируют по яйцам паразита, обнаруженным в дуоденальном содержимом и фекалиях, по незначительной эози- нофилии и повышенному содержанию IgM. Стёртую форму, помимо этих критериев, характеризует кратковременный суб- фебрилитет. Клинически выраженная форма манифестирует внезапно возникшей лихорад- кой, болями в правом подреберье, миалгией, артралгией, высыпаниями на коже, увеличением селезёнки и печени, лейкоцитозом и гиперэозинофилией крови. При лёгкой форме лихорадка (около 38 °С) продолжается до 2 нед, возможны боли в животе неопределённой локализации, диарея, умеренный лейкоцитоз и эозинофилия. Среднетяжёлая форма характеризуется лихорадкой (38–39,5 °С) ремиттирую- щего, постоянного или неправильного типа длительностью до 3 нед, уртикарными высыпаниями на коже, миалгией и артралгией, болями в правом подреберье, в части случаев — умеренной диареей и рвотой. Печень и селезёнка увеличены; воз- можен астматический бронхит. Тяжёлому течению болезни свойственны высокая лихорадка, выраженная интоксикация (головная боль, бессонница, заторможенность или возбуждение, тахикардия), полиморфные кожные высыпания. Выражена картина гепатита. Характерен гиперлейкоцитоз (20–60×109/л), эозинофилия в пределах от 10 до 80–90%, увеличение СОЭ. Острая фаза болезни длится от 2–3 нед до 2 мес, после чего клинические сим- птомы стихают и болезнь переходит в хроническую фазу, признаки которой про- являются через несколько месяцев и даже лет и характеризуются значительным полиморфизмом. Чаще всего наблюдают поражение гепатобилиарной системы. Больные отмеча- ют тяжесть в правом подреберье и эпигастральной области, ухудшение аппетита, тошноту, рвоту, диарею. Печень немного увеличена, чувствительна при пальпации, плотноватая. Функциональные показатели обычно не изменены. Жёлчный пузырь увеличен, точка жёлчного пузыря болезненна; возможны приступы коликообраз- ных болей. При дуоденальном зондировании количество жёлчи увеличено, содер- жание лейкоцитов в ней повышено. При поражении поджелудочной железы отмечают боли опоясывающего харак- тера.
ДиагностикаДиагноз устанавливают на основании клинико-эпидемиологических и лабора- торных данных: употребление термически не обработанной, слабосолёной рыбы в эндемичных регионах; лихорадка, токсико-аллергический синдром; лейкоцитоз и эозинофилия в крови; в хронической фазе — симптомы холецистопанкреатита, гастродуоденита. Для клинической диагностики применяют ЭГДС, холецистографию, дуоде- нальное зондирование, УЗИ органов брюшной полости, определяют кислотность желудочного сока.
Специфическая лабораторная диагностикаПаразитологическая диагностика острого описторхоза невозможна, так как гельминты начинают выделять яйца только через 6 нед после начала инвазии. Для определения специфических антител используют ИФА. Применяют следующие тест-системы: G для определения IgM — «Описторхис-IgM-стрип»; G для определения IgG — «Тиатоп-стрип»; G для определения специфических ЦИК — «Описторх-ЦИК-стрип». Паразитологическое исследование жёлчи — наиболее достоверный метод диа- гностики описторхоза. Проводят микроскопическое исследование осадка трёх порций жёлчи. Дуоденальное зондирование — сложная и не всегда приемлемая процедура, малопригодная для массовых обследований. Именно поэтому наиболее распространена копроовоскопия, основанная на изучении морфологических осо- бенностей яиц описторхов. При исследовании кала используют различные мето- ды: качественный формалин-эфирный, химико-седиментационный Березанцева, количественный Столла и полуколичественный Като. Применяют также флотаци- онные методы Фюллеборна и Горячева. При незначительной инвазии яйца описторхов обнаруживают непостоянно, поэтому необходимо неоднократное паразитологическое обследование больных после процедур, стимулирующих желчеотток (тюбажи по Демьяновичу, приём холекинетиков).
ЛечениеЛечение больных описторхозом должно быть комплексным, индивидуальным и учитывать сопутствующие заболевания. Госпитализацию больных осуществляют по клиническим показаниям. Назначают щадящий режим, диету № 5 в течение 6 мес. Препарат выбора — празиквантел или его отечественный аналог ази- нокс♠. Лечение, как правило, амбулаторное (кроме больных с выраженными симптомами острой фазы, тяжёлыми органными поражениями, токсико- аллергическими проявлениями). В острой фазе терапию начинают после купи- рования лихорадки, устранения интоксикации и аллергических симптомов. Препарат назначают в суточной дозе 75 мг/кг массы тела после еды в три приёма с интервалом 4–6 ч. Максимальная разовая доза — 2 г, суточная — 6 г. Препарат не рекомендуют детям до двух лет и беременным (в I триместре). Кормящие женщины в день приёма и на следующий день не должны кормить ребёнка грудью. Противопоказано употребление алкоголя. Возможны кратков- ременные побочные эффекты: головная боль, головокружение, чувство опья- нения, диспепсические расстройства. Эффективность одного курса лечения составляет 90–94%. В острой фазе проводят дезинтоксикационную и десенсибилизирующую тера- пию с использованием антигистаминных препаратов. В тяжёлых случаях назнача- ют преднизолон по 40–60 мг в сутки в течение 5–7 дней, в хронической стадии — желчегонные препараты, спазмолитики, ферментные препараты, тюбаж с сер- нокислой магнезией, боржоми. При присоединении бактериальных осложнений применяют противомикробные препараты.
Эхинококкоз
Эхинококкозы — хронически протекающие биогельминтозы, вызываемые паразитированием у человека личинок цестод рода Echinococcus.
Гидатидозный эхинококкоз (однокамерный эхинококкоз, эхинококкоз цист- ный, лат. echinococcosis, англ. echinococcus disease) — хронический зоонозный биогельминтоз с фекально-оральным механизмом передачи возбудителя, харак- теризующийся образованием паразитарных кист в печени, реже в лёгких и других органах.
ЭтиологияВозбудителя гидатидозного эхинококкоза Echinococcus granulosus отно- сят к типу Plathelminthes, классу Cestoda, семейству Taeniidae. Половозрелый E. granulosus — это ленточный гельминт белого цвета длиной 3–8 мм. Он состо- ит из головки с четырьмя присосками и двойной коронкой крючьев, из шейки и 2–6 члеников. Последний членик заполнен маткой, содержащей яйца (онкос- феры), которые обладают инвазионной способностью и не нуждаются в дозре- вании в окружающей среде. Половозрелый гельминт паразитирует в тонкой кишке окончательного хозяина — плотоядных животных (собаки, волки, рыси, кошки и др.). Зрелые членики с фекалиями попадают в окружающую среду. Яйца обладают высокой устойчивостью во внешней среде, зимой сохраняют жизнеспособность до 6 мес. Личиночная стадия представляет собой пузырь, наполненный жидкостью. Стенка эхинококковой кисты (ларвоцисты) состоит из внутренней зароды- шевой (герминативной) и наружной (кутикулярной) оболочек. В результате реакции тканей хозяина вокруг эхинококковой кисты образуется плотная фиброзная оболочка. Из зародышевого слоя формируются выводковые кап- сулы, в которых развиваются сколексы. Зрелые сколексы выводятся из капсул и свободно плавают в жидкости, образуя так называемый гидатидный песок. В толще зародышевой оболочки из сколексов образуются дочерние пузыри; отрываясь, они также свободно плавают в жидкости. В полости дочерних могут образоваться внучатые пузыри, и все они содержат выводковые капсулы. Ларвоциста растёт в тканях промежуточного хозяина (овцы, крупный рогатый скот, лоси, северные олени, свиньи, зайцы и др). Человек, оказываясь в роли промежуточного хозяина, в жизненном цикле данного паразита становится биологическим тупиком.
ЭпидемиологияИсточником E. granulosus для человека чаще всего служат домашние собаки, реже — дикие животные (волки, шакалы и др.). Основной фактор передачи — руки, загрязнённые онкосферами эхинококка, которые в обилии находятся на шерсти инвазированных собак. Заражение человека может происходить также при сборе ягод и трав, употреблении воды из источников, загрязнённых яйцами гельминта. Заболевание чаще встречается в определённых профессиональных группах: у работников скотобоен, пастухов, кожевенников, охотников, чле- нов их семей, особенно детей. Существуют различные штаммы эхинококков, адаптированных к разным промежуточным и окончательным хозяевам. К некоторым штаммам у человека, в частности к «лошадиному штамму», распро- странённому в странах Западной Европы и Великобритании, отмечают опреде- лённую резистентность, в то время как «овечий штамм» высокопатогенен для человека. Гидатидозный эхинококкоз встречается на всех континентах. Чаще его реги- стрируют в странах с пастбищным скотоводством, особенно там, где традиционно для охраны овец и крупного рогатого скота используют собак. В южном полу- шарии интенсивность поражения особенно высока. В странах СНГ эхинококкоз распространён в регионах с развитым животноводством, главным образом овце- водством: в Закавказье, Казахстане и других странах Средней Азии, на Украине, в Молдове; регистрируют и в некоторых регионах России: на Северный Кавказе, в Поволжье, Западной Сибири, Бурятии, республике Саха (Якутия), горно-таёжной зоне Дальнего Востока. Меры профилактикиСостоят в соблюдении личной гигиены. Особая настороженность необходима при содержании собак в доме и уходе за животными. Проводят плановую дегель- минтизацию собак. В местах, неблагополучных по эхинококкозу, необходима плановая диспансеризация групп риска.
ПатогенезИз-за гематогенного пути распространения онкосферы эхинококка могут быть занесены в любой орган, но чаще всего эхинококковые кисты локализуются в печени (30–75%) и лёгких (15–20%), значительно реже в ЦНС (2–3%), селезёнке, поджелудочной железе, сердце, в трубчатых костях и почках (до 1%). Превращение онкосферы в ларвоцисту у инвазированного человека длится около 5 мес; за это время она достигает в диаметре 5–20 мм. Патологическое воздействие эхинококка обусловлено механическим и сенсибилизирующим факторами. У большинства пациентов поражается единственный орган одной солитарной кистой, но может развиваться и множественный эхинококкоз. Паразит имеет ряд приспособитель- ных механизмов, обеспечивающих его длительное развитие в организме промежу- точного хозяина. К ним относят потерю ларвоцистой части рецепторов в период формирования гиалиновой оболочки, выработку иммуносупрессоров, белковую мимикрию за счёт включения белков хозяина в свою оболочку. Размеры кист варьируют от 1 до 20 см (и более) в диаметре. Эхинококковая киста растёт мед- ленно в течение ряда лет, отодвигая ткани поражённых органов, где постепенно развиваются дистрофические изменения, склероз стромы и атрофия паренхимы. У 5–15% больных отмечают сдавление жёлчных протоков обызвествлёнными внутрипечёночными кистами. В лёгочной ткани вокруг погибшего паразита воз- никают ателектазы, очаги пневмосклероза, бронхоэктазы. Кисты, поражающие кости, постепенно разрушают структуру костной ткани, что приводит к патологи- ческим переломам. При длительном течении болезни может происходить нагное- ние и разрыв эхинококковых кист. При вскрытии кисты (самопроизвольно или в результате повреждения её стенок) развиваются сильные аллергические реакции на антигены, входящие в состав жидкости; высвобождение многочисленных ско- лексов ведёт к диссеминации возбудителя. Клиническая картинаРазличают следующие стадии гидатидозного эхинококкоза: доклиническую, неосложнённую и стадию осложнений. При наиболее частом поражении — эхинококкозе печени — первые призна- ки болезни обычно появляются через несколько лет и даже десятилетий после заражения. Нередко эхинококкоз диагностируют случайно (при плановой флюо- рографии, УЗИ) или при целенаправленном обследовании населения в очагах. Гидатидозный эхинококкоз чаще выявляют у лиц среднего возраста. В клини- чески манифестной стадии в неосложнённых случаях у больных эхинококкозом печени отмечают снижение работоспособности, общую слабость, диспепсиче- ские расстройства, головные боли, иногда аллергические проявления: кожные высыпания, зуд, эозинофилию в крови. Печень при пальпации увеличенная, плотная (при локализации пузыря в глубине паренхимы) или мягкая, эластичная (при поверхностном расположении кисты), при кальцификации — деревянисто- плотная. Симптоматика эхинококкоза лёгких определяется локализацией кисты и темпа- ми её роста. Даже небольшая киста, расположенная вблизи плевры, рано проявляет себя болевым синдромом, а при локализации у бронхиального ствола — упорным сухим кашлем, кровохарканьем, болями в груди, одышкой. Возможны деформация грудной клетки, сглаженность межрёберных промежутков, отставание при дыха- нии поражённой стороны, укорочение перкуторного звука и ослабление дыхания над кистой. При небольших единичных кистах симптомы могут отсутствовать, но течение болезни может резко измениться при вскрытии кисты. При прорыве в бронх появляются сильный кашель, удушье, цианоз, возможны тяжёлые аллер- гические реакции и аспирационная пневмония. Прорыв в плевральную полость приводит к развитию острого экссудативного плеврита, в тяжёлых случаях наступает анафилактический шок, а перфорация в полость перикарда бывает причиной внезапной смерти.
ДиагностикаПредполагать эхинококкоз позволяют клинические проявления (опухолевид- ное, медленно растущее образование в печени, лёгких или других органах) и эпи- демиологические данные. Сероиммунологические методы (ИФА, РНГА, РЛА) дают положительные результаты в 90% случаев и более при поражении печени, при эхинококкозе лёг- ких эффективность ниже (60%). Титры антител в раннем периоде инвазии, при невскрывшихся или медикаментозно не леченных кистах могут быть невысокими или реакции дают отрицательные результаты. Внутрикожную пробу с эхинококко- вым антигеном (известна как реакция Касони) в настоящее время не используют в связи с частым развитием аллергических осложнений. Паразитологическая диа- гностика возможна при прорыве эхинококковых кист в просвет полых органов — тогда сколексы или отдельные крючья паразита можно обнаружить в мокроте, дуоденальном содержимом, кале. Рентгенологические методы обследования, УЗИ, КТ и МРТ позволяют оценить характер и распространённость процесса. В лёгких на рентгенограмме обнаружи- вают округлые, часто неправильной формы образования равномерной плотности; они не обызвествляются, в то время как примерно в 50% случаев вокруг кист в печени обнаруживают кольцо обызвествления. Небольшие кисты выявляют с помощью томографии. УЗИ — один из наиболее эффективных методов диагности- ки при локализации эхиноккокозов печени и органов брюшной полости. УЗИ, как скрининг, позволяет определить наличие объёмного жидкостного образования в печени и гипертензию во внутри- и внепечёночных жёлчных протоках. КТ и МРТ обладают более высокой разрешающей способностью. КТ в осложнённых случа- ях используют для уточнения локализации кисты и её соотношения с соседними анатомическими образованиями. Алгоритм диагностики обтурационной желтухи эхинококкового генеза в обязательном порядке должен включать УЗИ брюшной полости, КТ и РХПГ с декомпрессией жёлчных путей. В некоторых случаях пока- зана диагностическая лапароскопия (осторожно: пунктировать кисту нельзя из-за опасности диссеминации).
ЛечениеРежим и диета определяются характером осложнений. Химиотерапию проводят в случаях разрыва кист, когда есть опасность обсеме- нения при нарушении целостности кисты во время операции, а также в случаях множественных кист небольших размеров (не более 3–5 см) печени, лёгких и других органов, при которых оперативное вмешательство технически сложно. Противорецидивное лечение рекомендуют после операции, когда нельзя исклю- чить другую локализацию паразита небольших размеров. Противопаразитарное лечение проводят албендазолом внутрь после еды по 10 мг/кг (не более 800 мг в сутки) в два приёма, курс 28 дней, интервалы между курсами не менее 2 нед. Продолжительность лечения клинически выраженных форм инвазии (наличие кист) 12–18 мес. Применение высоких доз албендазола в течение длительного времени само по себе становится причиной развития осложнений, обусловленных токси- ческим действием препарата: отмечают лейкопению, агранулоцитоз, алопецию, лихорадку, токсический гепатит. Один из важных показателей, свидетельствую- щих о нежелательном действии албендазола и угрозе развития серьёзных ослож- нений, — повышение активности аминотрансфераз. При уменьшении количества лейкоцитов ниже 3,0×109/л и повышении активности аминотрансфераз в 5–6 раз необходимо приостановить лечение до нормализации или значительного улуч- шения показателей. При прогрессирующей лейкопении и гиперферментемии необходимо отменить препарат. В процессе химиотерапии в связи с угнетением жизнедеятельности или гибелью паразита возможны нагноение и спонтанные разрывы кист. В этих случаях проводят антибактериальную терапию, по показа- ниям — хирургическое лечение. Показанием к оперативному лечению также считают воздей- ствие объёмного процесса на жизненно важные органы, такие, как кисты лёгких, головного мозга, почек, костей и других органов. При множественном поражении оперативное лечение проводят поэтапно. Противопоказания — труднодоступные, отмирающие, обезыствлённые или множественные мелкие кисты. Учитывают общие хирургические, анестезиологи- ческие и терапевтические противопоказания. Показания к операции у маленьких детей и людей со множественными кистами должны быть очень обоснованными. Обтурационную желтуху при эхинококкозе печени разрешают только оператив- ным путём.
Лямблиоз
Лямблиоз (жиардиаз; английское название — Giardiasis) — протозойная инва- зия, протекающая чаще как бессимптомное носительство, иногда с функциональ- ными расстройствами кишечника.
ЭтиологияВозбудитель — Lamblia intestinalis (Giardia lamblia) — относят к подцарству Protozoa, подтипу Mastigophora, отряду Diplomonadida, семейству Hexamitidae. В цикле развития простейшего выделяют две стадии — вегетативной формы и цисты. Вегетативная форма — трофозоит размером 8–18×5–10 мкм, грушевидной формы. Задний конец сужен и вытянут, передний расширен и закруглён; брюшная сторона плоская, спинная — выпуклая. Для трофозоита характерно билатерально- симметричное строение. Он имеет четыре пары жгутиков, два ядра с кариосомами и так называемый присасывательный диск — углубление, при помощи которого он прикрепляется к поверхности эпителиальной клетки кишечника хозяина. Питается лямблия осмотически всей поверхностью тела, поглощая питательные вещества и различные ферменты непосредственно из щёточной каёмки. Максимальное коли- чество паразитов находится в проксимальном отделе тонкой кишки (начальные 2,5 м), где наиболее высока интенсивность пристеночного пищеварения. Лямблии не паразитируют в желчевыводящих путях, так как концентрированная жёлчь оказывает губительное действие на паразитов. Размножение происходит путём продольного деления трофозоита. Процесс образования цист занимает 12–14 ч. Зрелая циста овальной формы, размером 12–14×6–10 мкм, содержит четыре ядра. Цисты, выделяемые с фекалиями, устойчивы к факторам окружающей среды: в воде при температуре 4–20 °С они остаются жизнеспособными до 3 мес. Как и цисты амёб, устойчивы к хлору.
ЭпидемиологияИсточник заражения — человек, выделяющий с фекалиями зрелые цисты лям- блий. Возможность заражения человека штаммами Giardia lamblia от животных (возбудитель обнаружен у собак, кошек, кроликов и других млекопитающих) в настоящее время не имеет достаточных доказательств. Механизм заражения фекально-оральный. Основной путь передачи водный. Степень загрязнения фека- лиями окружающей среды — решающий фактор в уровне поражённости населения лямблиозом. В детских учреждениях большое значение имеет контактно-бытовой путь заражения. Групповые вспышки обычно обусловлены фекальным загряз- нением воды, реже пищи. Цисты лямблий обнаружены в кишечнике некоторых насекомых (мух, тараканов, мучных хрущаков), которые могут способствовать их распространению. Лямблиоз встречается повсеместно, но наибольшую поражённость населения отмечают в странах с тропическим и субтропическим климатом. В этих странах лямблия — один из наиболее частых возбудителей диареи путешественников. Заболевание регистрируют во всех возрастных группах. Предполагают, что у взрослых в эндемичных очагах развивается определённый защитный иммунитет. В нашей стране большую часть инфицированных (70%) составляют дети дошколь- ного и младшего школьного возраста. На территории центральной части РФ наи- более выражена весенне-летняя сезонность, наименьшее число случаев регистри- руют в ноябре–декабре.
ПрофилактикаМеры профилактики такие же, как при амёбиазе и других инфекциям с фекально-оральным механизмом передачи возбудителя.
ПатогенезРазвитие клинических проявлений зависит от инфицирующей дозы, функцио- нального состояния ЖКТ и иммунного статуса организма. Увеличению количества лямблий способствуют пища, богатая углеводами, резекция желудка в анамнеза и снижение кислотности желудочного сока. Препятствует размножению лямблий белковая диета. Трофозоиты обитают в двенадцатиперстной кишке, прикрепля- ясь с помощью присасывательных дисков к эпителиальным клеткам ворсинок и крипт. Они не проникают в слизистую оболочку кишки, однако присасывательные диски образуют углубления на микроворсинчатой поверхности эпителиальных клеток. Паразиты питаются продуктами пристеночного пищеварения и могут размножаться в кишечнике в огромных количествах. В местах паразитирования лямблий усиливаются митотические процессы и зрелые, функционально полно- ценные клетки замещаются молодыми, незрелыми (частая смена эпителия); в результате нарушается всасывание компонентов пищи. Эти изменения обратимы, после излечения от лямблиоза процесс всасывания нормализуется. Лямблиозу часто сопутствует дисбиоз кишечника, особенно возрастает численность аэробной микрофлоры. Продукты метаболизма лямблий и вещества, образуемые после их гибели, всасываются и вызывают сенсибилизацию организма. Морфологические изменения при лямблиозе характеризуются укорочением сосочков слизистой обо- лочки двенадцатиперстной и тощей кишки, уменьшением глубины крипт. Массивная инвазия лямблиями возникает при иммунодефиците, особенно у детей с первичной гипогаммаглобулинемией, селективным дефицитом IgA. Лямблии способны вырабатывать IgA-протеазы, разрушающие иммуноглобулины этого класса. Возможно, это имеет значение в формировании упорного рецидиви- рующего течения лямблиоза, резистентного к противопаразитарным ЛС.
Клиническая картинаРазличают лямблиоз латентный (без клинических проявлений) и манифест- ный. Подавляющее большинство инфицированных становятся бессимптомными носителями лямблий. Инкубационный период длится от 7 до 28 дней. Клинически манифестные формы развиваются сравнительно редко. Острый период длится обычно несколько дней, после чего лямблиоз чаще переходит в подострую или хроническую стадию с кратковременными обострениями в виде жидкого стула и вздутия кишечника, похудания, повышенной утомляемости. Наиболее частые проявления первичной инфекции — тошнота, анорексия, вздутие кишечника и урчание в животе. Стул учащённый, зловонный, жироподобный, пенистый; возможны рвота, схваткообразные боли в эпигастральной области. Эта форма лямблиоза в гигиенических условиях купируется в течение нескольких дней, хорошо поддаётся химиотерапии, но без специфического лечения может приобретать затяжное течение. У некоторых людей есть предрасположенность к повторному инфицированию и персистирующему лямблиозу. В этих случаях болезнь протекает месяцами и годами с периодическими обострениями в форме гастродуоденита, еюнита, дискинезии жёлчного пузыря. Известны клинические формы с аллергическими проявлениями в виде крапивницы с кожным зудом, приступов бронхиальной астмы с умеренной эозинофилией в крови. У детей нередки невротические симптомы: слабость, быстрая утомляемость, раздражительность, плаксивость, головные боли. В тропических и субтропических странах у больных лямблиозом регистрируют синдром мальабсорбции. Лямблиоз может осложниться дисбиозом кишечника.
ДиагностикаДля лабораторной диагностики исследуют фекалии или дуоденальное содержи- мое. В фекалиях обычно находят цисты лямблий. При диарее или после приёма слабительного в фекалиях можно обнаружить и вегетативные формы. Для выявле- ния трофозоитов исследуют дуоденальное содержимое. В диагностических целях исследуют также мазки-отпечатки слизистой оболочки тонкой кишки, биопсий- ный материал, полученный при эндоскопии. Методом ИФА выявляют антитела к антигенам лямблий. Дифференциальную диагностику проводят с глистными инвазиями и другими диарейными инфекциями. Консультативной помощи, как правило, не требуется. Больных лечат амбулаторно. ЛечениеСпецифическое лечение проводят при обнаружении лямблий и наличии у боль- ного клинических проявлений. Для этих целей используют следующие ЛС. • Метронидазол. Внутрь взрослым назначают по 400 мг три раза в сутки 5 дней или по 250 мг три раза в сутки 7–10 дней; детям 1–3 лет — по 0,5 г в сутки 3 дня, 3–7 лет — по 0,6–0,8 г в сутки 3 дня, 7–10 лет — по 1–1,2 г в сутки 5 дней. • Тинидазол назначают внутрь однократно, взрослым по 2 г (при необходимо- сти можно повторить), детям — по 50–75 мг/кг. • Орнидазол применяют внутрь по 1,5 г один раз в день (вечером) в течение 5–10 дней; детям с массой тела до 35 кг препарат назначают по 40 мг/кг в один приём. • Ниморазол назначают внутрь по 500 мг два раза в сутки в течение 6 дней. • Нифурател принимают внутрь: взрослые по 400 мг 2–3 раза в сутки в течение 7 дней, дети — по 15 мг/кг два раза в сутки 7 дней. • Албендазол. Внутрь взрослым по 400 мг два раза в день 7 дней; детям — 10 мг/ (кг×сут), но не более 400 мг, в течение 7 дней. Показана высокая лямблиоцид- ная эффективность албендазола, который может быть средством выбора при лечении лямблиоза в сочетании с кишечными нематодозами. После курса специфического лечения проводят контрольное исследование фекалий.

Дата добавления: 2018-08-06; просмотров: 263; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
