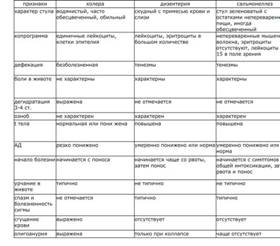
Дифдиагностика сальмонеллеза дизентерии и холеры
Ботулизм
Ботулизм (ихтиизм, аллантиизм; англ. botulism, allantiasis, sausage-poisoning; франц. botulisme, allantiasis; нем. Botulismus Wurst-Vergiftung, Fleischvergtftung) — острая инфекционная болезнь из группы сапрозоонозов с фекально-оральным механизмом передачи, развивающаяся в результате употребления пищевых продуктов, в которых произошло накопление токсина возбудителя, блокирующего передачу нервных импульсов. Выделяют ботулизм пищевой, раневой и грудных детей, когда токсин образуется соответственно в ране и ЖКТ. Пищевой ботулизм
составляет более 99% всех случаев болезни.
Этиология
Возбудитель ботулизма, Clostridium botulinum, грамположительная анаэробная подвижная палочка. В зависимости от антигенных свойств продуцируемого токсина выделяют восемь сероваров — А, В, С1, С2, D, Е, F и G На территории России болезнь вызывают серовары А, В и Е. В процессе жизнедеятельности возбудитель ботулизма продуцирует специфический нейротоксин Данный токсин — наиболее сильный из всех известных токсинов любого происхождения. Ботулотоксин, вырабатываемый разными сероварами возбудителя, обладает единым механизмом действия, различается по антигенным и физическим свойствам, молекулярной массе. Прогревание при температуре 80 °С в течение 30 мин вызывает гибель вегетативных форм возбудителя. Споры в отличие от вегетативной формы чрезвычайно устойчивы к различным физическим и химическим факторам: в частности, выдерживают кипячение в течение 4–5 ч, воздействие высоких концентраций различных дезинфицирующих средств. Они устойчивы к замораживанию и высушиванию, к ультрафиолетовому облучению. Ботулинический токсин в обычных условиях внешней среды сохраняется до 1 года, в консервированных продуктах — годами. Он устойчив в кислой среде, выдерживает высокие концентрации (до 18%) поваренной соли, не разрушается в продуктах, содержащих различные специи. Токсин сравнительно быстро инактивируется под влиянием щелочей, при кипячении полностью теряет свои токсические свойства в течение 10 мин. В ЖКТ токсин снижает свою токсичность, за исключением токсина Е, который, активируясь трипсином, усиливает её в 10 000 раз.
Эпидемиология
Споровые формы возбудителя можно обнаружить в пыли, воде и иле. Практически все пищевые продукты, загрязнённые почвой или содержимым кишечника животных, птиц, рыб, могут содержать споровые формы возбудителей ботулизма. Подавляющее число случаев ботулизма связано с употреблением консервов(грибы, бобы, овощи), рыбы и мяса домашнего приготовления. Если контаминируется твердофазный продукт (колбаса, копчёное мясо, рыба), то в нём возможно «гнёздное» образование токсина, поэтому заболевают не все лица, употреблявшие этот продукт. Значительно реже встречаются случаи заболевания в результате заражения лишь спорами возбудителей Cl. Botulinum: раневой ботулизм и ботулизм новорождённых. Иммунитет при ботулизме типоспецифический антибактериальный, выражен слабо, поэтому возможно повторное заболевание. Ботулизм распространён во всех странах, где практикуется домашнее консервирование.
Меры профилактики
Специфические: подозрительные продукты подлежат изъятию и лабораторному контролю, а употреблявшие их вместе с заболевшими лица — медицинскому наблюдению в течение 10–12 дней, внутримышечное введение им по 2000 ME антитоксических противоботулинических сывороток типов А, В и Е, назначение энтеросорбентов. Прививки проводят полианатоксином трёхкратно с интервалами 45 сут между первой и второй и 60 сут между второй и третьей прививками. Неспецифические: готовь норм, не жри что попало
Патогенез
При алиментарном заражении токсин попадает в организм вместе с пищей, содержащей также и вегетативные формы возбудителя. Н-цепь токсина связывается с синаптической мембраной нервно-мышечных холинергических синапсов, иннервирующих поперечно-полосатые мышцы, т.е. α-мотонейронами передних рогов спинного мозга и двигательных ядер черепных нервов, а также гладкую мускулатуру, которая иннервируется блуждающим нервом. Токсин, обладая протеазной активностью, расщепляет специфические синаптические белки: SNAP-25 (расщепляется токсинами сероваров А и Е) и синаптобревин (расщепляется токсином серовара В), что нарушает слияние синаптических пузырьков и синаптической мембраны, т.е. блокирует прохождение нервного импульса при нормальной продукции ацетилхолина и холинэстеразы. Блокада передачи импульсов приводит к миастении и паралитическому синдрому. Поражаются в первую очередь мышцы с высокой функциональной активностью: глазодвигательные, глотки и гортани, дыхательные. Действие токсина потенцируется аминогликозидами, антиполяризующими миорелаксантами, ионизирующей радиацией и повторным поступлением в организм новых доз токсина. Блокада мускулатуры, иннервируемой блуждающим нервом, вызывает парез кишечника, уменьшает продукцию слюны, желудочного сока. Дополнительными факторами патогенеза служат вентиляционная гипоксия, аспирация секрета ротоглотки, вторичная бактериальная инфекция.
Клиническая картина
Инкубационный период длится до суток, реже до 2–3 дней, в единичных случаях до 9–12 дней. При более коротком инкубационном периоде наблюдают, хотя и не всегда, более тяжёлое течение болезни.
Классификация
В клинической картине выделяют лёгкие, среднетяжёлые и тяжёлые формы болезни.
При лёгком течении у пациентов паралитический синдром ограничивается поражением глазодвигательных мышц; при среднетяжёлом распространяется на глоссофарингеальную мускулатуру.
Тяжёлое течение характеризуется ДН и тяжёлыми бульбарными нарушениями.
Начало болезни острое. Выделяют два варианта начала: первый — с картины гастроэнтерита с последующим, в течение нескольких часов, присоединением неврологической симптоматики и второй — вариант, при котором диспепсический синдром отсутствует и на первый план с самого начала выступает поражение ЦНС. В первом случае болезнь начинается со схваткообразных болей в эпигастрии, со рвоты, с диареи, повышения температуры тела. Эти явления длятся от нескольких часов до суток, затем выявляются симптомы поражения нервной системы. Диспепсичесий синдром связывают с сопутствующей анаэробной флорой (Cl. perfringens) и другими возбудителями ПТИ. Второй вариант начинается с резко выраженной миастении, головокружения, головной боли, лихорадки. Боли не характерны. Почти одновременно нарушается зрение вследствие пареза цилиарной мышцы. Одновременно: косоглазие, диплопия, нарушение конвергенции, мидриаз, анизокория, птоз. В тяжёлых случаях возможна офтальмоплегия: глазные яблоки неподвижны, зрачки широкие, не реагируют на свет. Через несколько часов появляются парезы глоточно-язычных мышц (IX, X, XII пары черепных нервов) с развитием афонии и дисфагии. Реже наблюдается двусторонний парез лицевого нерва. Несколько позже (а в наиболее тяжёлых случаях одновременно) появляется парез диафрагмы и вспомогательных дыхательных мышц. Затем появляется разорванность речи, чувство нехватки воздуха, цианоз губ, тахипноэ, поверхностное дыхание. Синдром поражения парасимпатической нервной: характеризуется сухостью кожных покровов, слизистых оболо-чек, сниженным слюноотделением, что выражается в соответствующих жалобах больных. Помимо этого, с поражением вегетативной нервной системы связано нарушение иннервации ЖКТ, вплоть до развития паралитической кишечной непроходимости и реже нарушений уродинамики в виде острой задержки мочи или непроизвольного постоянного мочевыделения. Для ботулизма, протекающего без осложнений, характерны ясность сознания, отсутствие менингеальных симптомов, лихорадочно-интоксикационного синдрома. Выздоровление наступает медленно — при тяжёлых формах обычно не ранее чем со второй недели болезни.
Диагностика
Диагноз ботулизма устанавливают на основании эпидемиологических данных (употребление консервов домашнего приготовления, групповые заболевания) и на всестороннем анализе клинической картины заболевания: характерная локализация и симметричность поражений нервной системы, отсутствие лихорадочно- интоксикационного, общемозгового и менингеального синдромов. Обнаружение ботулинического токсина в крови служит абсолютным подтверждением диагноза. Используют РН ботулотоксинов антитоксическими сыворотками путём биопробы на белых мышах. Для этого необходимо до введения лечебной антитоксической противоботулинической сыворотки взять у больного 15–30 мл венозной крови. Исследование позволяет уже в течение 8 ч определить наличие в ней ботулинического токсина и его тип. Аналогичные исследования проводят с промывными водами желудка или рвотными массами, испражнениями больного, остатками подозрительного продукта. Для выделения возбудителя ботулизма производят посевы содержимого желудка, испражнений, подозрительных продуктов на специальные питательные среды (Китта–Тароцци, казеиново-грибную, бульон Хоттингера и др.).
Лечение
Режим постельный или полупостельный. Диета: стол № 10, зондовое или парентеральное питание в зависимости от состояния больного. Методика — инфузия в течение 16 ч. Предпочтительны питательные смеси с высокой энергетической плотностью (например, «Isocal HCN», «Osmolite HN»), при ДН — «Pulmocare». Объём белка в сутки определяют из расчёта 25 ккал/кг массы тела и 1,5 г/кг массы тела. При застойном отделяемом из желудка переходят на парентеральное питание с обязательным частичным энтеральным питанием из расчёта 2000–2500 ккал в сутки на взрослого больного. Парентеральное питание осуществляют концентрированными растворами глюкозы (10–40%), смесями аминокислот и жировыми эмульсиями. Медикаментозная терапияБольным вводят антитоксическую противоботулиническую сыворотку. Используют гетерологичные (лошадиные) антитоксические моновалентные сыворотки. При неизвестном типе токсина вводят смесь моновалентных сывороток или поливалентную сыворотку (10 тыс. МЕ анатоксина типов А и Е и 5 тыс. МЕ анатоксина типа Е). Независимо от тяжести течения внутривенно вводят одну лечебную дозу сыворотки, разведённую в 200 мл подогретого изотонического раствора натрия хлорида. Сыворотку вводят однократно. Перед введением сыворотки проводят пробу по Безредке с сывороткой, разведённой в 100 раз. Наличие аллергической реакции при постановке пробы служит относительным противопоказанием к введению лечебной дозы сыворотки. В этих случаях предварительную дозу преднизолона увеличивают до 240 мг. Перспективное средство специфической антитоксической терапии — человеческий противоботулинический иммуноглобулин. При тяжёлом течении ботулизма лечение прежде всего направлено на замещение или активацию временно утраченных функций организма. G Назначают препараты, уменьшающие кислотность желудочного сока: ранитидин, фамотидин, блокаторы протонного насоса (омепразол, эзомепразол, рабепразол). G Препараты, улучшающие моторную функцию ЖКТ (домперидон, метоклопрамид). G Нормализация кислотно-щелочного равновесия, уровня гемоглобина, объёма циркулирующей крови, сердечного выброса, температуры тела, электро- литного состава плазмы. Всем больным, чтобы подавить жизнедеятельность возбудителей ботулизма в ЖКТ и предупредить возможное образование токсина, назначают хлорамфеникол по 0,5 г четыре раза в сутки в течение 5 дней. Вместо хлорамфеникола можно применять ампициллин по 0,5–1 г четыре раза в сутки внутрь. В случаях раневого ботулизма проводят соответствующую хирургическую обработку раны, применяют повышенные дозы (до 12–16 млн ЕД/сут) пенициллина или других антибиотиков. Больных выписывают после клинического выздоровления.
Пищевые токсикоинфекции
ПТИ (пищевые бактериальные отравления; лат. toxicoinfectiones alimentariaе) —полиэтиологическая группа острых кишечных инфекций, возникающих после употребления в пищу продуктов, контаминированных условно патогенными бактериями, в которых произошло накопление микробной массы возбудителей и их токсинов. ЭтиологияПТИ объединяют большое количество этиологически различных, но патогенетически и клинически сходных болезней. Объединение ПТИ в отдельную нозологическую форму вызвано необходимостью унифицировать меры по борьбе с их распространением и эффективностью синдромального подхода к лечению. Наиболее часто регистрируют ПТИ, вызываемые следующими условно-патогенными микроорганизмами:семейство Enterobacteriaceae род Сitrobacter, Klebsiella, Enterobacter, Hafnia,Serratia, Proteus, Edwardsiella, Erwinia;семейство Micrococcaceae род Staphilococcus;семейство Bacillaceae род Clostridium, род Bacillus (в том числе вид B.сereus);·семейство Pseudomonaceae род Pseudomonas (в том числе вид Aeruginosa);·семейство Vibrionaceae род Vibrio, вид НАГ-вибрионы (неагглютинирующиевибрионы), V. parahaemoliticus.Большинство вышеперечисленных бактерий обитает в кишечнике практически здоровых людей и многих представителей животного мира. Возбудители устойчивы к действию физических и химических факторов окружающей среды; способны к размножению как в условиях живого организма, так и вне его, например в пищевых продуктах (в широком диапазоне температур).
ЭпидемиологияИсточниками возбудителей могут быть люди и животные (больные, носители), а также объекты окружающей среды (почва, вода), их относят к группе антропонозов (стафилококкоз, энтерококкоз) и сапронозов — водных и почвенных ( клостридиозы,псевдомоноз, клебсиеллёз,).Механизм передачи возбудителя — фекально-оральный; путь передачи —пищевой. Протей и клостридии способны к активному размножению в белковых продуктах (холодце, заливных блюдах), B. сereus — в овощных супах, мясных и рыбных изделиях. В молоке, картофельном пюре- энтерококков. Галофильные и парагемолитические вибрионы, выживающие в морском осадке, инфицируют многих морских рыб и моллюсков. Стафилококк попадает в кондитерские изделия, молочные продукты, мясные, овощные и рыбные блюда. Зоонозный источник стафилококка — животные, больные маститом. ПТИ — это болезни «грязной пищи».
ПатогенезДля возникновения болезни имеет значение:инфицирующая доза — не менее 105–106 микробных тел в 1 г субстрата;·вирулентность и токсигенность штаммов микроорганизмов. Основное значение имеет интоксикация бактериальными экзо- и эндотоксинами возбудителей, содержащимися в продукте. При разрушении бактерий в пищевых продуктах и ЖКТ происходит высвобождение эндотоксина, который, стимулируя продукцию цитокинов, активирует гипоталамический центр, способствует возникновению лихорадки, нарушению сосудистого тонуса, изменениям в системе микроциркуляции. Комплексное воздействие микроорганизмов и их токсинов приводит к возникновению местных (гастрит, гастроэнтерит) и общих (лихорадка, рвота и др.) признаков болезни. Имеет значение возбуждение хеморецепторной зоны и рвотного центра, расположенных в нижней части дна IV желудочка, импульсами с блуждающего и симпатического нервов. При продолжительной рвоте возможно развитие гипохлоремического алкалоза. Энтерит вызывают энтеротоксины, выделяемые следующими бактериями:Proteus, B. cereus, Klebsiella, Enterobacter, Aeromonas, Edwardsiella, Vibrio. Повышения активности аденилатциклазы происходит усиление синтеза цАМФ, усиливается выход изотонической, бедной белком жидкости в просвет тонкой кишки. Возникает профузная диарея, ведущая к нарушениям водно-электролитного баланса, изотонической дегидратации. В тяжёлых случаяхвозможно развитие дегидратационного (гиповолемического) шока. Колитический синдром появляется обычно при микст-инфекциях с участиемпатогенной флоры.В патогенезе стафилококковых пищевых отравлений имеет значение действиеэнтеротоксинов A, B, C1, C2, D и E.
Клиническая картинаИнкубационный период — от 2 ч до 1 сут; при ПТИ стафилококковой этиологии — до 30 мин. Острый период болезни — от 12 ч до 5 сут, после чего наступает период реконвалесценции. В клинической картине на первый план выступают общая интоксикация, обезвоживание и гастроинтестинальный синдром. Классификация ПТИ (Зубик Т.М., 2001)• По распространённости поражения: G гастритический вариант; G гастроэнтеритический вариант; G гастроэнтероколитический вариант. • По тяжести течения: G лёгкое; G среднетяжёлое; G тяжёлое.• По осложнениям: G неосложнённая; G осложнённая ПТИ.
Первые симптомы ПТИ — боль в животе, тошнота, рвота, озноб, повышение температуры тела, жидкий стул. О развитии острого гастрита свидетельствуют обложенный белым налётом язык; рвота (иногда неукротимая) съеденной накануне пищей, затем — слизью с примесью жёлчи; тяжесть и боль в эпигастральной области. Боль в животеможет носить разлитой характер, быть схваткообразной, реже — постоянной. О развитии энтерита свидетельствует диарея, возникающая у 95% больных. Испражнения обильные, водянистые, зловонные, светло-жёлтого или коричневого цвета; имеют вид болотной тины. Живот при пальпации мягкий, болезненный не только в эпигастральной области, но и в области пупка. Частота актов дефекации отражает тяжесть течения болезни. Признаки колита: мучительную схваткообразную боль в нижних отделах живота (чаще слева), примесь слизи, крови в испражнениях — обнаруживают у 5–6%больных. При гастроэнтероколитическом варианте наблюдают последовательное вовлечение в патологический процесс желудка, тонкой и толстой кишки. Лихорадка выражена у 60–70% больных. Она может быть субфебрильной; у части больных достигает 38–39 °С, иногда — 40 °С. Продолжительность лихорадки —от нескольких часов до 2–4 дней. Иногда (при стафилококковой интоксикации) наблюдают гипотермию. Изменения почек: возможно развитие преренальной ОПН с олигоанурией, азотемией, гиперкалиемией и метаболическим ацидозом. Стафилококковое пищевое отравление вызывают энтеротоксигенные штаммы патогенных стафилококков. Они устойчивы к воздействию факторовокружающей среды, переносят высокие концентрации соли и сахара, но погибаютпри нагревании до 80 °С. Энтеротоксины стафилококка выдерживают прогреваниедо 100 °С в течение 1–2 ч. По внешнему виду, вкусу и запаху продукты, контаминированные стафилококком, неотличимы от доброкачественных. Энтеротоксин влияет на парасимпатическую нервную систему, способствует значительному снижению АД, активирует моторику желудка и кишечника. Начало заболевания острое, бурное. Инкубационный период — от 30 мин до 4–6 ч.Интоксикация резко выражена, температура тела обычно повышена до 38–39 °С,но может быть нормальной или пониженной. Характерна интенсивная боль в животе, локализующаяся в эпигастральной области. Отмечают также слабость,головокружение, тошноту. У 50% больных наблюдают многократную рвоту (втечение 1–2 сут), диарею (на протяжении 1–3 сут). При тяжёлом течении возникает острейший гастроэнтерит (острый гастроэнтероколит). Характерны тахикардия, глухость тонов сердца, артериальная гипотензия, олигурия. У подавляющего большинства больных заболевание заканчивается выздоровлением, но возраста возможно развитие псевдомембранозного колита и стафилококкового сепсиса. Наиболее тяжёлоеосложнение — ИТШ. Пищевое отравление Клостридиоз протекает в виде острого гастроэнтероколита с признакамиинтоксикации и обезвоживания. Инкубационный период 2–24 ч. Заболевание начинается с интенсивных, колющих болей в животе. При лёгком и среднетяжёломтечении отмечают повышение температуры тела, многократную рвоту, жидкийстул (до 10–15 раз) с примесью слизи и крови, болезненность живота при пальпации. Продолжительность заболевания 2–5 сут. Возможны следующие варианты тяжёлого течения:·острейший гастроэнтероколит: выраженные признаки интоксикации; желтушность кожного покрова; рвота, диарея (более 20 раз в сутки), примесьслизи и крови в испражнениях; резкая болезненность живота при пальпации, увеличение печени и селезёнки; уменьшение количества эритроцитов исодержания гемоглобина, увеличение концентрации свободного билирубина; холероподобное течение — острейший гастроэнтероколит в сочетании с обезвоживаниемI–III степени;·развитие некротических процессов в тонкой кишке, перитонита на фоне острого гастроэнтероколита с характерным стулом типа мясных помоев. Цереоз у большинства больных протекает легко. В клинической картине преобладают симптомы гастроэнтерита. Клебсиеллёзу свойственно острое начало с повышением температуры тела (втечение 3 сут) и признаками интоксикации. В клинической картине доминируетострый гастроэнтероколит, реже — колит. Продолжительность диареи — до 3 сут.Преобладает среднетяжёлое течение болезни. Протеоз в большинстве случаев протекает лёгко. Инкубационный период —от 3 ч до 2 сут. Основные симптомы — слабость, интенсивная, нестерпимая больв животе, резкая болезненность и громкое урчание, зловонные испражнения. Возможны холероподобный и шигеллёзоподобный варианты течения болезни, ведущие к развитию ИТШ. Стрептококковой ПТИ свойственно лёгкое течение. Основные симптомы —диарея, боли в животе. Малоизученная группа ПТИ — аэромоноз, псевдомоноз, цитробактериоз. Основной симптом — гастроэнтерит различной степени тяжести.

Лечение

Эшерихиозы
Эшерихиозы (син. Escherichioses, коли-инфекция, коли-энтерит, диарея путеше- ственников) — группа бактериальных антропонозных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечной палочки, протекающих с симптомами общей интоксикации и поражением ЖКТ
ЭтиологияЭшерихии — подвижные грамотрицательные палочки, аэробы, относящиеся к виду Еscherichia coli, роду Escherichia, семейству Enterobacteriaceae. Растут на обычных питательных средах, выделяют бактерицидные вещества-колицины
. Эшерихии содержат соматические (О-Аг — 173 серотипа), капсульные (К-Аг — 80 серотипов) и жгутиковые (Н-Аг — 56 серотипов) антигены. Диареегенные кишечные палочки подразделяются на пять типов: ·энтеротоксигенные (ЭТКП, ETEC); ·энтеропатогенные (ЭПКП, EPEC); ·энтероинвазивные (ЭИКП, EIEC); ·энтерогеморрагические (ЭГКП, EHEC); ·энтероадгезивные (ЭАКП, EAEC)
Факторы патогенности ЭТКП (пили, или фимбриальные факторы) определяют склонность к адгезии и колонизации нижних отделов тонкой кишки, а также к токсинообразованию. Термолабильный и термостабильный энтеротоксины ответственны за повышенную экскрецию жидкости в просвет кишки. Патогенность ЭПКП обусловлена способностью к адгезии. ЭИКП способны, имея плазмиды, проникать в клетки кишечного эпителия и размножаться в них; ЭГКП выделяют цитотоксин, шигоподобные токсины 1-го и 2-го типов, содержат плазмиды, которые облегчают адгезию к энтероцитам. Сохраняют жизнеспособность в молоке до 34 дней, в детских питательных смесях — до 92 дней, на игрушках — до 3–5 мес. Хорошо переносят высушивание. Обладают способностью размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при воздействии дезинфицирующих средств и при кипячении. У многих штаммов Е. cоli отмечают полирезистентность к антибиотикам
ЭпидемиологияОсновной источник эшерихиозов — больные со стёртыми формами заболевания, меньшую роль играют реконвалесценты и носители. По некоторым данным, источник возбудителя при энтеро- геморрагических эшерихиозах (О157) — крупный рогатый скот. Механизм передачи — фекально-оральный, который осуществляется пищевым, реже — водным и бытовым путём. По данным ВОЗ, для энтеротоксигенных и энтероинвазивных эшерихий характерен пищевой, а для энтеропатогенных — бытовой путь
Из пищевых продуктов чаще фактором передачи служат молочные изделия, готовые мясные продукты, напитки (квас, компот и др.)
ПатогенезЭшерихии проникают через рот, минуя желудочный барьер, и в зависимости от типовой принадлежности оказывают патогенное действие:
Энтеротоксигенные штаммы способны вырабатывать энтеротоксины и фактор колонизации, посредством которого осуществляются прикрепление к энтероцитам и колонизация тонкой кишки
Энтеротоксины — термолабильные или термостабильные белки, которые воздействуют на биохимические функции эпителия крипт, не вызывая видимых морфологических изменений. Энтеротоксины усиливают активность аденилат- циклазы и гуанилатциклазы. При их участии и в результате стимулирующего действия простагландинов увеличивается образование цАМФ, вследствие чего в про- свет кишки секретируется большое количество воды и электролитов, которые не успевают реабсорбироваться в толстой кишке, — развивается водянистая диарея с последующими нарушениями водно-электролитного баланса. Инфицирующая доза ЭТКП — 10×1010 микробных клеток
ЭИКП обладают свойством внедряться в клетки эпителия толстой кишки: Проникая в слизистую оболочку, они вызывают развитие воспалительной реакции и образование эрозий кишечной стенки. Из-за повреждения эпителия усиливается всасывание в кровь эндотоксинов. У больных в испражнениях появляются слизь, кровь и полиморфно-ядерные лейкоциты. Инфицирующая доза ЭИКП — 5×105 микробных клеток
Механизм патогенности ЭПКП изучен недостаточно. У штаммов (055, 086, 0 и др.) выявлен фактор адгезии к клеткам Нер-2, за счёт которого происходит колонизация тонкого кишечника. У других штаммов (018, 044, 0112 и др.) этот фактор не обнаружен. Инфицирующая доза ЭПКП — 10×1010 микробных клеток
ЭГКП выделяют цитотоксин (SLT — shiga-like toxin), который разрушает клетки эндотелия, выстилающего мелкие кровеносные сосуды кишечной стенки проксимальных отделов толстой кишки. Сгустки крови и фибрин препятствуют кровоснабжению кишки — в кале появляется кровь. Развивается ишемия кишечной стенки, вплоть до некроза. У некоторых больных наблюдают осложнения с ДВС, ИТШ и ОПН
ЭАКП способны к колонизации эпителия тонкой кишки. Вызванные ими заболевания взрослых и детей протекают длительно, но легко. Это связано с тем, что бактерии прочно закрепляются на поверхности эпителиальных клеток
Клиническая картина
Клинические проявления эшерихиозов зависят от типа возбудителя, возраста больного, иммунного статуса
Клиническая классификация эшерихиозов (Ющук Н.Д., Венгеров Ю.Я., 1999) • По этиологическим признакам: G энтеротоксигенные; G энтероинвазивные; G энтеропатогенные; G энтерогеморрагические; G энтероадгезивные
• По форме заболевания: G гастроэнтеритическая; G энтероколитическая; G гастроэнтероколитическая; G генерализованная (коли-сепсис, менингит, пиелонефрит, холецистит)
• По тяжести течения: G лёгкое; G средней тяжести; G тяжёлое
При эшерихиозе, вызванном энтеротоксигенными штаммами, инкубационный период — 16–72 ч, для него характерно холероподобное течение болезни, протекающее с поражением тонкой кишки без выраженного синдрома интоксикации («диарея путешественников»)
Заболевание начинается остро, больных беспокоят слабость, головокружение, Температура тела нормальная или субфебрильная. Появляются тошнота, повторная рвота, разлитые схваткообразные боли в животе. Стул частый (до 10–15 раз в сутки), жидкий, обильный, водянистый, нередко напоминающий рисовый отвар
Живот вздут, при пальпации определяют урчание, небольшую разлитую болезненность. Тяжесть течения определяется степенью дегидратации. Возможна молние- носная форма заболевания с быстрым развитием эксикоза. Длительность болезни 5–10 дней
Энтероинвазивные эшерихии вызывают дизентериеподобное заболевание, которое протекает с симптомами общей интоксикации и преимущественным поражением толстой кишки. Инкубационный период — 6–48 ч. Начало острое, с повышения температуры тела до 38–39 °С, озноба, слабости, головной боли, боли в мышцах, ухудшение аппетита. У части больных температура тела нормальная или субфебрильная. Через несколько часов присоединяются схваткообразные боли, преимущественно в нижней части живота, ложные позывы на дефекацию, тенезмы, жидкий стул, обычно калового характера, до 10 и более раз в сутки с примесью слизи и крови. При более тяжёлом течении заболевания стул в виде «ректального плевка». Сигма спазмированна, уплотнена и болезненна. При ректороманоскопии — катаральный, реже — катарально-геморрагический или катарально-эрозивный проктосигмоидит. Течение болезни доброкачественное Лихорадка длится 1–2, реже 3–4 дня, болезнь — 5–7 дней. Через 1–2 дня стул нормализуется. Спазм и болезненность толстой кишки сохраняются 5–7 дней Восстановление слизистой оболочки толстой кишки наступает к 7–10-му дню болезни
Энтеропатогенный эшерихиоз, вызываемый Е. cоli 2-го класса, регистрируют у взрослых и детей. Инкубационный период — 1–5 дней. Характерны острое начало заболевания (температура тела 38–38,5 °С, озноб, нечастая рвота, боли в животе, стул без патологических примесей, жидкий, до 5–8 раз в сутки), течение доброкачественное. У некоторых больных отмечают гипотонию, тахикардию
При эшерихиозе, вызванном энтерогеморрагическимиштаммами, заболевание проявляется синдромом общей интоксикации и поражением проксимального отдела толстой кишки. Инкубационный период 1–7 дней. Заболевание начинается остро: с болей в животе, тошноты, рвоты. Температура тела субфебрильная или нормальная, стул жидкий, до 4–5 раз в день, без примеси крови. Состояние больных ухудшается на 2–4-й день болезни, когда стул учащается, появляются примесь крови, тенезмы. При эндоскопическом исследовании выявляют катарально-геморрагический или фибринозно-язвенный колит. Более выраженные патоморфологические изменения обнаруживают в слепой кишке. Наиболее тяжело протекает заболевание, вызванное штаммом 0157:Н7. У 3–5% больных через 6–8 дней от начала заболевания развивается гемолитико-уремический синдром (синдром Гассера), который проявляется гемолитической анемией, тромбоцитопенией, прогрессирующей ОПН и токсической энцефалопатией (судороги, парезы, сопор, кома). Летальность в этих случаях может составлять 3–7%
Особенности эшерихиоза, вызванного энтероадгезивнымиштаммами, изучены мало. Заболевание регистрируют у пациентов с ослабленной иммунной системой Чаще выявляют внекишечные формы — поражение мочевыводящих (пиелонеф- рит, цистит) и желчевыводящих (холецистит, холангит) путей. Возможны септические формы (коли-сепсис, менингит)
Диагностикадиагноз подтверждают на основании бактериологического метода исследования. Материал (испражнения, рвотные массы, промывные воды желудка, кровь, моча, ликвор, жёлчь) следует брать в первые дни болезни до назначения больным этиотропной терапии. Посевы производят на среды Эндо, Левина, Плоскирева, а также на среду обогащения Мюллера
Используют иммунологические методы исследования РА, РНГА в парных сыворотках, но они не убедительны, так как возможны ложноположительные результаты из-за антигенного сходства с другими энтеробактериями. Эти методы используют для ретроспективной диагностики, особенно во время вспышки Перспективным методом диагностики служит ПЦР. Инструментальные методы исследования (ректороманоскопия, колоноскопия) при эшерихиозах малоинформативны. Диагноз эшерихиоза правомерен лишь при бактериологическом подтверждении
Лечение
В остром периоде болезни больным рекомендуют щадящую терапию (стол № 4, при нормализации стула — № 2, в период реконвалесценции — № 13)
В лёгких случаях заболевания достаточно назначения оральной регидратацион- ной терапии (регидрон♠ и другие растворы, количество которых должно в 1,5 раза превышать потери воды с испражнениями)
Показаны ферменты (панзинорм-форте♠, мезим-форте♠), энтеросорбенты (полисорб♠, энтеросгель♠, энтеродез♠ в течение 1–3 дней). При лёгком течении болезни целесообразно использование кишечных антисептиков (интетрикс по две капсулы три раза в день, неоинтестопан после каждого акта дефекации по две таблетки, до 14 в сутки, энтерол по две капсулы два раза в день) в течение 5–7 дней. Лёгкие и стёртые формы эшерихиозов не требуют назначения этиотроп- ных препаратов
При лечении больных в условиях стационара показан постельный режим в первые 2–3 дня. Назначают этиотропную терапию. С этой целью при среднетяжё- лых формах используют один из следующих препаратов: ко-тримоксазол по две таблетки два раза в день или препараты фторхинолонового ряда (ципрофлоксацин по 500 мг два раза в сутки перорально, пефлоксацин по 400 мг два раза в сутки, офлоксацин по 200 мг два раза в сутки), длительность терапии 5–7 дней
В тяжёлых случаях фторхинолоны применяют вместе с цефалоспоринами 2-го (цефуроксим по 750 мг четыре раза в сутки внутривенно или внутримышечно; цефаклор по 750 мг три раза в сутки внутримышечно; цефтриаксон 1,0 г один раз в сутки внутривенно) и 3-го поколения (цефоперазон по 1,0 г два раза в сутки вну- тривенно или внутримышечно; цефтазидим по 2,0 г два раза в сутки внутривенно или внутримышечно)
При дегидратации II–III степени назначают регидратационную терапию вну- тривенно кристаллоидными растворами (хлосоль♠, ацесоль♠ и пр.), которую про- водят по общим правилам
При выраженных симптомах интоксикации используют коллоидные растворы (декстран и др.) в объёме 400–800 мл/сут
После приёма антибактериальных препаратов при продолжающейся диарее используют эубиотики для коррекции дисбактериозов (бифидумбактерин- форте♠, хилак-форте♠ и др.) в течение 7–10 дней. Больных выписывают после полного клинического выздоровления, нормализации стула и температуры тела, а также однократного бактериологического исследования кала, которое проводят не ранее чем через 2 дня после окончания лечения
Ротавирусная инфекция
Ротавирусная инфекция (ротавирусный гастроэнтерит) — острая инфекцион- ная болезнь, вызываемая ротавирусами, характеризующаяся симптомами общей интоксикации и поражением ЖКТ с развитием гастроэнтерита
ЭтиологияВозбудитель — представитель семейства Reoviridae, рода Rotavirus. Под электронным микроскопом вирусные частицы выглядят как колёса с широкой ступицей, короткими спицами и чётко очерченным тонким ободом. Вирион ротавируса диаметром 65–75 нм состоит из электронноплотного центра (сердцевины) и двух пептидных оболочек: наружного и внутреннего капсида. Сердцевина диаметром 38–40 нм содержит внутренние белки и генетический материал, представленный двухцепочечной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, чем, вероятно, и обусловлено антигенное разнообразие ротавирусов. Репликация ротавирусов в организме человека происходит исключительно в эпителиальных клетках тонкой кишки
В составе ротавирусов обнаружено четыре основных антигена; главный из них — групповой антиген — белок внутреннего капсида. С учётом всех группоспецифических антигенов ротавирусы делят на семь групп: A, B, C, D, E, F, G. Большинство ротавирусов человека и животных относят к группе A, внутри которой выделяют подгруппы (I и II) и серотипы. Подгруппа II включает до 70–80% штаммов, выделяемых от больных. Ротавирусы устойчивы к воздействию факторов окружающей среды: в питьевой воде, открытых водоёмах и сточных водах они сохраняются до нескольких месяцев, на овощах — 25–30 дней, на хлопке, шерсти — до 15–45 дней. Ротавирусы не разрушаются при многократном замораживании, под действием дезинфицирующих растворов, эфира, хлороформа, ультразвука, но погибают при кипячении, обработке растворами с рН больше 10 либо меньше 2. Оптимальные условия существования вирусов: температура 4 °С и высокая (>90%) или низкая (<13%) влажность. Инфекционная активность возрастает при добавлении протеолитических ферментов (например, трипсина, панкреатина)
Эпидемиология
Основной источник и резервуар ротавирусной инфекции — больной человек,выделяющий с фекалиями значительное количество вирусных частиц (до 1010 КОЕв 1 г) в конце инкубационного периода и в первые дни болезни. После 4–5-го дня болезни количество вируса в испражнениях значительно снижается, однако общая продолжительность выделения ротавируса составляет 2–3 недели. Источником возбудителя инфекции могут быть также здоровые вирусоносители (дети из организованных коллективов и стационаров, взрослые: прежде всего, медицинский персонал родильных домов, соматических и инфекционных отделений), из фекалий которых ротавирус можно выделить на протяжении несколькихмесяцев
Механизм передачи возбудителя — фекально-оральный. Пути передачи: контактно-бытовой;); алиментарный (чаще всего при употреблении молока, молочных продуктов). Не исключена возможность воздушно-капельного пути передачи ротавирусной инфекции
После перенесённой инфекции в большинстве случаев формируется непродолжительный типоспецифический иммунитет. Возможны повторные заболевания, особенно в старших возрастных группах
Для специфической профилактики ротавирусной инфекции у человека предлагают использование нескольких вакцин, вакцина Rotarix (компания GlaxoSmithKline), основанная на человеческом типе вируса, и вакцина на базе человеческого и коровьего штаммов ротавирусов, созданная в лаборатории компании Merck & Co
ПатогенезПатогенез ротавирусной инфекции сложен. С одной стороны, большое значение в развитии ротавирусного гастроэнтерита придают структурным (VP3, VP4, VP6,VP7) и неструктурным (NSP1, NSP2, NSP3, NSP4, NSP5) белкам вируса. В част- ности, NSP4-пептид — энтеротоксин, вызывающий секреторную диарею, подобно бактериальным токсинам; NSP3 влияет на репликацию вируса, а NSP1 может «запрещать» выработку интерферон-регулирующего фактора 3
С другой стороны, уже в первые сутки заболевания ротавирус обнаруживают в эпителии слизистой оболочки двенадцатиперстной кишки и верхних отделах тощей кишки, где происходит его размножение и накопление. Проникновение ротавируса в клетку — многоэтапный процесс. Для внедрения в клетку некоторые серотипы ротавируса нуждаются в специфических рецепторах, содержащих сиало- вую кислоту. Установлена важная роль белков: α2β1-интегрина, интегрина-αVβ3 и hsc70 на начальных этапах взаимодействия вируса и клетки, при этом весь процесс контролируется вирусным белком VP4. Проникнув внутрь клетки, ротавирусы вызывают гибель зрелых эпителиоцитов тонкой кишки и отторжение их от вор- синок. Клетки, замещающие ворсинчатый эпителий, функционально неполно- ценны и не способны адекватно абсорбировать углеводы и простые сахара
Возникновение дисахаридазной (главным образом, лактазной) недостаточности ведёт к накоплению в кишечнике нерасщеплённых дисахаридов с высокой осмо- тической активностью, что вызывает нарушение реабсорбции воды, электролитов и развитие водянистой диареи, нередко приводящей к дегидратации. Поступая в толстую кишку, эти вещества становятся субстратами для ферментации кишечной микрофлорой с образованием большого количества органических кислот, угле- кислого газа, метана и воды.
Клиническая картинаИнкубационный период составляет от 14–16 ч до 7 дней (в среднем — 1–4 дня).Различают типичную и атипичную ротавирусную инфекцию. Типичную рота- вирусную инфекцию, в зависимости от степени тяжести ведущих синдромов, под- разделяют на лёгкую, среднетяжёлую и тяжёлую формы. К атипичным относят стёртую (клинические проявления выражены слабо и кратковременны) и бессим- птомную формы (полное отсутствие клинических проявлений, но лабораторно обнаруживают ротавирус и специфический иммунный ответ). Диагноз вирусоно- сительства устанавливают при обнаружении ротавируса у здорового человека, не имевшего при обследовании изменений специфического иммунитета в динамике
Заболевание чаще всего начинается остро, с повышения температуры тела, появления симптомов интоксикации, диареи и повторной рвоты, DFV-синдром (диарея, лихорадка, рвота). Указанные симптомы отмечают у 90% пациентов; они возникают почти одновременно в первый день болезни, достигая максимальной выраженности в течение 12–24 ч. В 10% случаев рвота и диарея появляются на 2–3-й день болезни
Рвота — не только один из первых, но нередко и ведущий признак ротавирусной инфекции. Обычно она предшествует диарее или появляется одновременно с ней, может быть повторной (до 2–6 раз) или многократной (до 10–12 раз и более), про- должается в течение 1–3 дней
Повышение температуры тела умеренное: от субфебрильных до фебрильных значений. Длительность лихорадки колеблется в пределах 2–4 дней, нередко лихорадка сопровождается симптомами интоксикации (вялость, слабость, сниже- ние аппетита, вплоть до анорексии)
Кишечная дисфункция протекает преимущественно по типу гастроэнтерита или энтерита, характеризуясь жидким, водянистым, пенистым стулом жёлтого цвета без патологических примесей. Кратность дефекаций чаще соответствует тяжести болезни. При обильном жидком стуле может развиться обезвоживание, обычно I–II степени.
С самого начала заболевания могут наблюдаться боли в животе. Чаще они умеренные, постоянные, локализованы в верхней половине живота; в отдельных случаях — схваткообразные, сильные. При пальпации живота отмечают болезнен- ность в эпигастральной и пупочной областях, грубое урчание в правой подвздош- ной области. Печень и селезёнка не увеличены. Признаки поражения органов пищеварения сохраняются в течение 3–6 дней
У части больных, преимущественно у детей младшего возраста, развиваются катаральные явления: покашливание, насморк или заложенность носа, редко — конъюнктивит, катаральный отит. При осмотре обращают на себя внимание гипе- ремия и зернистость мягкого нёба, нёбных дужек, язычка
Количество мочи в острый период болезни уменьшено, у отдельных пациентов наблюдается незначительная протеинурия, лейкоцитурия, эритроцитурия, а также повышение содержания креатинина и мочевины в сыворотке крови. В начале болезни может быть лейкоцитоз с нейтрофилёзом, в период разгара сменяющийся лейкопенией с лимфоцитозом; СОЭ не изменена. Для копроцитограммы характер- но отсутствие признаков выраженного воспалительного процесса, в то же время обнаруживаются зёрна крахмала, непереваренная клетчатка, нейтральный жир
Симптомы, характерные для лёгких форм ротавирусной инфекции: G субфебрильная температура тела; G умеренная интоксикация в течение 1–2 дней; G нечастая рвота; G стул жидкой кашицей до 5–10 раз в сутки
При среднетяжёлых формах заболевания отмечается: G фебрильная лихорадка; G выраженная интоксикация (слабость, вялость, головная боль, бледность кож- ных покровов); G повторная рвота в течение 1,5–2 дней; G обильный водянистый стул от 10 до 20 раз в сутки; G обезвоживание I–II степени
Тяжёлые формы ротавирусного гастроэнтерита характеризуются бурным началом с нарастанием тяжести состояния ко 2–4-му дню болезни в связи со значительными потерями жидкости (обезвоживание II–III степени), многократной рвотой и бессчётным водянистым стулом (более 20 раз в сутки). Возможны гемо- динамические нарушения
ДиагностикаОсновные клинико-диагностические признаки ротавирусной инфекции: G характерный эпидемиологический анамнез — групповой характер заболева- ния в зимнее время года; G острое начало болезни; G повышение температуры тела и синдром интоксикации; G рвота как ведущий симптом; G водянистая диарея; G умеренно выраженные боли в животе; G метеоризм
Для лабораторного подтверждения ротавирусной природы заболевания используют три группы методов: G методы, основанные на обнаружении ротавируса и его антигенов в фекалиях: – электронная и иммуноэлектронная микроскопия; – РЛА; – ИФА; G методы обнаружения вирусной РНК в копрофильтратах: – метод молекулярных зондов — ПЦР и гибридизации; – электрофорез РНК в полиакриламидном геле или агарозе; G методы обнаружения специфических антител (иммуноглобулины различных классов и/или нарастания титра антител) к ротавирусам в сыворотке крови (ИФА, РСК, РТГА, РНГА)
На практике диагностика ротавирусной инфекции чаще всего основана на обнаружении вирусного антигена в копрофильтратах с помощью РЛА, ИФА в 1–4-е сутки болезни
Лечение
Из диеты исключают молоко и молочные продукты, ограничивают употребле- ние углеводов (овощи, фрукты и соки, бобовые). Пища должна быть физиологи-чески полноценной, механически и химически щадящей, с достаточным содер- жанием белка, жира, минеральных солей и витаминов. Необходимо увеличение кратности приёмов пищи
Один из перспективных методов лечения ротавирусной инфекции — примене- ние препаратов, обладающих противовирусной и интерфероногенной активностью, в частности, меглумина акридонацетата (циклоферона♠). Меглумина акри- донацетат в таблетированной форме принимают в 1–2–4–6–8-й день в возрастной дозировке: до 3 лет — по 150 мг; 4–7 лет — 300 мг; 8–12 лет — 450 г; взрослые — 600 мг однократно. Использование меглумина акридонацетата приводит к более эффективной элиминации ротавируса и сокращению длительности заболевания
Кроме того, в качестве лечебных средств можно применять иммуноглобулины для энтерального введения: иммуноглобулин человека нормальный (IgG+IgA+IgM) — 1–2 дозы 2 раза в день. Антибактериальные средства не показаны
Патогенетическое лечение, направленное на борьбу с дегидратацией и инток- сикацией, осуществляют путём введения полиионных кристаллоидных растворов, внутривенно или внутрь, с учётом степени обезвоживания и массы тела больного
Оральную регидратацию проводят подогретыми до 37–40 °С растворами: глю- косолан♠, цитраглюкосолан♠, регидрон♠. Для инфузионной терапии используют полиионные растворы
Эффективный метод лечения диареи ротавирусной этиологии — энтеросорбция: смектит диоктаэдрический по 1 порошку 3 раза в сутки; полиметилсилоксана полигидрат по 1 столовой ложке 3 раза в сутки; лигнин гидролизный по 2 таблетки 3–4 раза в сутки
Учитывая ферментативную недостаточность, рекомендуют применение поли- ферментных средств (таких, как панкреатин) по 1–2 драже 3 раза в сутки во время еды
Кроме того, при лечении ротавирусной инфекции целесообразно включение биопрепаратов, содержащих бифидобактерии (бифиформ♠ по 2 капсулы 2 раза в сутки)
Норовируснаяя инфекция
Норовирусная инфекция, — острая вирусная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, характеризующаяся умеренной интоксикацией и картиной острого гастроэнтерита с доброкачественным течением
ЭтиологияВозбудитель — РНК-содержащий неклассифицированный вирус Norwalk, имею- щий белковую структуру, округлую форму и размеры около 27–32 нм; устойчивый в окружающей среде, а также к действию дезинфицирующих средств
ЭпидемиологияИсточник возбудителя инфекции — больной человек, заразный до 2 сут после прекращения диареи; механизм передачи возбудителя — фекально-оральный, реализующийся пищевым (зелёный салат, устрицы, мороженое) и водным путём
Вирус Норволк активен в течение всего года без выраженной сезонности, чаще болеют дети старшего возраста и взрослые. Наблюдают как спорадические случаи заболевания, так и групповые вспышки. После перенесённой инфекции развивает- ся стойкий продолжительный иммунитет
Заболевание широко распространено. У 50–70% взрослых, проживающих как в развитых, так и в развивающихся странах, определяются антитела к вирусу Норволк, появляющиеся ещё в детском возрасте. В развитых странах с этим виру- сом связывают около 30% всех эпидемий диарей этой группы. Вирус Норволк был определён как этиологический агент эпидемий в интернатах, летних лагерях и школах
ПатогенезПопадая в организм человека, вирус Норволк нарушает структуру клеток тон- кой кишки, при этом укорачиваются ворсинки клеток, развивается гиперплазия крипт, собственная пластинка слизистой оболочки кишечника инфильтрируется полиморфно-ядерными и моноядерными клетками. Все это обусловливает уме- ренную стеаторею, нарушение всасывания углеводов и снижение активности неко- торых ферментов, располагающихся в пограничном клеточном слое. В слизистой оболочке желудка и толстой кишки значительных изменений не наблюдается. Аденилатциклазная активность клеток не изменяется
Клиническая картинаИнкубационный период — от 10 ч до 2–3 сут. Начало заболевания острое, у некоторых больных — короткий субфебрилитет, сильная слабость, адинамия
Самые частые симптомы: G тошнота и нечастая кратковременная рвота; G боли в эпигастрии и средней части живота (несильные, ноющие или схват- кообразные); G жидкий стул без патологических примесей не более 5–7 раз в сутки в течение 1–2 сут
У большинства пациентов наблюдается головная боль, миалгии. При осмотре живот немного вздут, при пальпации ощущается громкое урчание. Печень и селезёнка не увеличиваются
В гемограмме изредка обнаруживают лейкоцитоз с относительной лимфопени- ей. Заболевание чаще протекает в лёгкой форме, выздоровление наступает через 12–72 ч. Осложнений не установлено
ДиагностикаДиагноз ставят на основании клинических и эпидемиологических данных, под- тверждают лабораторно (радиоиммунные тесты, метод ИФА)
ЛечениеГоспитализацию осуществляют, в основном, по эпидемиологическим показа- ниям. Назначают полноценную диету, включающую механически и химически щадящую пищу. В остром периоде из рациона исключают цельное молоко и туго- плавкие жиры, ограничивают употребление углеводов
Медикаментозное лечение В качестве медикаментозного лечения применяют оральную регидратацию, энтеросорбенты, ферменты, биопрепараты. Антибактериальные средства не пока- заны
РЕСПИРАТОРНЫЕ ИНФЕКЦИИ
Дифтерия
Дифтерия (diphtheria, удушающая болезнь) — острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся преимущественным поражением ротоглотки и дыхательных путей с развитием фибринозного воспаления в месте внедрения возбудителя и токсическим поражением сердечно-сосудистой системы, нервной системы и почек.
Этиология
Corynebacterium diphtheriae (род Corynebacterium, семейство Corynebacteriaceae) — не образующая спор грамположительная палочка булавовидной формы, растёт только на специальных питательных средах (наиболее распространена теллуритовая среда); разделяются на три биовара: mitis (40 сероваров), gravis (14 сероваров) и intermedius (4 серовара). Основной фактор патогенности возбудителя — токсинообразование. Дифтерийный токсин обладает всеми свойствами экзотоксина: термолабильностью, высокой токсичностью (уступает только ботулотоксину и столбнячному токсину), иммуногенностью, нейтрализацией антитоксической сывороткой. Дифтерийная палочка устойчива в окружающей среде: в дифтерийных плёнках, на предметах домашнего обихода, в трупах сохраняется около 2 нед; в воде, молоке — до 3 нед. Под воздействием дезинфицирующих средств в обычных концентрациях гибнет в течение 1–2 мин, при кипячении — мгновенно.
Эпидемиология
Источник возбудителя — больные любой клинической формой дифтерии, а также бактерионосители токсигенных штаммов. Основной путь передачи возбудителя — воздушно-капельный, возможен контактно-бытовой (например, при дифтерии кожи), в редких случаях алиментарный (молоко). Иммунитет при дифтерии антитоксический, а не антибактериальный. Возможны повторные заболевания и заболевания у вакцинированных, протекающие чаще в лёгкой форме. Наиболее активный источник инфекции — больные люди. Число носителей токсигенных коринебактерий в сотни раз превышает количество больных дифтерией. Дифтерию относят к управляемым инфекциям, т.е. заболеваемость высока в том случае, если не проводилась массовая вакцинация населения
Патогенез
Общепризнано, что дифтерийный экзотоксин — первичный поражающий фактор при дифтерии. Проникший в кровь токсин взаимодействует с клеткой посредством связывания с цитоплазматическими рецепторами. Дифтерийный токсин может повреждать любые клетки, особенно при высокой его концентрации, но наиболее часто поражает клетки-мишени: кардиомиоциты, олигодендроглиоциты, лейкоциты. Вследствие блокады карнитин-челночного механизма токсином нарушаются магистральные пути обмена белков (аминокислот), жиров и углеводов в силу того, что ацетил-КоА не может пройти через цитоплазматическую мембрану митохондрий и вступить в цикл Кребса. Клетка начинает испытывать энергетический «голод», вследствие чего изменяются основные метаболические пути. В результате при тяжёлом поражении клетки в цитозоле прогрессирует уве- личение концентрации восстановленных форм никотинамидадениндинуклеотида, лактата и ионов водорода, ингибируется гликолиз, что может привести к деком- пенсированному внутриклеточному ацидозу и гибели клетки. Внутриклеточный ацидоз и высокое содержание жирных кислот вызывают активацию перекисного окисления липидов. При выраженной интенсификации перекисного окисления липидов деструктивные изменения мембранных структур влекут за собой необра- тимые сдвиги гомеостаза. Вследствие поражения клеток-мишеней при тяжёлой дифтерии возникают следующие патофизиологические изменения. • В первые дни болезни наибольшее значение имеет развитие гиповолемии и ДВС-синдрома. • Поражение экзотоксином кардиомиоцитов (у больных тяжёлой дифтерией уже с первых дней болезни). • Поражение нейронов возникает при всех формах дифтерии, но при тяжёлой дифтерии характер этих изменений всегда массивный и выраженный. Помимо черепных и соматических нервов, при тяжёлой дифтерии также поражается парасимпатический отдел вегетативной нервной системы Основные причины смерти при дифтерии — поражение сердца, паралич дыха- тельной мускулатуры, асфиксия при дифтерии дыхательных путей, ДВС-синдром с развитием ОПН и/или РДС взрослых и вторичная бактериальная инфекция (пневмония, сепсис).
Клиническая картина
Инкубационный период 2–12 (чаще 5–7) сут. Классификация Дифтерию классифицируют по локализации процесса и тяжести течения болез- ни. Самые частые формы — дифтерия ротоглотки (зева) и дыхательных путей. Возможна также дифтерия носа, глаз, уха, половых органов. Эти формы обычно сочетаются с дифтерией ротоглотки. Дифтерия кожи и ран встречается главным образом в тропических странах. Основные симптомы и динамика их развития Дифтерия ротоглотки характеризуется наличием на миндалинах плёнчатых налётов, которые могут распространяться за пределы миндалин на нёбную занаве- ску, язычок, мягкое и твёрдое нёбо. Налёты имеют равномерную белую или серую окраску, расположены на поверхности миндалин («плюс ткань»), с усилием снимаются шпателем, при этом обнажается эрозированная кровоточащая поверхность.Налёты не растираются, не тонут и не растворяются в воде. Катаральная форма дифтерии ротоглотки диагностируется очень редко на основании эпидемиологиче- ских, клинических и бактериологических данных, когда налёты отсутствуют, есть лишь лёгкая гиперемия и отёчность миндалин. Дифтерию ротоглотки в зависимости от характера налётов разделяют на следующие формы: ·локализованная (островчатая, плёнчатая) — налёты не выходят за пределы миндалин; ·распространённая — налёты переходят на мягкое и твёрдое нёбо, дёсны. Для лёгкой формы дифтерии ротоглотки характерны острое начало с повышения температуры тела до 37,5–38,5 °С, общего недомогания, боли в горле (незначительной или умеренной). Налёты появляются через сутки, на 2-й день приобретают характерный вид. При осмотре отмечают бледность лица, умеренную гиперемию миндалин с синюшным оттенком. Поднижнечелюстные лимфатические узлы, как правило, не увеличены, безболезненны при пальпации. Лихорадка длится до 3 сут. Без лечения налёты сохраняются до 6–7 дней. При лёгких формах дифтерии ротоглотки (локализованная и распространённая) возможен отёк миндалин. Токсические формы дифтерии Наличие отёка ротоглотки даёт основание диагностировать токсическую форму дифтерии, которая протекает в среднетяжёлой и тяжёлой форме. Субтоксическая и токсическая дифтерия ротоглотки I степени чаще имеет среднетяжёлое течение. Эти формы отличаются более выраженной общей интоксикацией, более высокой (до 39 °С) и длительной лихорадкой, выраженной астенией, тахикардией, более сильными болями в горле. Налёты на миндалинах распространённые, иногда поражена только одна миндалина. Миндалины отёчны, ярко гиперемированы. Отёк шейной клетчатки локализуется при субтоксическом варианте в подчелюстной области, а при токсической дифтерии I степени распространяется до середины шеи. Токсическая дифтерия II, III степени и гипертоксическая дифтерия характеризуются быстрым развитием общей интоксикации, ознобом, повышением температуры тела до 40 °С и выше, резкой мышечной слабостью, головной болью, сильными болями в горле. При осмотре выявляют бледность кожи, выраженный отёк шейной клетчатки, распространяющийся при токсической дифтерии II степени до ключиц, при III степени — ниже ключиц на грудную клетку. Отёк тестоватой консистенции, безболезненный. Поднижнечелюстные лимфатические узлы умеренно болезненны, значительно увеличены, контуры их из-за отёка и периаденита нечёткие. При осмотре слизистой ротоглотки обнаруживают диффузную гиперемию и резкую отёчность миндалин, которые могут смыкаться по средней линии, что затрудняет дыхание, глотание, придаёт голосу носовой оттенок. Налёты в первые сутки могут иметь вид белесоватой паутинки, на 2–3-й день болезни приобретают характерный вид, причём у этой категории больных плёнки плотные, распространённые, выходят за переделы миндалин, образуют складки. При гипертоксической дифтерии на 2–3-й день болезни развиваются ИТШ и полиорганная недостаточность. Для геморрагического варианта характерно пропитывание налётов кровью, из-за чего они приобретают багровую окраску. При тяжёлом течении болезни лихорадка и интоксикация сохраняются до 7–10 сут, налёты отторгаются ещё в более поздние сроки, оставляя после себя эрозированную поверхность.
Дифтерия дыхательных путей (дифтерийный круп) — частая форма болезни. Дифтерийный круп может быть локализованным (дифтерия гортани), распространённым (дифтерия гортани и трахеи) и нисходящим, когда процесс распространяется на бронхи и бронхиолы. Тяжесть течения этой формы болезни определяется выраженностью ДН. Болезнь начинается с небольшого повышения температуры тела, появления сухого, «лающего» кашля, охриплости голоса, переходящей в афонию. В течение 1–3 сут процесс прогрессирует, появляются признаки стеноза гортани: шумный вдох, сопровождающийся втяжением эпигастральной области, межреберий, над- и подключичных ямок, яремной ямки. Через несколько часов — 2–3 сут присоединяются признаки ДН: двигательное беспокойство, бессонница, цианоз, бледность кожи, тахикардия, повышение АД, сменяющиеся заторможенностью, судорогами, артериальной гипотензией. При исследовании крови выявляют нарастающую гипоксемию, гиперкапнию, респираторный ацидоз. У взрослых из-за широкого просвета гортани такие симптомы, как афония и стенотическое дыхание, могут отсутствовать, процесс развивается медленно. Признаки ДН проявляются на 5–6-й день болезни при развитии нисходящего крупа: возникают чувство нехватки воздуха, тахикардия, бледность кожных покровов, цианоз, аускультативно — ослабление дыхания. Плёнки легко снимаются и могут быть удалены электроотсосом.
Дифтерия носа — третья по частоте форма болезни. Начинается постепенно. Температура тела нормальная или субфебрильная. Отмечают сукровичные или слизисто-гнойные выделения, чаще односторонние, появляется мацерация кожи у входа в нос, при риноскопии выявляют эрозии, корки, фибринозные плёнки в носовых ходах, которые могут распространяться на кожу, слизистую оболочку гайморовых пазух. В редких случаях возникает отёк лица. Дифтерия глаз. Процесс обычно односторонний. Характерен отёк век, суже- ние глазной щели, гнойно-сукровичное отделяемое. На переходной складке конъ- юнктивы появляется фибринозная плёнка, которая может распространяться на глазное яблоко. Возможен отёк мягких тканей в области глазницы. Дифтерия половых органов встречается у девочек. Характерны отёчность вульвы, выделения. Фибринозные плёнки локализуются в области малых губ и входа во влагалище. Дифтерия кожи и ран встречается преимущественно в тропиках, характеризуется наличием поверхностной малоболезненной язвы, покрытой фибринозной плёнкой. Общее состояние нарушается мало; течение вялое, до 1 мес. Комбинированная дифтерия. Чаще всего наблюдается сочетание дифтерии ротоглотки с дифтерией дыхательных путей и носа, реже глаза и половых органов. Для тяжёлых токсических форм дифтерии характерно поражение различных органов и систем. В клинической практике целесообразно выделять несколько клинических синдромов. Синдром местных проявлений (отёк подкожной клетчатки шеи, ротоглотки, распространённые фибринозные налёты и др.) описан выше. Интоксикационный синдромнаблюдают у всех больных с токсически- ми формами дифтерии. Характерны резкая слабость, лихорадка, артериальная гипотензия, жажда, тахикардия, снижение диуреза, анорексия и бессонница. Выраженность интоксикационного синдрома в острый период болезни — один из критериев тяжести течения. Синдром токсико-метаболического шока.При особо тяжёлом течении дифтерии (фульминантная форма) и выраженной интоксикации у 3–7% больных развивается токсико-метаболический шок. Он характеризуется тяжёлым ДВС- синдромом (проявляющимся не только лабораторными изменениями, но и кли- ническими симптомами), выраженной гиповолемией, ОДН и ОПН, нарушением функции миокарда (нарушение сократимости и проводимости) и поражением черепных нервов. Синдром ДН при тяжёлой дифтерии может быть обусловлен следующими основными причинами: ИТШ, стенозом гортани, частичной непроходимостью верхних дыхательных путей (отёк надгортанника, выраженный отёк ротоглотки с дисфункцией мягкого нёба, западение корня языка, преимущественно у алкого- ликов, аспирация плёнки в трахею), нисходящим крупом. Наиболее частые признаки ДН — одышка, цианоз (акроцианоз), угнетение сознания различной степени, нестабильная гемодинамика (артериальная гипер- тензия, тахи- и брадиаритмии), снижение диуреза, гипоксемия, гипер- или гипо- капния. Синдром диссеминированного внутрисосудистого свёртывания крови (ДВС-синдром) наблюдают при всех формах токсической дифтерии. Клинические признаки ДВС-синдрома при тяжёлых формах регистрируют в 15% случаев. Развитие сывороточной болезни усугубляет течение ДВС-синдрома. Синдром поражения миокардаСердце страдает в результате непосредственного действия экзотоксина. При тяжёлых формах дифтерии действуют дополнительные поражающие факторы: гипоксические состояния различного генеза (ДВС-синдром, ДН, анемия), объ- ёмные перегрузки при ОПН, электролитные нарушения. Клинические проявления синдрома складываются из кардиальных жалоб, син- дрома сердечной недостаточности и физикальных данных. Кардиальные жалобы при дифтерии непостоянны и не отражают тяжести поражения сердца. При обследовании наибольшее значение имеет выявление аритмии и дефицита пульса, бледности или цианоза. Для более точной и ранней оценки состояния миокарда необходимы данные ЭКГ, ЭхоКГ исследований, а также результаты исследования активности кардиоспецифических ферментов. Критерии, определяющие тяжёлое поражение миокарда с неблагоприятным прогнозом: ·прогрессирующая сердечная недостаточность преимущественно по правожелудочковому типу (по клиническим данным); ·выраженные нарушения проводимости; ·снижение сократимости; частые тахиаритмий и фибрилляции желудочков. Синдром поражения периферической нервной системы в виде бульбарного пареза (паралич) и полинейропатии. Бульбарный парез (паралич) при токсических формах дифтерии выявляют в 30% наблюдений. Возникают гнусавость голоса и поперхивание при приёме жидкой пищи. Поражение других пар черепных нервов (III, VII, X, XII) встречается реже, возникает парез (паралич) мышц глотки, языка, мимической мускулатуры, нарушается кожная чувствитель- ность. Выявляют периферический парез (или паралич) с угнетением или отсутствием сухожиль- ных рефлексов, уменьшением мышечной силы, нарушениями чувствительности, ограничением подвижности диафрагмы Синдром поражения почек Поражение почек при дифтерии принято характеризовать термином «токсиче- ский нефроз». При тяжёлом течении заболевания поражение почек проявляется микрогематурией, лейкоцитурией, цилиндрурией, протеинурией. Прямое поражающие действие экзотоксина на паренхиму почек минимально, не приводит к клиническим проявлениям почечной недостаточности и не влияет на тяжесть течения
Диагностика
Диагноз дифтерии, независимо от локализации процесса, устанавливают на основании наличия на слизистых оболочках или коже фибринозной плёнки, обладающей характерными свойствами. При распространённой и токсических формах большое диагностическое значение имеет распространение налётов за пределы миндалин, отёк миндалин, а при токсических формах — отёк мягких тканей шеи. Для подтверждения диагноза важны данные микробиологического исследова- ния мазков с поражённой поверхности (слизистая оболочка миндалин, носа и др.). После выделения культуры возбудителя определяют её токсигенные и биологиче- ские свойства.
Меры профилактики
Специфические
Иммунопрофилактика — основной метод борьбы с дифтерией. Плановую вакцинацию и ревакцинацию населения, согласно национальному календарю прививок, проводят вакцинами, содержащими адсорбированный дифтерийный анатоксин (АКДС♠, АКДС-М♠, АДС-М♠, АД-М♠, а также импортные вакцины — тетракок♠, имовакс полио♠). Неспецифические Важное значение имеют раннее выявление и изоляция больных и носителей токсигенных коринебактерий, выписка их после двукратного отрицательного результата бактериологического исследования отделяемого ротоглотки. В кол- лективе после изоляции больного в течение 7 сут проводят термометрию и еже- дневный врачебный осмотр. Контактных с больными и носителями однократно обследуют бактериологически. В очаге после изоляции больного или носителя проводят заключительную дезинфекцию.
Лечение
Режим и диета В остром периоде болезни и в более поздние сроки при наличии признаков поражения сердца и нервной системы показан постельный режим. В зависимости от состояния больного используют стол № 10, зондовое или парентеральное пита- ние. Медикаментозная терапия Основное средство лечения — ПДС, которая нейтрализует дифтерийный токсин, циркулирующий в крови (поэтому она эффективна только в ранние сроки болез- ни — в первые 2 сут). После 3-х суток болезни введение ПДС малоэффективно, а в ряде случаев даже вредно. При лёгком течении заболевания (локализованная, рас- пространённая форма) сыворотку вводят только при отрицательных результатах кожной пробы. Если результат положительный, от введения сыворотки следует воздержаться. При среднетяжёлой и тяжёлой форме дифтерии ротоглотки, а также при дифтерии дыхательных путей сыворотку вводят обязательно, хотя при дифте- рии дыхательных путей эффект менее явный. При положительной кожной пробе сыворотку вводят в условиях отделения реанимации после предварительного вве- дения глюкокортикоидов и антигистаминных препаратов. Сыворотку вводят однократно внутримышечно и внутривенно. При комбинированных формах дозу увеличивают на 20–30 тыс. ME. При средней тяжести и тяжёлых формах, а также при дифтерии дыхательных путей для скорейшего подавления возбудителя назначают антибиотики: пеницил- лины, цефалоспорины, препараты тетрациклинового ряда, макролиды, комбини- рованные препараты (ампиокс♠) — в средних терапевтических дозах в течение 5–8 сут. Проводят дезинтоксикационную терапию. В тяжёлых случаях показан плазмаферез. Кратковременное применение глюкокортикоидов целесообразно только по экстренным показаниям (ИТШ, стеноз гортани), так как у больных тяжёлыми формами болезни выражена иммуносупрессия и существует высокая вероятность развития бактериальных осложнений. При дифтерии дыхательных путей показаны тепловые и отвлекающие процеду- ры, ингаляция, антигистаминные препараты, глюкокортикоиды, оксигенотерапия. При прогрессировании стеноза — интубация трахеи или трахеотомия. При нисхо- дящем крупе оперативное лечение малоэффективно, его необходимо дополнять санационной бронхоскопией для удаления плёнок. При миокардите необходим полный покой. Применяют триметазидин, мель- доний, пентоксифиллин. При полинейропатии назначают постельный режим, полноценное питание, при дыхательных расстройствах — ИВЛ, профилактика вторичной инфекции.
Менингококковая инфекция
Менингококковая инфекция — острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, которая характеризуется лихорадкой, интоксикацией, геморрагической сыпью и гнойным воспалением оболочек мозга.
Этиология
Возбудитель — менингококк Neisseria meningitidis, рода Neisseria семейства Neisseriaceae. Это бобовидный кокк, располагающийся попарно (диплококк). Менингококк грамотрица- телен, имеет полисахаридную капсулу и выросты — пили. Для культивирования используют специальные среды, содержащие белок или набор аминокислот (среда Мюллера–Хинтона и др.). Менингококки неоднородны по антигенной структуре: различаются поли- сахаридными антигенами капсулы и белковыми антигенами. В соответствии с антигенной структурой полисахаридов капсулы менингококки подразделяют на серогруппы А, В, С, H, I, K, L, X, Y, Z, 29E, W-135. Менингококк малоустойчив в окружающей среде. При 55 °С погибает через 5 мин, при 100 °С — через 30 c. Плохо переносит низкие температуры. Несколько дольше, до 5 сут, может сохранять жизнеспособность при 5–6 °С. В патологии человека наибольшую роль играют менингококки серогрупп А, В и С. К факторам патогенности относят капсулу, пили, ЛПС и IgA-протеазы.. Эпидемиология Резервуар и источник возбудителя — больной человек или бактерионоситель. Существуют три группы источников инфекции, различных по своей значимости: носители менингококка, больные менингококковым назофарингитом и больные с генерализованной формой менингококковой инфекции. Носительство менингококка широко распространено, чаще бывает острым и длится не более месяца. Больные менингококковым назофарингитом — наиболее важный источник возбудителя менингококковой инфекции и эпидемического процесса, поскольку лёгкое течение болезни и активный образ жизни позволяют им иметь множество контактов. Механизм передачи возбудителя — аэрозольный, путь передачи — воздушно- капельный. В мегаполисах отмечают осенний подъём, связанный с усилением контактов между детьми в дошкольных учреждениях, школах, интернатах и др. В воинских частях возможны вспышки, связанные с поступлением призывников.
Патогенез
Менингококк имеет двойственную природу: с одной стороны, это гноеродный кокк, вызывающий гнойный менингит, артрит; с другой — он содержит (как и другие грамотрицательные микроорганизмы) ЛПС, т.е. эндотоксин, вызывающий развитие интоксикационного синдрома. Защитные механизмы при менингококковой инфекции связаны с барьерными функциями эпителия носоглотки, действием секреторных IgA, системой компле- мента, фагоцитарной активностью полиморфно-ядерных нейтрофилов, специфи- ческими бактерицидными антителами. При бактерионосительстве паразитирование менингококка на слизистой обо- лочке носоглотки не сопровождается субъективными нарушениями здоровья, но при осмотре в большинстве случаев обнаруживают картину острого фолликуляр- ного фарингита (местная воспалительная реакция). При назофарингите аналогичные местные изменения сопровождаются ката- ральными явлениями, в части случаев — лихорадочной реакцией, что обусловлено токсинемией. Механизм генерализации инфекции изучен не до конца, однако ряд факторов, способствующих генерализации, известен: высокая IgA-протеазная активность эпидемического штамма, высокая инфицирующая доза при тесном контакте. Важнейшее звено патогенеза генерализованной формы менингококковой инфекции — бактериемия. При этом течение инфекционного процесса зависит от соотношения патогенных свойств возбудителя и защитных механизмов. В опти- мальных случаях (лёгкие формы менингококкемии) гибель менингококка сопро- вождается высвобождением небольших количеств ЛПС, обладающего мощным активизирующим действием на все защитные системы организма, благодаря чему организм быстро освобождается от возбудителя. Однако чаще, в связи с интенсив- ной бактериемией, нейтрофилы вырабатывают свой ресурс миелопероксидазы, и фагоцитоз становится незавершённым. Нейтрофилы, содержащие жизнеспо- собные менингококки, преодолевают гистогематические барьеры и заносят воз- будитель в субарахноидальное пространство и полость суставов, где развивается гнойное воспаление. При более высоких уровнях бактериемии и токсинемии усиливается потребле- ние комплемента, подавляется фагоцитоз, снижается бактерицидная активность крови, происходит размножение возбудителя и накопление высоких доз ЛПС, которые подавляют фагоцитоз и функциональную активность тромбоцитов. Нарушаются окислительно-восстановительные процессы в клеточных мембранах. Нерегулируемый выброс биологически активных веществ (кинины, катехолами- ны, ИЛ, белки ранней фазы), инициирующих генерализованную воспалительную реакцию, клинически выражается в картине ИТШ. Шок развивается при концен- трации ЛПС в крови более 800–1000 нг в 1 мкл, а при концентрации свыше 8000 нг в 1 мкл, как правило, становится необратимым. Всё это объясняет высокую летальность при фульминантной менингококкемии. Проникновение возбудителя в субарахноидальное пространство приводит к развитию гнойного менингита. Раньше всего выявляют признаки повы- шенной проницаемости гематоликворного барьера и продукции СМЖ, что сопровождается повышением ЛД и увеличением содержания глюкозы в СМЖ до 3–4 мкмоль/л и более. Затем очень быстро (в течение нескольких часов) развивается картина разлитого гнойного менингита. Тяжесть течения и исход менингита в ранние сроки определяется степенью выраженности острого отёка- набухания головного мозга, а в поздние сроки при отсутствии адекватной тера- пии — прогрессированием гнойно-воспалительного процесса, вовлечением в него вещества и желудочков мозга, нарушением ликвородинамики и развитием водянки головного мозга. В патогенезе острого отёка-набухания головного мозга ведущую роль играют два компонента — токсический и воспалительный. Токсическое поражение сосудов мозга, микроциркуляторные расстройства, воспалительный процесс приводят к гипоксии мозга, повышению проницаемости ГЭБ. Увеличение объёма мозга связано с проникновением жидкости во внеклеточное пространство и увеличе- нием объёма нейроцитов и глиальных элементов вследствие выхода из строя ионного насоса и поступления в клетки натрия и воды. Увеличение объёма мозга в замкнутом пространстве ведёт к дислокации продолговатого мозга с опущением миндалин мозжечка в большое затылочное отверстие, что приводит к сдавлению, ишемии, а затем к демиелинизации и гибели клеток ствола мозга и сопровождает- ся нарушением жизненно важных функций. В целом более 90% летальных исходов при менингококковой инфекции обусловлено ИТШ, острым отёком-набуханием головного мозга или их сочетанием. Около 10% летальных исходов связано с про- грессирующим менингоэнцефалитом.
Клиническая картина
Инкубационный период при генерализованных формах длится от 1 до 10, чаще 2–4 сут. Клиническая картина многообразна. Разработана отечественная классификация, приближённая к международной.
Менингококковая инфекция
• Локализованные формы:
G носительство;
G менингококковый назофарингит.
• Генерализованные формы:
G менингококкемия:
– острая неосложнённая,
– острая осложнённая ИТШ (синдром Уотерхауса–Фридериксена),
– хроническая;
G менингококковый менингит:
– неосложнённый,
– осложнённый ОНГМ с дислокацией,
– менингоэнцефалит;
G сочетанная (смешанная форма):
– неосложнённая,
– осложнённая ИТШ,
– осложнённая ОНГМ с дислокацией;
G другие формы:
– артрит,
– иридоциклит,
– пневмония,
– эндокардит.
Менингококковое носительство протекает бессимптомно, но при осмотре можно обнаружить картину острого фолликулярного фарингита. Менингококковый назофарингит — наиболее частое проявление менингококко- вой инфекции. Больные жалуются на затруднение носового дыхания, скудные выделения из носа, небольшой кашель, боли в горле, головную боль. Лихорадку (чаще субфебриль- ную) продолжительностью до четырёх суток отмечает половина больных. В более тяжёлых случаях температура достигает 38,5–39,5 °С, что сопровождается озно- бом, болями в мышцах и суставах. При осмотре — бледность кожных покровов, инъекция сосудов склер и конъюнктив. Слизистая оболочка передних отделов зева без патологических изменений. Слизистая оболочка задней стенки глотки гиперемирована, отёчна, часто видны наложения слизи. На 2–3-й день появляет- ся гиперплазия лимфоидных фолликулов. Через несколько дней воспали- тельные изменения стихают, но гиперплазия фолликулов сохраняется до 2 нед. У детей в возрасте до 3 лет выражены насморк, кашель, воспалительные измене- ния распространяются на миндалины, нёбные дужки и мягкое нёбо. Изменения картины крови для назофарингита малохарактерны, в более тяжёлых случаях — нейтрофильный лейкоцитоз со сдвигом формулы влево и увеличение СОЭ. Менингококкемияхарактеризуется сочетанием лихорадочно-интоксикационного синдрома с поражением кожных покровов и широким диапазоном тяжести течения. В типичных случаях начало внезапное или на фоне назофарингита. Появляются озноб, боли в пояснице, суставах, мышцах, головная боль, иногда рвота, резкая слабость, температура повышается в течение нескольких часов до 39 °С и выше. Через 6–24 ч после начала озноба появляется кардинальный сим- птом менингококкемии — полиморфная геморрагическая сыпь. Элементы сыпи имеют неправильную, часто звездчатую форму, размеры варьируют от петехий до крупных экхимозов диаметром 2–3 см и более. Крупные элементы плотноваты на ощупь, чувствительны при пальпации, возвышаются над поверхностью кожи. Сыпь локализуется преимущественно в дистальных отделах конечностей, на лате- ральной поверхности бёдер и ягодиц. В течение суток она может стать обильнее; в дальнейшем новые элементы не появляются. Мелкие элементы пигментируются и через несколько дней исчезают; крупные подвергаются некрозу, покрываются коркой, после отпадения которой остаются эрозивно-язвенные дефекты с последую- щим формированием рубцов. Чем раньше появляется сыпь и чем крупнее элементы, тем тяжелее протекает болезнь. До появления геморрагических элементов возмож- но возникновение не обильных папулёзных или розеолёзных высыпаний, которые быстро исчезают или трансформируются в геморрагии. Лёгкие формы менингококкемии часто не диагностируются или диагностируются уже при развитии осложнений (артрит, иридоциклит). Для них характерны кратковременная лихорадка, длящаяся несколько часов–сутки, типичная, но мелкая и не обильная сыпь или только розеолёзные и папулёзные элементы. Совершенно иначе протекает фульминантная менингококкемия. Начало бур- ное, с потрясающего озноба. Характерен резко выраженный токсикоз с первых часов болезни, проявляющийся интенсивной головной болью и рвотой, голово- кружением, болями в пояснице, конечностях, суставах, тахикардией, одышкой. Температура в течение нескольких часов достигает 40 °С и более. Сыпь появляет- ся, как правило, в течение первых 12 ч после начала озноба. Элементы крупные, быстро некротизируются и приобретают багрово-синюшную окраску, локализу- ются не только в типичных местах, но и на лице, шее, животе, передней поверх- ности грудной клетки, причём в этих местах часто бывают обильнее. Возможны геморрагические некрозы кончика носа, мочек ушей, гангрена ногтевых фаланг и даже кистей и стоп. Появлению сыпи предшествуют обильные кровоизлияния в конъюнктивы и склеры глаз, слизистые оболочки ротоглотки. На этом фоне развивается картина ИТШ. Симптомы первой фазы шока: двигательное беспокойство, тревога, снижение критики к своему состоянию; гиперестезия, бледность кожных покровов, похоло- дание конечностей, цианоз губ и ногтевых фаланг, одышка. В это время АД ещё в пределах нормы, иногда даже повышено. Вторая фаза шока развивается через несколько часов. На фоне вновь появляющихся элементов сыпи снижается тем- пература тела, АД падает до 50% нормы (особенно диастолическое), тоны сердца становятся приглушёнными, нарастает одышка, снижается диурез, усиливается цианоз. Переход в третью фазу шока характеризуется падением АД менее 50% нормы. Часто давление на локтевой артерии определить невозможно, хотя пуль- сация сонных и бедренных артерий сохраняется. Температура тела снижается до 35–36 °С, цианоз становится разлитым. На коже появляются багрово-синюшные пятна. Развиваются носовые, желудочно-кишечные, почечные, маточные крово- течения, олигоанурия. У больных часто сохраняется сознание, но они находятся в состоянии прострации, безучастны, испытывают ощущение холода; гиперестезия сменяется анестезией. У части больных возможны потеря сознания, судороги. Тоны сердца глухие, аритмия. В лёгких дыхание ослаблено, особенно в нижних отделах. На фоне лечения у части больных в течении шока доминируют проявления тромбогеморрагического синдрома, у других — шокового лёгкого или ОПН.. Картина крови у больных менингококкемией характеризуется резко выра- женным нейтрофильным лейкоцитозом до 30–40 тыс. клеток в 1 мкл, сдвигом лейкоцитарной формулы влево, появлением в крови миелоцитов и промиело- цитов, нередко отмечают умеренную тромбоцитопению. При тяжёлых формах менингококкемии, осложнённых шоком, лейкоцитоз часто отсутствует, возмож- ны лейкопения и нейтропения, а также тромбоцитопения до 40–50 тыс. и ниже. Тромбоцитопения сочетается с резким снижением функциональной активности тромбоцитов. Лейкопения и тромбоцитопения — неблагоприятные прогностиче- ские признаки. Изменения в моче малохарактерны, однако в тяжёлых случаях отмечают проте- инурию, гематурию, снижение плотности. Изменения в системе гемостаза зависят от тяжести течения болезни. При неосложнённых формах преобладает тенденция к гиперкоагуляции за счёт повышения уровня фибриногена и угнетения фибрино- лиза. В тяжёлых случаях развивается коагулопатия потребления с резким сниже- нием уровня фибриногена, активности тромбоцитарных и плазменных факторов свёртывания и появлением в крови продуктов деградации не только фибрина, но и фибриногена. Изменения кислотно-основного состояния сводятся в тяжёлых случаях к мета- болическому ацидозу (при развитии шока — декомпенсированному), гипоксемии, уменьшению артериально-венозного соотношения по кислороду за счёт шунтиро- вания крови в малом круге. При развитии шока, как правило, наблюдают гипока- лиемию, которая при развитии ОПН сменяется гиперкалиемией, сочетающейся с повышением содержания креатинина. При микроскопии мазка крови часто обнаруживают характерные диплококки, расположенные чаще внеклеточно, иногда скоплениями. Менингит, также как и менингококкемия, начинается остро, но не столь бурно. Появляются познабливание, головная боль, температура в течение первых суток достигает 38,5–39,5 °С. Головная боль быстро усиливается и к концу суток ста- новится труднопереносимой, приобретает распирающий характер. Она обычно бывает диффузной, но может локализоваться преимущественно в лобно-теменной или затылочной области. Головная боль усиливается при резких движениях, под воздействием яркого света и громких звуков. Несколько позже присоединяется тошнота, а затем рвота, часто «фонтаном». Одновременно появляется гипере- стезия кожи конечностей, живота. Во второй половине суток или на второй день болезни при осмотре чётко определяются менингеальные симптомы, которые могут сочетаться с симптомами натяжения (симптомы Нери, Ласега). Степень выраженности менингеального синдрома по мере развития менингита прогрес- сирует. С 3–4-го дня болезни больные (особенно дети) занимают вынужденную менингеальную позу: на боку с запрокинутой головой и поджатыми к туловищу ногами (поза «легавой собаки»). Со вторых суток нарастает общемозговой синдром: заторможенность, сопор, психомоторное возбуждение. На 2–3-й дни также возможно появление очаговых симптомов: парезы черепных нервов (чаще лицевого и глазодвигательных), пирамидные знаки, иногда парезы конечностей, тазовые расстройства. Особенно серьёзно развитие гнойного лабиринтита или кохлеарного неврита VIII пары черепных нервов. При этом появляется шум в ухе (ушах), затем сразу развивается глухота (больные говорят «отключён слух»). Со стороны внутренних органов существенной патологии не отмечают. Возможны относительная брадикардия, повышение АД, особенно систолического. Картина крови при менингококковом менингите аналогична таковой при менингококкемия, но лейкоцитоз менее выражен, в пределах 15–25 тыс. в 1 мкл. Изменения в моче отсутствуют. При исследовании кислотно-основного состоя- ния отмечают тенденцию к респираторному алкалозу. Наиболее информативны изменения в СМЖ. При спинномозговой пункции жидкость уже с первых часов болезни вытекает под повышенным давлением, однако при частой рвоте возможна и ликворная гипотензия. Раньше всего отмечают повышение уровня глюкозы до 3,5–4,5 ммоль/л. В дальнейшем этот уровень падает, а на 3–4-й день глюкоза может не определяться. Далее в СМЖ при нормальном цитозе появляются нейтрофилы. В это время, фактически до развития воспаления, возбудитель можно обнаружить в субарахноидальном пространстве всеми доступными методами. Затем в течение нескольких часов СМЖ приобретает гнойный характер, становится мутной, ней- трофилов содержит до 3–10 тыс. в 1 мкл (причём они составляют более 90% всех клеток), количество белка повышается до 1,5–6,0 г/л и более. Содержание лактата увеличивается до 10–25 ммоль/л. Становятся резко положительными осадочные пробы, pH СМЖ снижается до 7–7,1 (ацидоз). При исследовании СМЖ важно обращать внимание на наличие ксантохромии и примеси эритроцитов, указываю- щих на субарахноидальное кровоизлияние на фоне менингита. Наиболее частое осложнение менингококкового менингита — ОНГМ той или иной степени. Тяжёлый, жизнеугрожающий ОНГМ с синдромом дислокации и ущемлением ствола мозга наблюдается у 10–20% больных генерализованной фор- мой менингококковой инфекции. ОНГМ может развиться с первых часов болезни (молниеносная форма менингита), когда ещё не сформировался гнойный экссудат в оболочках мозга, а у больных старше 70 лет с исходно сниженным мозговым кровотоком — до 3–5-го дня лечения. Симптомы тяжёлого прогрессирующего ОНГМ — спутанное сознание, психо- моторное возбуждение с быстрым развитием комы, генерализованные клонико- тонические судороги, тахипноэ, аритмия (как по частоте, так и по глубине дыхательных движений), появление шумного паралитического дыхания с участием вспомогательных мышц при малой экскурсии диафрагмы. Подобный тип дыхания сопровождается нарастанием гипоксемии и гипокапнии, способствует угнетению дыхательного центра, гиповен- тиляции нижних отделов лёгких, а в дальнейшем — развитию пневмонии. У части больных регистрируют дыхание типа Чейна–Стокса, затем наступает апноэ (сер- дечная деятельность, как правило, сохраняется ещё несколько минут). Довольно показательны изменения со стороны сердечно-сосудистой системы. Брадикардию наблюдают редко, чаще тахиаритмию с быстрым изменением частоты сердечных сокращений в пределах 120–160 в минуту (в два раза чаще возрастной нормы). АД повышено за счёт систолического до 140–180 мм рт.ст., нестабильно. У части боль- ных, особенно у детей, наоборот, наблюдают выраженную гипотензию. Характерны вегетативные нарушения: багрово-синюшная (при гипотензии — пепельно-серая) окраска лица, усиленное пото- и салоотделение. При исследовании крови — гипер- гликемия, тенденция к гипонатриемии, гипоксемия, гипокапния со снижением раСО2 до 25 мм и ниже, декомпенсированный респираторный алкалоз. Чаще всего встречается сочетанная (смешанная) форма менингококковой инфекции. При этом всегда менингококкемия предшествует возникновению менингококкового менингита, который может развиться после кратковременной (несколько часов) ремиссии после появления сыпи. Вновь повышается температу- ра, нарастает головная боль и появляются менингеальные симптомы. Сочетанной форме, также как и менингококкемии, часто предшествует менингококковый назофарингит. Менингококковую пневмонию, как правило, клинически не дифференцируют от пневмококковой, поэтому достоверных данных о её частоте нет. Менингококковый артрит и иридоциклит обычно являются следствием недиагностированной менин- гококкемии. Хроническая менингококкемия протекает с периодическими подъёмами тем- пературы, сопровождающимися высыпаниями на коже, артритом или полиартри- том Помимо описанных выше, наиболее частое осложнение генерализованной формы менингококковой инфекции — полиартрит. Он развивается обычно у больных менингококкемией и сочетанной формой болезни и очень редко при менингококковом менингите. Полиартрит может развиваться в первые дни болезни. В этих случаях поражаются преимущественно мелкие суставы кисти. На 2–3-й неделе чаще наблюдаются артриты и полиартриты с поражением крупных и средних суставов (коленного, голеностопного, плечевого, локтевых).
Диагностика
требу- ет бактериологического подтверждения, т.е. получения и типирования культуры менингококка из носоглоточной слизи. Клиническая диагностика менингококкемии и сочетанной формы менингокок- ковой инфекции в типичных случаях не представляет трудностей, однако возмож- но большое сходство с целым рядом болезней, протекающих с геморрагическими высыпаниями и поражением ЦНС. Менингококковый менингит клинически труд- ноотличим от других гнойных первичных менингитов, поэтому важно лаборатор- но подтвердить диагноз генерализованной менингококковой инфекции. Особое значение для дифференциальной диагностики с вирусными инфекциями имеют островоспалительные изменения в крови. Для диагностики менингококкового менингита решающее значение имеет исследование СМЖ. Из лабораторных способов диагностики наиболее значимы микробиологиче- ские методы, РЛА и ПЦР. Бактериоскопически менингококк можно обнаружить в крови и СМЖ, однако данные бактериоскопии ориентировочны. Выделение куль- туры менингококка — наиболее достоверный метод, но его результаты зависят от многих факторов. • Применение антибиотиков до забора СМЖ и крови уменьшает частоту высева в 2–3 раза. • Важно доставить материал в лабораторию сразу поле забора (без охлажде- ния). • При использовании качественных питательных сред частота положительных результатов на практике составляет 30–60%. РЛА, применяемая для выявления антигена менингококка в СМЖ, увеличивает частоту положительных результатов до 45–70%, наконец ПЦР позволяет подтвер- дить диагноз более чем у 90% больных, причём антибиотики не влияют на частоту положительных результатов. Получение культуры возбудителя позволяет определить его чувствительность к антимикробным препаратам и при необходимости провести коррекцию этиотроп- ной терапии. Иммунологическая диагностика (РПГА) имеет вспомогательное значение, так как антитела выявляются не ранее 3–5-го дня болезни. Достоверное значение имеет исследование парных сывороток крови, причём 4-кратное нарастание титров выявляется у 40–60% больных, а у детей в возрасте до трёх лет — не более чем у 20–30%.
Режим и диета
При генерализованной форме менингококковой инфекции режим вначале стро- гий постельный, в дальнейшем — постельный и палатный. Специальной диеты не требуется. При коме, проведении ИВЛ — зондовое и/или парентеральное пита- ние.
Медикаментозная терапия
Лечение менингококковой инфекции зависит от клинической формы болезни. При назофарингите терапия симптоматическая. Если диагноз подтверждён бак- териологически, применяют бензилпенициллин, ампициллин, цефалоспорины I–II поколения, хлорамфеникол, пефлоксацин в средних терапевтических дозах в течение 3 сут. Не следует использовать ко-тримоксазол, аминогликозиды, к кото- рым большинство ныне существующих штаммов менингококка устойчивы. Больные или лица с предположительным диагнозом генерализованной формой менингококковой инфекции подлежат экстренной госпитализации в специализи- рованные отделения инфекционных стационаров. Препаратом выбора для лечения генерализованных форм менингококковой инфекции остаётся бензилпенициллин, к которому чувствительны почти все штаммы менингококка, встречающиеся на территории РФ. Пенициллин назна- чают в суточной дозе 200–300 тыс. ЕД/кг, разовые дозы вводят с интервалом 4 ч. При внутривенном введении суточную дозу повышают до 300–400 тыс. ЕД/кг. При позднем поступлении, менингоэнцефалите целесообразно повысить дозу до 400–500 тыс. ЕД/кг. Высокоэффективен цефтриаксон, обладающий выраженной антимикробной активностью и удовлетворительным пассажем через ГЭБ. Взрослым его назначают в дозе 4 г однократно, детям — 100 мг/кг, но не более 4 г/сут. Эффективен также цефотаксим в дозе 200 мг/кг (не более 12 г/сут). Применяют также хлорамфеникол в дозе 80–100 мг/кг в сутки в 2–3 приёма, фторхинолоны III поколения. Антибиотики проникают в субарахноидальное пространство только при наличии воспалительного процесса, поэтому в период лечения возможны ситуации, когда концентрация этих препаратов может сни- жаться ниже терапевтической и бактерицидного эффекта достичь не удаётся. В этом плане пенициллин имеет преимущество в связи с очень низкой токсично- стью, отсутствием нефротоксического и гепатотоксического действия, дозу можно увеличивать до 500 тыс. ЕД/кг и более. Длительность антимикробной терапии зависит от сроков санации СМЖ и составляет от 5 до 10 сут. Установлено, что при снижении цитоза ниже 100 в 1 мкл (а у детей в возрасте до года — ниже 50 в 1 мкл) и количестве нейтрофилов менее 30% при менингококковом менингите СМЖ стерильна. Дезинтоксикационную терапию неосложнённых генерализованных форм болезни проводят по общим правилам. В патогенетической терапии важное место занимают анальгетики и седативные препараты. При менингококковом менингите главное направление патогенетической тера- пии — дегидратация, цель которой — уменьшить отёк мозга и внутричерепную гипертензию путём мобилизации жидкости из субарахноидального пространства и вещества мозга. Наиболее эффективен фуросемид в суточной дозе 20–40 мг, мак- симально — 80 мг, детям — до 6 мг/кг. Интенсивную дегидратацию в режиме нор- моволемии проводят в первые 5–7 сут, затем используют более слабые диуретики, в частности ацетазоламид. Потери жидкости восполняют введением полиионных растворов. При развитии ИТШ на ранних этапах основными направлениями медикамен- тозной терапии становятся: ·дезинтоксикация (режим форсированного диуреза — до 6 л жидкости в сутки, детям — до 100 мл/кг). Применяют криоплазму, 5–10% рас- твор альбумина, декстран, полиионные растворы, глюкозо-калиевую смесь. Одновременно вводят фуросемид под контролем уровня гематокрита и ЦВД. Оптимален режим умеренной гемодилюции (гематокрит приблизительно составляет 35%); ·стабилизация гемодинамики, борьба с микроциркуляторными нарушения- ми (допамин в минимальных дозах, преднизолон — 3–5 мг/кг); ·борьба с гипоксией путём ингаляций кислорода через маску или назальные катетеры — до 6 л/мин; ·коррекция метаболического ацидоза и электролитных нарушений (по индивидуальным показаниям). При наличии артериальной гипотензии для стабилизации АД показано вве- дение норадреналина♠ в дозе 0,5–1 мкг/кг в минуту. В дальнейшем переходят на введение допамина или добутамина в индивидуальных дозах, необходимых для поддержания АД у нижних границ физиологической нормы. Обязательна коррекция декомпенсированного метаболического ацидоза с использовани- ем гидрокарбоната натрия и других буферных растворов. При недостаточной эффективности оксигенотерапии больных переводят на ИВЛ. При развитии ОПН проводят коррекцию объёмов вводимой жидкости и доз медикаментов, выво- димых почками. При прогрессировании ОНГМ назначают дексаметазон в дозе 0,15–0,25 мг/кг в сутки до восстановления сознания; проводят оксигенотерапию, а при нарастании дыхательных расстройств и развитии комы больных переводят на ИВЛ в режиме умеренной гипервентиляции (раСО2 >25 мм рт.ст.). При воз- буждении, а также судорогах назначают диазепам, оксибат натрия, пиридоксин, магния сульфат. Если судороги купировать не удаётся, используют тиопентал натрия или гексобарбитал. Проводят также коррекцию водно-электролитных и метаболических нарушений, при этом наиболее опасна гипернатриемия, кото- рую корригируют путём замены натрийсодержащих препаратов (оксибат натрия, бензилпенициллин и др.). Важное значение имеют уход, полноценное энтерально-парентеральное пита- ние, профилактика внутрибольничной инфекции и трофических нарушений.
Ликвородиагностика

Дата добавления: 2018-08-06; просмотров: 1151; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
