Лечение больных коклюшем определяется степенью тяжести болезни.
При легкой форме (у привитых, детей старшего возраста)
Антибактериальная терапия показана детям раннего возраста, а также с хроническими очагами инфекции. Препаратами выбора являются макролиды: эритромицин в возрастной дозировке, обычно per os 5–7 дней; азитромицин 10 мг/кг/сут за час до еды или через два часа после еды № 3–5.
В качестве патогенетической и симптоматической терапии показаны успокаивающие препараты: настой валерианы 5–10,0 мл 3–4 раза в сут. В зависимости от возраста; настойка валерианы, пустырника, пиона — капля на год жизни 3–4 раза в сут, 7–10 дней.
Хороший эффект от использования спазмолитических средств: микстура с экстрактом белладонны — 0,015, глюконатом кальция 5% — 100,0 по 5–15,0 мл 3 раза/сут, 7–10 дней.
Витамины А, С, Р в возрастных дозировках.
Десенсибилизирующая терапия показана при наличии аллергии.
При среднетяжелой форме
Определяющим при выборе антибактериальной терапии является наличие или отсутствие бактериальных осложнений. При неосложненном течении препаратами выбора остаются макролиды; при развитии пневмоний назначаются цефалоспорины III поколения, комбинации антибактериальных препаратов в зависимости от необходимости.
Назначение симптоматической и патогенетической терапии должно обеспечить выполнение следующих задач: улучшение мукоцилиарного клиренса, воздействие на кашель, уменьшение отека слизистой оболочки и гиперсекреции мокроты, противодействие бронхоконстрикции, улучшение отхождения мокроты.
|
|
|
Важное место занимают бронхомуколитические препараты, вводимые посредством небулайзера, что способствует более глубокому проникновению в бронхолегочную систему: Беродуал из расчета 1 капля на кг массы, Лазолван 0,5–2,0 мл в зависимости от возраста 2—4 раза в сут. Показаны также Бромгексин, Бронхикум, Стоптуссин, Синекод, Эуфиллин 2–4 мг/кг/прием и др. в возрастных дозировках.
При наличии очень тяжелого приступообразного кашля с целью уменьшения количества приступов и их продолжительности можно использовать нейроплегические средства: Пипольфен 2,5%, 0,5–1,0 мг/кг/сут в течение 5–7 дней, Седуксен 0,5% — 0,5–1,0 мг/кг/сут, как правило, перед ночным и дневным сном. Доза подбирается индивидуально: достаточная, если после введения препарата ребенок засыпает через 10–15 минут и дневной сон продолжается 2,5–3 часа, а ночной 6–8 часов.
Противокашлевые препараты не эффективны при коклюше, но иногда используются при мучительном сухом кашле: глауцина гидрохлорид 1 мг/год на прием 3 раза/сут, 7–10 дней; Левопронт, Стоптуссин в возрастных дозировках; препараты кодеина противопоказаны.
Наряду с аэротерапией, жизненно необходимой является оксигенотерапия, проводимая в кувезе или кислородной палатке (оптимальная концентрация кислорода во вдыхаемой смеси до 40%, при температуре 28–30 °C, относительная влажность — 80–90%) в течение 30–40 минут несколько раз в день.
|
|
|
Дополнительно к терапии, используемой у пациентов со среднетяжелыми формами, бывает оправдано применение гормонов. Их назначение обосновывается мембранозащитным эффектом, способствующим понижению проницаемости сосудов и уменьшению отечности мозга, снижению метаболических нарушений, связанных с гипоксией, а также с заместительной функцией в защите организма от функционального истощения надпочечников: преднизолон из расчета 2–5 мг/кг/сут, гидрокортизон — 5–10 мг/кг/сут, 3 раза, в/м, 3–5—7 дней. При необходимости назначается дегидратационная терапия: Лазикс (фуросемид) 1–3 мг/кг/сут коротким курсом. Детям с патологией ЦНС показаны препараты, улучшающие мозговое кровообращение (Трентал, Кавинтон).
Профилактика коклюша
Так как иммунитет к коклюшу не передается трансплацентарно, показана специфическая профилактика АКДС всем детям в возрасте от трех месяцев до трех лет. Курс вакцинации состоит из трех внутримышечных инъекций препарата (0,5 мл каждая) с интервалом 1,5 мес. Ревакцинацию АКДС-вакциной проводят однократно через 1–1,5 года после законченной 3-кратной вакцинации. Прививки АКДС-вакциной детям старше трех лет не проводят. Развернувшаяся в последние годы полемика о вреде вакцинации АКДС-вакциной значительно отразилась на прививочной работе. В настоящее время существует только три противопоказания для вакцинации данной вакциной:
|
|
|
1) тяжелая реакция на первую вакцинацию в виде повышения температуры выше 40,5 °C, пронзительный крик и неукротимый продолжительный плач в течение трех и более часов, анафилактическая реакция или отек Квинке;
2) прогрессирующие онкологические заболевания или прогрессирующие поражения ЦНС;
3) активный туберкулез.
При наличии побочных реакций или в качестве альтернативы могут использоваться бесклеточные вакцины Инфанрикс («Глаксо Смит Кляйн», Бельгия) или Пентаксим («Санофи Пастер», Франция). Сроки вакцинации и ревакцинации те же, возможно использование у детей старше трех лет.
Вакцины соответствуют требованиям ВОЗ в отношении производства субстанций биологического происхождения и вакцин против дифтерии, столбняка и коклюша, а у Пентаксима дополнительно к перечисленным — против полиомиелита и гемофильной инфекции [9].
|
|
|
Герпесвирусные инфекции
Герпесвирусные инфекции — группа широко распространённых антропонозных инфекционных болезней, вызываемых вирусами семейства Herpesviridae, которые характеризуются хроническим рецидивирующим течением и пожизненным перси- стированием возбудителя в организме.
ЭтиологияГерпесвирусы объединены в обширное семейство Herpesviridae, которое включает в себя более 100 представителей, из которых для человека патогенны 8 герпесвирусов — вирусы герпеса человека (human herpes virus — HHV). Герпесвирусы — филогенетически древнее семейство крупных ДНК-вирусов; их подразделяют на три подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ.
α-Герпесвирусы, включающие HHV-1, HHV-2 и вирус ветряной оспы (Varicella zoster virus), характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпесвирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в нервных ганглиях.
β-Герпесвирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму; в культуре клеток легко возникает персистентная инфекция. К этой группе относят ЦМВ, HHV-6, HHV-7.
γ-Герпесвирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и могут трансформиро- вать, вызывая лимфомы, саркомы. В эту группу входят ЭБВ и HHV-8–герпесвирус, ассоциированный с саркомой Капоши.
Все герпесвирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду (его сборка происходит в ядре инфицированной клетки), оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека. Вирионы герпесвирусов чрезвычайно термолабильны — инактивируются при температуре 50–52 °С в течение 30 мин, при температуре 37,5 °С — в течение 20 ч, устойчивы при температуре –70 °С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50% растворе глицерина. Уникальные биологические свойства всех герпесвирусов человека — это тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпесвирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создаёт постоянную угрозу развития инфекционного процесса. Латенция герпесвирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизменённой форме в нервных клетках регионарных (по отношению к месту внедрения герпесвируса) ганглиев чувствительных нервов. ЭпидемиологияИсточник герпесвирусов — больные острыми формами болезней (стоматит, генитальный герпес, ветряная оспа и др.) и здоровые лица, инфицированные соответствующим вирусом, которые периодически выделяют его в окружающую среду. В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путём, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т.п.). Доказаны также оральный, генитальный, орогенитальный, вертикальный, трансфузионный и трансплантационный пути передачи инфекции.
ПатогенезИнфицирование человека указанными герпесвирусами сопровождается клиническими симптомами соответствующей острой инфекции, в среднем, не более чем у 50% людей, в основном у детей: внезапная экзантема (HHV-6), афтозный стоматит (ВПГ типа 1 или 2), ветряная оспа (вирус ветряной оспы Varicella zoster virus), инфекционный мононуклеоз (ЭБВ), мононуклеозоподобный синдром (ЦМВ). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпесвируса, влияние на течение острых и рецидивирующих герпесви- русных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онтогенетические) особенности иммуннного ответа инфицированного человека на многочисленные антигены вируса. При снижении иммунореактивности организма герпесвирусы выступают в каче- стве вирусов-оппортунистов, приводя к более тяжёлому, с необычными клиниче- скими проявлениями течению основного заболевания. Вызываемые ВПГ, ЦМВ, ЭБВ заболевания рассматривают как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. Все известные герпесвирусные инфекции могут рецидивировать, однако порог и причины трансформации острой формы в рецидивирующую для каждого типа гер- песвируса свои. Клонирование герпесвирусов происходит по следующей схеме: спонтанная случайная адсорбция исходного «материнского» вируса на поверхности клетки- мишени, «раздевание вириона» — расщепление оболочки и капсида, инфильтрация вирусной ДНК в ядро клетки-мишени, формирование и созревание «дочерних» вирионов путём почкования на ядерной мембране. Все эти превращения идут под управлением ферментных систем вирусного происхождения. В процессе созревания «дочерних» вирионов их оболочки, капсиды и ДНК формируются из имеющихся внутри инфицированной клетки аминокислот, белков, липопротеидов и нуклеозидов. Эти молекулы поступают в инфицированную клетку из межтканевых пространств по мере истощения внутриклеточных резервов. Первая генерация «дочерних» герпесвирусов начинает поступать в окружающую среду (межклеточ- ные пространства, кровь, лимфу и другие биологические среды) примерно через 18 ч. В свободном состоянии герпесвирусы находятся в течение весьма непродолжительного периода (от 1 до 4 ч) — именно такова типичная продолжительность периода острой интоксикации при герпесвирусных инфекциях. Срок жизни каждой генерации образовавшихся и адсорбированных герпесвирусов в среднем составляет 3 сут.
Ветряная оспа
Ветряная оспа (Varicella) — острая вирусная антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя. Характерна полиморфная макуло папулёзно-везикулёзная сыпь и лихорадка.
ЭтиологияВозбудитель — вирус ветряной оспы Varicella zoster virus семейства Herpesviridae. Размер вируса от 150 до 200 нм, он находится в ветряночных пузырьках в первые 3–4 дня болезни; после 7-го дня обнаружить вирус не удаётся. Геном имеет двуспиральную линейную молекулу ДНК, липидную оболочку. Вирус репродуцируется только в ядре инфицированных клеток человека. Установлена идентичность вируса, вызывающего опоясывающий герпес, и вируса ветряной оспы. В окружающей среде вирус неустойчив и быстро погибает, в капельках слизи, слюны вирус сохраняется не более 10–15 мин. Нагревание, солнечные лучи, УФ-излучение быстро инактивируют его. ЭпидемиологияИсточник вируса — больной от последнего дня инкубационного периода до 5-го дня после появления последних высыпаний. Основной путь передачи — воздушно-капельный. Вирус способен распространяться на расстояния до 20 м (через коридоры в соседние комнаты квартиры и даже с одного этажа на другой). Возможен вертикальный механизм передачи вируса через плаценту. Восприимчивость к ветряной оспе очень высокая (минимум 90%), за исключением детей первых 3 мес жизни, у которых сохраняется пассивный иммунитет. Заболеваемость характеризуется выраженной сезонностью, достигая максимума в осенне-зимние месяцы. Болеют преимущественно дети. Постинфекционный иммунитет напряжённый, поддерживается персистенцией вируса в организме. При снижении его напряжённости возникает опоясывающий герпес.
Меры профилактикиБольных изолируют дома до 5-го дня со времени появления последнего све- жего элемента сыпи, обычно не госпитализируют. Дети до 3 лет, ранее не болев- шие, подлежат разобщению и наблюдению с 11 до 21-го дня с момента контакта. Контактным детям с отягощённым фоном рекомендовано введение иммуноглобу- лина. Вирус нестойкий, поэтому дезинфекцию не проводят. Изоляции подлежат больные опоясывающим герпесом. Описаны попытки применения активной иммунизации. Разработаны живые аттенуированные вакцины, которые, по наблюдениям их авторов, обеспечивают хороший эффект. Однако большинство специалистов считает проведение массовой вакцинации нецелесообразным.
ПатогенезВходные ворота вируса ветряной оспы — слизистые оболочки верхних дыхательных путей, где происходит репликация вируса, далее по лимфатическим путям возбудитель проникает в кровь. В конце инкубационного периода развивается виремия. Вирус фиксируется в клетках эктодермального происхождения, преимущественно в эпителиальных клетках кожи и слизистых оболочек дыхательных путей, ротоглотки. Возможно поражение межпозвоночных ганглиев, коры мозжечка и больших полушарий, подкорковых ганглиев. В редких случаях при гене- рализованной форме поражается печень, лёгкие, ЖКТ. В коже вирус вызывает формирование пузырьков, заполненных серозным содержимым, в котором вирус находится в высокой концентрации. При тяжёлых генерализованных формах болезни везикулы и поверхностные эрозии обнаруживают на слизистых оболочках ЖКТ, трахеи, мочевого пузыря и почечных лоханок, уретры, конъюнктивы глаз. В печени, почках, лёгких и ЦНС выявляют мелкие очаги некроза с кровоизлияниями по периферии. В патогенезе значительную роль отводят клеточному иммунитету, в основном системе Т-лимфоцитов, при угнетении которой наблюдают более тяжёлое течение болезни. После стихания острых проявлений первичной инфекции вирус пожизненно персистирует в спинальных нервных ганглиях.
Клиническая картинаИнкубационный период длится от 10 до 21 дня, при введении нормального иммуноглобулина человека может удлиняться до 28 дней. КлассификацияРазличают следующие клинические формы ветряной оспы. • По течению: G типичные; G атипичные: – рудиментарная; – геморрагическая; – гангренозная; – генерализованная. • По тяжести: G лёгкие; G среднетяжёлые; G тяжёлые: – с выраженной общей интоксикацией; – с выраженными изменениями на коже. Продромальные явления чаще отсутствуют, редко отмечают кратковременный субфебрилитет на фоне ухудшения общего самочувствия. Везикулы появляются обычно одновременно с повышением температуры или на несколько часов позднее. При обильной экзантеме температура может повышаться до 39 °С и выше. Высыпания появляются волнами на протяжении 2–4 дней и сопровождаются подъёмом температуры. Сыпь локализована на лице, волосистой части головы, туловище и конечностях. На ладонях и подошвах она встречается только при обильных высыпаниях. Элементы сыпи вначале имеют вид мелких макуло-папул, которые в течение нескольких часов превращаются в везикулы круглой или овальной формы, и размер 2–5 мм. Они располагаются поверхностно и на неинфильтрированном основании, стенка их напряжена, блестяща, содержимое прозрачно, но в некоторых везикулах мутнеет. Большинство везикул окружено узкой каймой гиперемии. Везикулы подсыхают через 2–3 дня, на их месте образуются корочки, которые отпадают через 2–3 нед. После отпадения корочек рубцов, как правило, не остаётся. Высыпания наблюдаются и на конъюнктиве, слизистых оболочках ротоглотки, иногда гортани, половых органов. Пузырьки на слизистых быстро превращаются в эрозии с желтовато-серым дном, которые через несколько дней эпителизируются. Высыпания на слизистой оболочке гортани и трахеи, сопровождаемые отёком слизистой оболочки, могут вызывать грубый кашель, охриплость голоса, в редких случаях явления крупа. Высыпания на слизистой оболочке половых губ представляют угрозу развития вульвовагинита. Высыпания часто сопровождаются увеличением лимфатических узлов. К концу первой недели болезни одновременно с подсыханием везикул нормализуется температура, улучшается самочувствие больного. В это время многих больных беспокоит кожный зуд. В гемограмме в период высыпания наблюдают небольшую лейкопению и относительный лимфоцитоз, СОЭ обычно не увеличена. Принято выделять типичную и атипичную ветряную оспу. К типичной относят случаи с характерной сыпью. Чаще всего типичная ветряная оспа протекает в лёгкой и среднетяжёлой форме. Тяжёлая форма болезни возникает редко, чаще у ослабленных детей и взрослых, для неё характерна длительная ремиттирующая лихорадка до 6–8 сут. Отмечают головную боль, возможна рвота, менингеальный синдром, нарушение сознания, артериальная гипотензия, судороги. Сыпь обильная, крупная, метаморфоз её замедлен, возможны элементы с пупковидным вдавлением в центре, напоминающие элементы сыпи при натуральной оспе. К атипичным формам относят рудиментарную, буллёзную, геморрагическую, гангренозную и генерализованную ветряные оспы. Рудиментарную форму чаще наблюдают у детей, получавших иммуноглобулины, плазму в период инкубации. Сыпь необильная, розеолёзно-папулёзная с единичными очень мелкими везикулами. Общее состояние не нарушается. Геморрагическая форма ветряной оспы встречается очень редко у резко ослабленных больных, страдающих гемабластозом или геморрагическими диатезами, на фоне приёма глюкокортикоидов и цитостатиков. На 2–3-й день высыпания содержимое пузырьков приобретает геморрагический характер. Появляются кровоизлияния в кожу и слизистые оболочки, носовые кровотечения и другие проявления геморрагического синдрома. Возможен летальный исход. Очень редко встречается гангренозная форма ветряной оспы. Она развивается у истощённых больных, при плохом уходе, создающем возможность возникновения вторичной инфекции. Вначале отдельные пузырьки принимают геморрагический характер, затем в окружении их возникает значительная воспалительная реакция. В последующем образуется геморрагический струп, после отпадения которого обнажаются глубокие язвы с грязным дном и крутыми или подрытыми краями. Язвы, вследствие прогрессирующего гангренозного распада ткани, увеличиваются, сливаются, принимая значительные размеры. Нередко возникают осложнения гнойно-септического характера. Общее состояние больного тяжёлое, течение болезни длительное. Генерализованная (висцеральная) форма. Встречается главным образом у новорождённых, иногда у взрослых с иммунодефицитом. Характерна гипертермия, интоксикация, поражение внутренних органов. Летальность высокая. На вскрытии обнаруживают мелкие очаги некроза в печени, лёгких, поджелудочной железе, надпочечниках, тимусе, селезёнке, костном мозге. Ветряная оспа представляет опасность для плода и новорождённого. Если заболевание у женщины возникло в конце беременности, возможны преждевременные роды и мертворождения. При заболевании ветряной оспой в ранние сроки беременности может произойти внутриутробное заражение плода с развитием у него различных пороков развития. Вероятность заболевания новорождённых составляет 17%, их гибели — 30%. Врождённая ветряная оспа протекает тяжело, сопровождаясь тяжёлыми висцеральными поражениями. ДиагностикаДиагностика ветряной оспы в типичных случаях не представляет затруднений. При необходимости и в диагностически неясных случаях используют вирусоскопический, вирусологический, серологический и молекулярно-биологический методы. Вирусоскопический метод заключается в окрашивании содержимого пузырька серебрением (по М.А. Морозову) для выявления вируса с помощью обычного светового микроскопа. Вирусологический метод практически не испольуют. Из серологических методов применяют РСК, РИМФ, ИФА. Основной метод лабораторной диагностики — молекулярно-биологический метод (ПЦР).
ЛечениеМедикаментозная терапия У больных с нормальным иммунитетом ветряная оспа требует только про- филактики осложнений. Тщательный уход за кожей помогает избежать бактериальной суперинфекции. В качестве этиотропной терапии подросткам и взрослым рекомендуют с первых суток заболевания назначать ацикловир (800 мг внутрь 5 раз в сутки в течение 5–7 дней). У детей младше 12 лет ацикловир (20 мг/кг внутрь 4 раза в сутки) тоже эффективен, если противовирусная терапия начата в первые 24 ч заболевания. Больным с ослабленным иммунитетом при ветряной оспе ацикловир вводят внутривенно в дозе 10–12,5 мг/кг каждые 8 ч в течение 7 дней. При развитии ветряночной пневмонии показаны ингаляции интерферона лейкоцитарного человеческого (лейкинферон♠). Местно используют 5–10% раствор калия перманганата или 1% спиртовой раствор бриллиантового зелёного с целью предотвращения присоединения вторичной инфекции и более быстрого подсыхания пузырьков. Для уменьшения зуда кожу смазывают глицеролом или обтирают водой с уксусом или спиртом. Назначают антигистаминные препараты (клемастин, дифенгидрамин, цетиризин, акривастин). При геморрагических формах показаны викасол♠, рутин♠, кальция хлорид. Из физиотерапевтических процедур используют УФ-облучение в течение 2–3 дней для ускорения отпадения корочек. Примерные сроки нетрудоспособности 10 дней.
Инфекционный мононуклеоз
Инфекционный мононуклеоз (синонимы: Эпстайна–Барр инфекционный мононуклеоз, болезнь Филатова, железистая лихорадка, моноцитарная ангина, болезнь Пфейффера; англ. infectious mononucleosis; нем. infectiose mononukleos). Антропонозная инфекционная болезнь, вызываемая ЭБВ с аэрозольным механизмом передачи. Характеризуется циклическим течением, лихорадкой, острым тонзиллитом, фарингитом, выраженным поражением лимфоидной ткани, гепатоспленомегалией, лимфомоноцитозом, появлением в крови атипичных мононуклеаров.
ЭтиологияВозбудитель ЭБВ относят к группе вирусов герпеса (семейство Herpesviridae, подсемейство Gammaherpesvirinae, род Lymphocryptovirus.), вирус герпеса человека типа 4. Содержит ДНК, имеющую форму двойной спирали, в которой закодировано более 30 полипептидов. Вирион состоит из капсида диаметром 120–150 нм, окружённого оболочкой, содержащей липиды. Капсид вириона имеет форму икосаэдра. ЭБВ обладает тропизмом к В-лимфоцитам из-за наличия на их поверхности рецепторов для этого вируса. Вирус может длительное время персистировать в клетках хозяина в латентной форме. Имеет антигенные компоненты, общие с другими вирусами группы герпеса. Антигенно однороден, содержит следующие специфические антигены: вирусный капсидный антиген, ядерный антиген, ранний антиген и мембранный антиген. Антигены вируса индуцируют продукцию антител — маркёров ЭБВ-инфекции. Устойчивость в окружающей среде низкая. Вирус быстро погибает при высыхании, под действием высоких температур (кипячение, автоклавирование), обработке всеми дезинфицирующими средствами. В отличие от других герпетических вирусов ЭБВ вызывает не гибель, а пролиферацию поражённых клеток, потому его относят к онкогенным вирусам, в частности, его считают этиологическим фактором саркомы Беркитта, назофарингеальной карциномы, В-клеточных лимфом, некоторых иммунодефицитов, волосистой лейкоплакии языка, при ВИЧ-инфекции. ЭБВ после первичного инфицирования персистирует в организме пожизненно, интегрируясь в геном поражённых клеток. При нарушениях в иммунной системе и воздействии других факторов возможна реактивация вируса.
ЭпидемиологияАнтропоноз; источник возбудителя инфекции — больной человек, в том числе со стёртой формой болезни, и вирусоноситель. Основной путь передачи — воздушно-капельный. Заражение также возможно путём прямого контакта (при поцелуях, половым путём) и непрямого контакта через предметы обихода, игрушки, контаминированные слюной, содержащей вирус. Латентная инфекция в В-лимфоцитах периферической крови доноров создаёт опасность заражения при гемотрансфузиях. Иммунитет у перенёсших инфекционный мононуклеоз пожизненный, нестерильный, повторные заболевания не наблюдаются, но возможны различные проявления ЭБВ-инфекции, обусловленные реактивацией вируса.
ПатогенезПри попадании ЭБВ со слюной воротами инфекции и местом его репликации служит ротоглотка. Инфекцию поддерживают В-лимфоциты, имеющие поверхностные рецепторы для вируса, их считают основной мишенью вируса. Репликация вируса происходит также в эпителии слизистой оболочки ротоглотки и носоглотки, протоков слюнных желёз. Во время острой фазы болезни специфические вирусные антигены обнаруживают в ядрах более 20% циркулирующих В-лимфоцитов. После стихания инфекционного процесса вирусы можно обнаружить лишь в единичных В-лимфоцитах и эпителиальных клетках носоглотки. Инфицированные вирусом В-лимфоциты под влиянием мутагенов вируса начинают интенсивно пролиферировать, трансформируясь в плазматические клетки. В результате поликлональной стимуляции В-системы в крови возрастает уровень иммуноглобулинов, в частности, появляются гетерогемагглютинины, способные агглютинировать чужеродные эритроциты (барана, лошади), что используют для диагностики. Пролиферация В-лимфоцитов также приводит к активации Т-супрессоров и естественных киллеров. Т-супрессоры подавляют пролиферацию В-лимфоцитов. В крови появляются их молодые формы, которые морфологически характеризуют как атипичные мононуклеары (клетки с крупным, как у лимфоцита, ядром и широкой базофильной цитоплазмой). Т-киллеры разрушают инфицированные В-лимфоциты путём антителозависимого цитолиза. Активация Т-супрессоров приводит к снижению иммуно-регуляторного индекса ниже 1,0, что способствует присоединению бактериальной инфекции. Активация лимфатической системы проявляется увеличением лимфатических узлов, миндалин, других лимфоидных образований глотки, селезёнки и печени. Гистологически выявляют пролиферацию лимфоидных и ретикулярных элементов, в печени — перипортальную лимфоидную инфильтрацию. В тяжёлых случаях возможны некрозы в лимфоидных органах, появление лимфоидных инфильтратов в лёгких, почках, ЦНС и других органах.
Клиническая картина Инфекционный мононуклеоз имеет цикличное течение. Инкубационный период, по различным данным, варьирует от 4 до 50 дней. КлассификацияВыделяют типичные и атипичные формы болезни, по тяжести — лёгкие, средней тяжести и тяжёлые формы болезни. В настоящее время описана хроническая форма инфекционного мононуклеоза. Выделяют начальный период болезни, период разгара и период реконвалесценции. В большинстве случаев болезнь начинается остро, с повышения температуры тела, появления болей в горле и увеличения лимфатических узлов. При постепенном начале болезненность и увеличение лимфатических узлов предшествуют повышению температуры на несколько дней, затем появляются боли в горле и лихорадка. В любом случае к концу недели начальный период болезни завершается и выявляют весь симптомокомплекс болезни. Для периода разгара болезни характерны: G лихорадка; G полиаденопатия; G поражение рото- и носоглотки; G гепатолиенальный синдром; G гематологический синдром. Лихорадочная реакция многообразна как по уровню, так и по длительности лихорадки. В начале болезни температура чаще субфебрильная, в разгаре может достигать 38,5–40,0 °С в течение нескольких дней, затем снижается до субфебрильного уровня. В некоторых случаях субфебрилитет отмечают на протяжении всей болезни, в редких случаях лихорадка отсутствует. Длительность лихорадки от 3–4 сут до 3–4 нед, иногда больше. При длительной лихорадке выявляют её однообразное течение. Особенность инфекционного мононуклеоза — слабая выраженность и своеобразие интоксикационного синдрома. Больные обычно сохраняют подвижность, аппетит снижен, доминирует миастения, утомляемость, в тяжёлых случаях больные из-за миастении не могут стоять, с трудом сидят. Интоксикация сохраняется несколько дней. Полиаденопатия — постоянный симптом. Чаще всего увеличиваются латеральные шейные лимфатические узлы, часто они видны на глаз, размеры их варьируют от фасолины до куриного яйца. В некоторых случаях появляется отёк клетчатки вокруг увеличенных лимфатических узлов, изменяются контуры шеи (симптом «бычьей шеи»). Кожа над лимфатическими узлами не изменена, при пальпации они чувствительные, плотноэластической консистенции, не спаяны между собой и с окружающими тканями. Увеличиваются также и другие группы узлов: затылочные, подчелюстные, кубитальные. В некоторых случаях доминирует увеличение пахово-бедренной группы. При этом отмечают боли в крестце, пояснице, резкую слабость, изменения в ротоглотке выражены слабо. Полиаденопатия регрессирует медленно и, в зависимости от тяжести течения болезни, сохраняется от 3–4 нед до 2–3 мес или принимает персистирующий характер. Также постоянным симптомом считают увеличение и отёчность нёбных миндалин, которые иногда смыкаются между собой, затрудняя ротовое дыхание. Одновременное увеличение носоглоточной миндалины и отёчность слизистой оболочки нижней носовой раковины затрудняют носовое дыхание. При этом появляется пастозность лица, гнусавость голоса. Больной дышит открытым ртом. Возможно развитие асфиксии. Задняя стенка глотки также отёчна, гиперемирована, с гиперплазией боковых столбов и лимфоидных фолликулов задней стенки глотки (гранулематозный фарингит). Увеличение печени и селезёнки — почти постоянный симптом, особенно у детей. Печень увеличивается с первых дней болезни, минимально в её разгаре. Она чувствительна при пальпации, плотноватая, спленомегалия сохраняется до 1 мес. Часто выявляют умеренное повышение активности АЛТ и АСТ, реже — потемнение мочи, лёгкую желтуху и гипербилирубинемию. В этих случаях отмечают тошноту, снижение аппетита. Длительность желтухи не превышает 3–7 сут, течение гепатита доброкачественное. Селезёнка увеличивается на 3–5-е сутки болезни, максимально ко 2-й неделе болезни и перестаёт быть доступной для пальпации к концу 3-й недели болезни. Она становится мало чувствительной при пальпации. В отдельных случаях сплено- мегалия резко выражена (край определяется на уровне пупка). В этом случае есть угроза её разрыва. Картина крови имеет решающее диагностическое значение. Характерен умеренный лейкоцитоз (12–25×109/л). Лимфомоноцитоз до 80–90%, нейтропения со сдвигом влево. Часто обнаруживают плазматические клетки. СОЭ увеличивается до 20–30 мм/ч. Особенно характерно появление атипичных мононуклеаров с первых дней болезни или в её разгаре. Количество их варьирует от 10 до 50%, как правило, они обнаруживаются в течение 10–20 сут, т.е. могут быть выявлены в двух анализах, взятых с интервалом 5–7 сут. Из других симптомов болезни следует отметить сыпь, обычно папулёзную. Она наблюдается у 10% больных, а при лечении ампициллином — у 80%. Из атипичных форм описывают стёртую форму, при которой отсутствует часть основных симптомов и для подтверждения диагноза необходимы серологические тесты. В редких случаях наблюдают висцеральную форму болезни с тяжёлыми поли- органными поражениями и неблагоприятным прогнозом. Описана хроническая форма болезни, которая развивается после перенесённого острого инфекционного мононуклеоза. Она характеризуется слабостью, утомляемостью, плохим сном, головными болями, миалгией, субфебрилитетом, фарин- гитом, полиаденопатией, экзантемой. Постановка диагноза возможна только при использовании убедительных лабораторных тестов.
ДиагностикаДиагностика основывается на комплексе ведущих клинических симптомов (лихорадка, лимфаденопатия, увеличение печени и селезёнки, изменения периферической крови). Наиболее специфичны и чувствительны методы, основанные на определении антительных маркёров антигенов ЭБВ (НРИФ, ИФА), которые позволяют определить форму инфекции. Антитела (IgM) к капсидному антигену при инфекционном мононуклеозе обнаруживаются с конца инкубационного периода, они определяются не более 2–3 мес. IgI к капсидному антигену появляются в остром периоде инфекции и сохраняются пожизненно. Антитела к ранним антигенам (IgM) появляются в разгаре болезни у 70–80% больных и быстро исчезают, а антитела к IgI сохраняются длительно. Повышение титра антител к ранним антигенам характерно для реактивации ЭБВ-инфекции и для опухолей, обусловленных этим вирусом. Антитела против ядерного антигена появляются через 6 мес после инфицирования и сохраняются в невысоких титрах пожизненно. Дополнительным подтверждением ЭБВ-инфекции может служить тест по выявлению ДНК вируса в крови или слюне методом ПЦР. Его применение эффективно для обнаружения ЭБВ-инфекции у новорождённых, когда определение серологических маркёров малоэффективно вследствие несформировавшейся иммунной системы, а также в сложных и сомнительных случаях при диагностике ЭБВ у взрослых.
ЛечениеРежим. Диета Режим полупостельный. Стол № 5. Лечение инфекционного мононуклеоза чаще всего проводят в амбулаторных условиях. Рекомендуют обильное питьё, полоскание ротоглотки растворами антисептиков, НПВС, симптоматическая терапия. Медикаментозная терапия In vitro ацикловир и интерферон альфа подавляют репликацию ЭБВ, однако их клиническая эффективность не доказана. При выраженных некротических изме- нениях на миндалинах назначают антибактериальные препараты (фторхинолоны, макролиды). Ампициллин противопоказан из-за возникновения у 80% больных сыпи. Глюкокортикоидные препараты могут существенно сократить длительность лихорадки и воспалительных изменений в ротоглотке, однако их рекомендуют назначать лишь при тяжёлых формах, при обтурации дыхательных путей, при гемолитической анемии и неврологических осложнениях.
Стрептококковые инфекции
Стрептококковые инфекции — группа инфекционных болезней, вызываемых стрептококками различных серологических групп, с воздушно-капельным и алиментарным путём передачи возбудителя, протекающих с лихорадкой, интоксика- цией, местными нагноительными процессами и развитием постстрептококковых аутоиммунных (ревматизм, гломерулонефрит) осложнений.
ЭтиологияВозбудители — неподвижные факультативно-анаэробные грамположительные кокки рода Streptococcus семейства Streptococcaceae. Род включает в себя 38 видов, различающихся особенностями метаболизма, культурально-биохимическими свойствами и антигенной структурой. Деление клеток происходит только в одной плоскости, поэтому они расположены парами (диплококки) или образуют цепочки разной длины. Некоторые виды имеют капсулу. Возбудители способны к росту при температуре 25–45 °С; температурный оптимум — 35–37 °С. На плотных питательных средах образуют колонии диаметром 1–2 мм. На средах с кровью колонии некоторых видов окружены зоной гемолиза. Облигатный признак, характеризующий всех представителей рода стрептококков, — отрицательные бензидиновый и каталазный тесты. Стрептококки устойчивы в окружающей среде; в течение многих месяцев они способны сохраняться в высохшем гное или мокроте. Возбудители выдерживают нагревание до 60 °С в течение 30 мин; под действием дезинфицирующих веществ погибают в течение 15 мин. По структуре группоспецифических полисахаридных антигенов (субстанция С) клеточной стенки выделяют 17 серологических групп стрептококков, обозначаемых латинскими буквами (А–О). Внутри групп стрептококки разделяют на серологические варианты по специфичности белковых М-, Р-, и Т-антигенов. Стрептококки группы А имеют широкий спектр суперантигенов: эритрогенные токсиныА, В и С, экзотоксин F (митогенный фактор), стрептококковый суперантиген (SSA), эритрогенные токсины(SpeX, SpeG, SpeH, SpeJ, SpeZ, SmeZ-2). Суперантигены способны к взаимодействию с антигенами главного комплекса гистосовместимости, экспрессированными на поверхности антигенпрезентирую- щих клеток, и с вариабельными участками β-цепи Т-лимфоцитов, вызывая их пролиферацию и мощный выброс цитокинов, ФНО-α и γ-интерферона. Кроме того, стрептококк группы А способен продуцировать биологически активные экс- трацеллюлярные вещества: стрептолизины О и S, стрептокиназу, гиалуронидазу, ДНКазу В, стрептодорназу, липопротеиназу, пептидазу и др. Клеточная стенка стрептококка включает капсулу, белковый, полисахаридный (группоспецифический антиген) и мукопротеидный слой. Важный компонент стрептококков группы А — белок М, напоминающий по структуре фимбрии грамотрицательных бактерий. Белок М (типоспецифический антиген) — основной фактор вирулентности. Белок М ингибирует фагоцитарные реакции, непосредственно действуя на фагоциты, маскируя рецепторы для компонентов комплемента и опсонинов и адсорбируя на своей поверхности фибриноген, фибрин и продукты его деградации. Свойствами типоспецифических антигенов обладают также Т-белок клеточной стенки и липопротеиназа(фермент, гидролизующий липидсодержащие компоненты крови млекопитающих). Стрептококки разных М-вариантовмогут иметь один и тот же Т-тип или комплекс Т-типов. Распределение серотипов липопротеиназы точно соответствует определённым М-типам, но этот фермент продуцируют около 40% штаммов стрептококка. Антитела к Т-белку и липопротеиназе протективны- ми свойствами не обладают. Капсула содержит гиалуроновую кислоту — один из факторов вирулентности. Она защищает бактерии от антимикробного потенциала фагоцитов и облегчает адгезию к эпителию. Бактерии способны самостоятельно разрушать капсулу при инвазии в ткани, синтезируя гиалуронидазу. Третьим по значимости фактором патогенности является С5а-пептидаза, подавляющая активность фагоцитов. Фермент расщепляет и инактивирует С5а-компонент комплемента, выступающий мощным хемоаттрактантом. Стрептококки группы А продуцируют различные токсины. Стрептококки группы В обычно колонизируют носоглотку, ЖКТ и влагалище. Выделяют следующие серологические варианты стрептококков группы В: Ia, Ib, Ic, II и III. Бактерии сероваров Ia и III тропны к тканям ЦНС и дыхательных путей; часто вызывают менингиты у новорождённых. Среди прочих видов важное диагностическое значение имеют пневмококки (S. pneumoniae), вызывающие большинство внебольничных пневмоний у человека. Они не содержат группового антигена и серологически неоднородны. По структуре капсульных антигенов выделяют 84 серологических варианта пневмококков.
ЭпидемиологияРезервуар и источник инфекции — больные с различными клиническими формами острых стрептококковых заболеваний и носители патогенных стрептококков. Наибольшую опасность с эпидемиологической точки зрения представляют больные, у которых очаги локализуются в верхних дыхательных путях (скарлатина, ангина). Механизм передачи инфекции — аэрозольный (воздушно-капельный), реже — контактный (пищевой путь и передача через загрязнённые руки и предметы обихода). Заражение обычно происходит при тесном длительном общении с больным или носителем. Возбудитель выделяется в окружающую среду чаще всего при экспираторных актах (кашель, чиханье, активный разговор). Заражение происходит при вдыхании образующегося воздушно-капельного аэрозоля. Скученность людей в помещениях и длительное тесное общение усугубляют вероятность заражения. При этом следует учитывать, что на расстоянии более 3 м этот путь передачи практически невозможен. ПатогенезЧаще всего заболевания возникают после попадания стрептококков на слизистые оболочки зева и носоглотки. Липотейхоевая кислота, входящая в состав клеточной стенки, М- и F-белки обеспечивают адгезию возбудителя к поверхности миндалин или другим лимфоидным клеткам. Белок М способствует устойчивости бактерий к антимикробному потенциалу фагоцитов, связывает фибриноген, фибрин и продукты его деградации. При размножении стрептококков выделяются токсины, вызывающие воспалительную реакцию тканей миндалин. При попадании стрептококков по лимфатическим путям в лимфатические узлы возникает регионарный (углочелюстной) лимфаденит. Токсичные компоненты, проникая в кровь, обусловливают генерализованное расширение мелких сосудов (клинически — гиперемия и точечная сыпь). Аллергический компонент, нарушающий проницаемость сосудов, считают причиной развития гломерулонефрита, артритов, эндокардитов и др. Септический компонент приводит к накоплению возбудителя в различных органах и системах и развитию очагов гнойного воспаления. Наличие общих перекрёстно реагирующих антигенных детерминант у стрептококков груп- пы А (белок М, нетипоспецифические белки, А-полисахарид и др.) и сарколеммы миофибрилл сердца и тканей почек определяет развитие аутоиммунных процессов, приводящих к ревматизму и гломерулонефриту. Молекулярная мимикрия — основной патогенетический фактор стрептококковой инфекции при этих заболеваниях: антитела к антигенам стрептококков реагируют с аутоантигенами хозяина. С другой стороны, белок М и эритрогенный токсин проявляют свойства суперантигенов и вызывают пролиферацию Т-клеток, активируя каскадную реакцию эффекторного звена иммунной системы и выброс медиаторов с цитотоксическими свойствами: ИЛ, ФНО-α, интерферона-гамма. Инфильтрация лимфоцитов и локальное действие цитокинов играют важную роль в патогенезе инвазивных стрептококковых инфекций (при целлюлитах, некротических фасцитах, поражениях кожи, внутренних органов). Важную роль в патогенезе инвазивной стрептококовой инфекции отводят ФНО-α, ЛПС собственной грамотрицательной микрофлоры и его синергическому взаимодействию с эритрогенным токсином S. pyogenes.
Скарлатина
Скарлатина (лат. scarlatina) — острая антропонозная инфекция с аэрозольным механизмом передачи возбудителя, которой свойственны острое начало, лихорадка, интоксикация, тонзиллит и мелкоточечная сыпь.
ЭтиологияВозбудитель — β-гемолитический стрептококк группы А (S. pyogenes).
ЭпидемиологияРезервуар и источник инфекции — больной ангиной, скарлатиной и другими клиническими формами респираторной стрептококковой инфекции, а также здоровые носители стрептококков группы А. Больной наиболее опасен для окружающих до 3-й нед болезни. Носительство стрептококков группы А широко распространено в популяции (15–20% здорового населения); многие из носителей выделяют возбудитель на протяжении длительного времени (месяцы и годы). Механизмы передачи — аэрозольный (воздушно-капельный путь) и контактный (пищевой и контактно-бытовой). Заражение происходит при тесном длительном общении с больным или носителем. Постинфекционный иммунитет типоспецифический; при инфицировании стрептококками А другого серовара возможно повторное заболевание. Заболевание распространено повсеместно, но чаще его встречают в регионах с умеренным и холодным климатом.Заболеваемость скарлатиной имеет выраженную осенне-зимне-весеннюю сезонность.
Меры профилактикиМероприятия в эпидемическом очаге. При скарлатине обязательной госпитализации подлежат больные: с тяжёлыми и среднетяжёлыми формами инфекции;из детских учреждений с круглосуточным пребыванием детей (дома ребёнка, детские дома, школы-интернаты, санатории и др.); из семей, где есть дети в возрасте до 10 лет, не болевшие скарлатиной; из семей, где есть лица, работающие в детских дошкольных учреждениях, хирургических и родильных отделениях, детских больницах и поликлиниках, молочных кухнях, при невозможности их изоляции от заболевшего; при невозможности надлежащего ухода на дому. Выписку больного скарлатиной из стационара осуществляют после клинического выздоровления, но не ранее чем через 10 дней после начала заболевания. При регистрации заболеваний скарлатиной в детском дошкольном учреждении на группу, где обнаружен больной, накладывают карантин сроком на 7 дней с момента изоляции последнего больного скарлатиной. В группе обязательно проводят термометрию, осмотр зева и кожных покровов детей и персонала. При обна- ружении у кого-либо из детей повышенной температуры или симптомов острого заболевания верхних дыхательных путей рекомендуется их немедленная изоляция от окружающих. Всех лиц, контактировавших с больными и имеющих хронические воспалительные заболевания носоглотки, подвергают санации томицидом в течение 5 сут (полоскание или орошение зева четыре раза в день до еды). В помещении, где присутствует больной, проводят регулярную текущую дезинфекцию 0,5% раствором хлорамина; посуду и бельё регулярно кипятят. Заключительную дезинфекцию не проводят. Детей, посещающих дошкольные коллективы и первые два класса школы, не болевших скарлатиной и контактировавших с больным на дому, не допускают в детское учреждение в течение 7 сут с момента последнего общения с больным. При обнаружении ОРЗ (ангина, фарингит и др.) детей осматривают на наличие сыпи и отстраняют от занятий (с оповещением участкового врача). В детские учреждения их допускают после того, как они выздоровеют и предоставят справку о проведённом лечении антибиотиками. Лиц декретированных профессий, контактировавших с больным, к работе допускают, но за ними устанавливают медицинское наблюдение в течение 7 сут, чтобы своевременно выявить скарлатину или ангину.
ПатогенезВозбудитель проникает в организм человека через слизистую оболочку зева и носоглотки; в редких случаях возможно заражение через слизистую оболочку половых органов или повреждённую кожу (экстрабуккальная скарлатина). В месте адгезии бактерий формируется воспалительно-некротический очаг. Развитие инфекционно-токсического синдрома обусловлено поступлением в кровоток эритрогенного токсина (токсина Дика), а также действием пептидогликана клеточной стенки стрептококков. Вследствие токсинемии происходит генерализованное расширение мелких сосудов во всех органах, в том числе в кожных покровах и слизистых оболочках, и возникает характерная сыпь. В результате выработки, накопления антитоксических антител при развитии инфекционного процесса и связывания ими токсинов ослабевают симптомы интоксикации и постепенно исчезает сыпь. Одновременно возникают умеренные признаки периваскулярной инфильтрации и отёка дермы. Эпидермис пропитывается экссудатом, и клетки эпидермиса ороговевают, что приводит к шелушению кожи после угасания скарлатинозной сыпи. Крупнопластинчатый характер шелушения в толстых слоях эпидермиса на ладонях и подошвах можно объяснить сохранением прочной связи между ороговевшими клетками в этих местах. Компоненты клеточной стенки стрептококка (групповой А-полисахарид, пептидогликан, белок М) и внеклеточные продукты (стрептолизины, гиалуронидаза, ДНКаза и др.) обусловливают развитие реакций ГЗТ, аутоиммунных реакций, формирование и фиксацию иммунных комплексов, нарушения системы гемостаза. Во многих случаях их можно считать причиной развития миокардита, гломерулонефрита, артериитов, эндокардита и других осложнений иммунопатологического характера. Из лимфатических образований слизистой оболочки ротоглотки возбудители по лимфатическим сосудам попадают в регионарные лимфатические узлы, где происходит их накопление, сопровождающееся воспалительными реакциями с очагами некроза и лейкоцитарной инфильтрации. Последующая бактериемия может вызвать попадание микроорганизмов в различные органы и системы и формирование гнойно-некротических процессов в них (гнойный лимфаденит, отит, поражения костной ткани височной области, твёрдой мозговой оболочки, височных синусов и др.). Клиническая картинаИнкубационный период 1–10 (чаще 2–4) сут.
Скарлатину классифицируют по типу и тяжести течения. Типичной считают скарлатину, протекающую с лихорадочно-интоксикационным синдромом, ангиной и сыпью. К атипичной относят стёртые, экстрафарингеальные (ожоговая, раневая, послеродовая), а также самые тяжёлые формы — геморрагическую и гипертоксическую. По тяжести выделяют лёгкую, среднетяжёлую и тяжёлую формы. Типичным считают острое начало. В некоторых случаях уже в первые часы болезни температура повышается до высоких цифр, возникают озноб, слабость, недомогание, головная боль, тахи- кардия, иногда — боли в животе и рвота. При высокой лихорадке в первые дни заболевания больные возбуждены, эйфоричны, подвижны или, наоборот, вялы, апатичны, сонливы. Следует подчеркнуть, что при современном течении скарлати- ны температура тела может быть невысокой. Уже с самого начала больные предъявляют жалобы на боль в горле при глотании. При осмотре — яркая разлитая гиперемия миндалин, дужек, язычка, мягкого нёба и задней стенки глотки («пылающий зев»). Гиперемия выражена сильнее, чем при обычной катаральной ангине, и резко ограничена в месте перехода слизистой оболочки на твёрдое нёбо. Возможно развитие фолликулярной или лакунарной ангины: на увеличенных, резко гиперемированных и разрыхлённых миндалинах возникают слизисто-гнойные, фибринозные или некротические налёты в виде отдельных мелких или, реже, глубоких и распространённых очагов. Одновременно развивается регионарный лимфаденит: переднешейные лимфатические узлы при пальпации плотные и болезненные. Язык обложен серовато-белым налётом, а к 4–5-м суткам болезни очищается, приобретает ярко-красную окраску с малиновым оттенком («малиновый» язык); сосочки языка гипертрофированы. В тяжёлых случаях скарлатины подобную «малиновую» окраску отмечают и на губах. К этому времени симптомы ангины начинают регрессировать, но некротические налёты исчезают гораздо медленнее. Со стороны сердечно-сосудистой системы определяют тахикардию на фоне умеренного повышения АД. Скарлатинозная экзантема на фоне гиперемии кожного покрова возникает в 1–2-е сутки болезни. Сыпь— важный диагностический признак заболевания. Вначале мелкоточечные элементы возникают на коже лица, шеи и верхней части туловища, затем сыпь быстро переходит на сгибательные поверхности конечностей, боковые стороны груди и живота, внутренние поверхности бёдер. Важный признак скарлатины — сгущение сыпи в виде тёмно-красных полос в местах естественных сгибов, например в локтевых, паховых (симптом Пастиа), подмышечных областях. На лице сыпь расположена на ярких гиперемированных щеках, в меньшей степени — на лбу и висках, в то время как носогубный треугольник свободен от элементов сыпи и бледен (симптом Филатова). При надавливании на кожу ладони сыпь в этом месте временно исчезает (симптом ладони ). Сыпь может возникать поздно, лишь на 3–4-й день болезни, или отсутствовать. К 3–5-м суткам самочувствие больного улучшается, температура начинает постепенно снижаться, сыпь бледнеет, постепенно исчезает и к концу 1–2-й недели сменяется мелкочешуйчатым (на ладонях и подошвах — крупнопластинчатым) шелушением кожи. Интенсивность экзантемы и сроки её исчезновения различны. Иногда при лёгком течении скарлатины скудная сыпь исчезает через несколько часов после возникновения. Выраженность и длительность шелушения кожи прямо пропорциональны обилию предшествующей сыпи. Токсико-септическую форму относят к типичным формам скарлатины. У взрослых больных её обнаруживают редко. Характерны бурное начало с гипертермией, быстрое развитие сосудистой недостаточности (глухие тоны сердца, падение АД, нитевидный пульс, холодные конечности), геморрагии на коже. В последующие дни возникают осложнения инфекционно-аллергического (поражения сердца, суставов, почек) или септического (лимфадениты, некротическая ангина, отиты и др.) типа. Экстрафарингеальная (экстрабуккальная) скарлатина. Ворота инфекции — места поражения кожи (ожоги, ранения, родовые пути, очаги стрепто- дермии и др.). Сыпь имеет тенденцию к распространению от места внедрения возбудителя. При этой редкой форме заболевания воспалительные изменения со стороны ротоглотки и шейных лимфатических узлов отсутствуют. Лимфаденит возникает вблизи входных ворот инфекции. Стёртые формы скарлатины. Часто обнаруживают у взрослых. Характерны слабая интоксикация, катаральное воспаление в ротоглотке, скудная, бледная, быстро исчезающая сыпь. У взрослых возможно тяжёлое течение заболевания —токсико-септическая форма.
Лечение проводят на дому, исключая тяжёлые и осложнённые случаи. Больному необходимо соблюдать постельный режим в течение 7 сут. Препарат выбора — бензилпенициллин в дозе 15–20 тыс ЕД/кг в сутки (5–7 сут). Альтернативные пре- параты — макролиды (эритромицин по 250 мг четыре раза в сутки или по 500 мг два раза в сутки) и цефалоспорины I поколения (цефазолин по 50 мг/кг в сутки). Курс лечения 5–7 сут. При наличии противопоказаний к этим препаратам при- меняют полусинтетические пенициллины, линкозамиды. В домашних условиях следует отдавать предпочтение таблетированным препаратам (феноксиметилпе- нициллин, эритромицин). Назначают полоскания горла раствором фурацилина 1:5000, настоями ромашки, календулы, эвкалипта. Показаны витамины и антиги- стаминные средства в обычных терапевтических дозах. Симптоматические сред- ства применяют по показаниям.
Рожа
Рожа (англ. еrysipelas) — инфекционная болезнь человека, вызываемая β-гемолитическим стрептококком группы А и протекающая в острой (первичной) или хронической (рецидивирующей) форме с выраженными симптомами интоксикации и очагового серозного или серозно-геморрагического воспаления кожи (сли- зистых оболочек). ЭтиологияВозбудитель — β-гемолитический стрептококк группы А (Streptococcus pyogenes). β-гемолитический стрептококк группы А — факультативный анаэроб, устойчивый к воздействию факторов внешней среды, но чувствительный к нагреванию до 56 °C в течение 30 мин, к воздействию основных дезинфекционных средств и антибиотиков. Особенности штаммов β-гемолитического стрептококка группы А, вызывающих рожу, в настоящее время изучены не полностью.
ЭпидемиологияИсточником возбудителя инфекции при экзогенном пути заражения могут быть больные стрептококковыми инфекциями и здоровые бактерионосители стрептококка. Наряду с основным, контактным механизмом передачи инфекции возможен аэрозольный механизм передачи (воздушно-капельный путь) с первичным инфицированием носоглотки и последующим заносом возбудителя на кожу руками, а также лимфогенным и гематогенным путём. Постинфекционный иммунитет непрочный. Почти у трети больных возникает повторное заболевание или рецидивирует форма болезни, обусловленная аутоин-фекцией, реинфекцией или суперинфекцией штаммами β-гемолитического стреп- тококка группы А, которые содержат другие варианты М-протеина. Специфической профилактики рожи не разработано. Неспецифические меры связаны с соблюдением правил асептики и антисептики в лечебных учреждениях, с соблюдением личной гигиены.
ПатогенезПри первичной и повторной роже основной путь заражения — экзогенный. При рецидивирующей роже возбудитель распространяется лимфогенно или гематогенно из очагов стрептококковой инфекции в организме. Таким образом, первый этап патологического процесса — внедрение β-гемолитического стрептококка группы А в участок кожи при её повреждении (первичная рожа) или инфицировании из очага дремлющей инфекции (рецидивирующая форма рожи) с развитием рожистого воспаления. Эндогенно инфекция может распространяться непосредственно из очага самостоятельного заболевания стрептококковой этиологии. Размножение и накопление возбудителя в лимфатических капиллярах дермы соответствует инкубационному периоду заболевания. Следующий этап — развитие токсинемии, вызывающей интоксикацию (характерно острое начало болезни с повышения температуры и озноба). В дальнейшем формируется местный очаг инфекционно-аллергического воспаления кожи с участием иммунных комплексов (формирование периваскулярно располо- женных иммунных комплексов, содержащих С3-фракцию комплемента), нарушается капиллярное лимфо- и кровообращение в коже с формированием лимфостаза, обра- зованием геморрагий и пузырей с серозным и геморрагическим содержимым. В завершающей стадии процесса происходит элиминация бактериальных форм β-гемолитического стрептококка с помощью фагоцитоза, образуются иммунные комплексы, и больной выздоравливает. Кроме того, возможно формирование очагов хронической стрептококковой инфекции в коже и регионарных лимфатических узлах с наличием бактериальных и L-форм стрептококка, что становится причиной хронического течения рожи у части больных. Важными особенностями патогенеза часто рецидивирующей рожи считают образование стойкого очага стрептококковой инфекции в организме больного (L-формы); изменение клеточного и гуморального иммунитета; высокий уровень аллергизации (гиперчувствительность IV типа) к β-гемолитическому стрептококку группы А и его клеточным и внеклеточным продуктам. При роже (особенно при геморрагических формах) важное патогенетическое значение приобретает активация различных звеньев гемостаза (сосудисто- тромбоцитарного, прокоагулянтного, фибринолиза) и калликреин-кининовой системы. Развитие внутрисосудистого свёртывания крови наряду с повреждающим действием имеет важное протективное значение: очаг воспаления отграничивается фибриновым барьером, препятствующим дальнейшему распространению инфекции. При микроскопии местного очага рожистого воспаления отмечают серозное или серозно-геморрагическое воспаление (отёк; мелкоклеточная инфильтрация дермы, более выраженная вокруг капилляров). Экссудат содержит большое количество стрептококков, лимфоцитов, моноцитов и эритроцитов (при геморрагических формах). Морфологическим изменениям свойственна картина микрокапил- лярного артериита, флебита и лимфангита. При эритематозно-буллёзной и буллёзно-геморрагической формах воспаления происходит отслойка эпидермиса с образованием пузырей. При геморрагических формах рожи в местном очаге отмечают тромбоз мелких кровеносных сосудов, диапедез эритроцитов в межклеточное пространство, обильное отложение фибрина. В периоде реконвалесценции при неосложнённом течении рожи отмечают крупно- или мелкопластинчатое шелушение кожи в области очага местного воспаления. При рецидивирующем течении рожи в дерме постепенно происходит разрастание соединительной ткани — в результате нарушается лимфоотток и развивается стойкий лимфостаз. Клиническая картинаИнкубационный период при экзогенном заражении длится от нескольких часов до 3–5 дней. У подавляющего большинства больных отмечают острое начало заболевания. Симптомы интоксикации в начальном периоде возникают раньше местных проявлений на несколько часов — 1–2 сут, что особенно характерно для рожи, лока- лизующейся на нижних конечностях. Возникают головная боль, общая слабость, озноб, миалгия, тошнота и рвота (25–30% больных). Уже в первые часы болезни пациенты отмечают повышение температуры до 38–40 °С. На участках кожи, где впоследствии возникнут локальные поражения, некоторые больные ощущают парестезии, чувство распирания или жжения, болезненность. Нередко возникает болезненность при пальпации увеличенных регионарных лимфатических узлов. Разгар заболевания наступает через несколько часов — 1–2 сут после появления первых признаков. При этом общетоксические проявления и лихорадка достигают своего максимума; возникают характерные местные симптомы рожи. Чаще всего воспалительный процесс локализуется на нижних конечностях (60–70%), лице (20–30%) и верхних конечностях (4–7% больных), редко — лишь на туловище, в области молочной железы, промежности, наружных половых органов. При своевременно начатом лечении и неосложнённом течении заболевания продолжительность лихорадки составляет не более 5 сут. Самый длительный лихорадочный период наблюдают при буллёзно-геморрагической роже. У 70% больных рожей обнаруживают регио-нарный лимфаденит (при всех формах болезни). Температура нормализуется и интоксикация исчезает раньше, чем происходит регресс местных симптомов. Локальные признаки заболевания наблюдают до 5–8-го дня, при геморрагических формах — до 12–18-го дня и более. К остаточным явлениям рожи, сохраняющимся на протяжении нескольких недель или месяцев, относят пастозность и пигментацию кожи, застойную гиперемию на месте угасшей эритемы, плотные сухие корки на месте булл, отёчный синдром. О неблагоприятном прогнозе и вероятности раннего рецидива свидетельствуют длительное увеличение и болезненность лимфатических узлов; инфильтративные изменения кожи в области угасшего очага воспаления; продолжительный субфебрилитет; длительное сохранение лимфостаза, который следует рассматривать как раннюю стадию вторичной слоновости. Гиперпигментация кожи нижних конечностей у больных, перенёсших буллёзно-геморрагическую рожу, может сохраняться всю жизнь.
Клиническая классификация рожи • По характеру местных проявлений: G эритематозная; G эритематозно-буллёзная; G эритематозно-геморрагическая; G буллёзно-геморрагическая. • По степени тяжести: G лёгкая (I); G среднетяжёлая (II); G тяжёлая (III). • По кратности течения: G первичная; G повторная (при повторении заболевания через два года; иной локализации процесса); G рецидивирующая (при наличии не менее трёх рецидивов рожи в год целесообразно определение «часто рецидивирующая рожа»). • По распространённости местных проявлений: G локализованная; G распространённая (мигрирующая); G метастатическая с возникновением отдалённых друг от друга очагов воспаления. • Осложнения рожи: G местные (абсцесс, флегмона, некроз, флебит, периаденит и др.); G общие (сепсис, ИТШ, тромбоэмболия лёгочной артерии и др.). • Последствия рожи: G стойкий лимфостаз (лимфатический отёк, лимфедема); G вторичная слоновость (фибредема).
Эритематозная рожа может быть самостоятельной клинической формой или начальной стадией других форм рожи. На коже появляется небольшое красное или розовое пятно, которое через несколько часов превращается в характерную рожистую эритему. Эритема — чётко отграниченный участок гиперемированной кожи с неровными границами в виде зубцов, языков. Кожа в области эритемы напряженная, отёчная, горячая на ощупь, она инфильтрирована, умеренно болезненна при пальпации (больше по периферии эритемы). В ряде случаев можно обнаружить «периферический валик» — инфильтрированные и возвышающиеся края эритемы. Характерны увеличение, болезненность бедренно-паховых лимфатических узлов и гиперемия кожи над ними («розовое облачко»). Эритематозно-буллёзная рожа возникает через несколько часов — 2–5 сут на фоне рожистой эритемы. Развитие пузырей вызвано повышенной экссудацией в очаге воспаления и отслойкой эпидермиса от дермы, скопившейся жидкостью. При повреждении поверхности пузырей или их самопроизвольном разрыве из них истекает экссудат; на месте пузырей появляются эрозии; если пузыри остаются целыми, они постепенно ссыхаются с образованием жёлтых или коричневых корок. Эритематозно-геморрагическая рожа возникает на фоне эритематозной рожи через 1–3 дня после начала заболевания: отмечают кровоизлияния различных размеров — от небольших петехий до обширных сливных экхимозов. Буллёзно-геморрагическая рожа развивается из эритематозно-буллёзной или эритематозно-геморрагической формы в результате глубокого повреждения капилляров и кровеносных сосудов сетчатого и сосочкого слоёв дермы. Происходят обширные кровоизлияния в кожу в области эритемы. Буллёзные элементы заполнены геморрагическим и фибринозно-геморрагическим экссудатом. Они могут быть разных размеров; имеют тёмную окраску с просвечивающими жёлтыми включениями фибрина. Пузыри содержат преимущественно фибринозный экссудат. Возможно возникновение обширных, плотных при пальпации уплощённых пузырей вследствие значительного отложения в них фибрина. При активной репарации у больных на месте пузырей быстро образуются бурые корки. В остальных случаях можно наблюдать разрыв, отторжение покрышек пузырей вместе со сгустками фибринозно-геморрагического содержимого и обнажение эрозированной поверхности. У большинства больных она постепенно эпителизируется. Критериями тяжести рожи считают выраженность интоксикации и распространённость местного процесса. К лёгкой (I) форме относят случаи с незначительной интоксикацией, субфебрильной температурой, локализованным (чаще эритема- тозным) местным процессом. Среднетяжёлой (II) форме свойственна выраженная интоксикация. Больные жалуются на общую слабость, головную боль, озноб, мышечные боли, иногда — на тошноту, рвоту, повышение температуры до 38–40 °С. При обследовании обнару- живают тахикардию; почти у половины больных — гипотензию. Местный процесс может иметь как локализованный, так и распространённый (захватывает две ана- томические области и более) характер. К тяжёлой (III) форме относят случаи с сильной интоксикацией: с интенсивной головной болью, повторной рвотой, гипертермией (свыше 40 °С), затемнением сознания (иногда), менингеальными симптомами, судорогами. Обнаруживают значительную тахикардию, гипотензию; у лиц пожилого и старческого возраста при поздно начатом лечении возможно развитие острой сердечно-сосудистой недостаточности. К тяжёлой форме также относят распространённую буллёзно- геморрагическую рожу с обширными пузырями при отсутствии резко выраженной интоксикации и гипертермии. При различной локализации болезни её течение и прогноз имеют свои особенности.
ДиагностикаДиагноз рожи основан на характерной клинической картине: острое начало с выраженными симптомами интоксикации; ·преимущественная локализация местного воспалительного процесса на нижних конечностях и лице; ·развитие типичных местных проявлений с характерной эритемой, возможным местным геморрагическим синдромом; ·развитие регионарного лимфаденита; отсутствие выраженных болей в очаге воспаления в покое. У 40–60% больных в периферической крови отмечают умеренно выраженный нейтрофильный лейкоцитоз (до 10–12×109/л). У отдельных пациентов с тяжёлым течением рожи наблюдают гиперлейкоцитоз, токсическую зернистость нейтрофи- лов. Умеренное повышение СОЭ (до 20–25 мм/ч) регистрируют у 50–60% больных с первичной рожей. Вследствие редкого выделения β-гемолитического стрептококка из крови больных и очага воспаления проводить обычные бактериологические исследования нецелесообразно. Определённое диагностическое значение имеют повышение титров антистрептолизина О и других противострептококковых антител, бакте- риальные антигены в крови, слюне больных, отделяемом из буллёзных элементов (РЛА, РКА, ИФА), что особенно важно при прогнозировании рецидивов у рекон- валесцентов.
ЛечениеРежим. Диета Режим зависит от тяжести течения. Диета: общий стол (№ 15), обильное питьё. При наличии сопутствующей патологии (сахарный диабет, заболевание почек и др.) назначают соответствующую диету. Медикаментозное лечение Этиотропная терапияПри лечении больных в условиях поликлиники целесообразно назначать один из нижеперечисленных антибиотиков внутрь: азитромицин — в 1-й день по 0,5 г, затем в течение 4 дней — по 0,25 г один раз в день (или по 0,5 г в течение 5 дней); спирамицин — по 3 млн МЕ два раза в сутки; рокситромицин — по 0,15 г два раза в день; левофлоксацин — по 0,5 г (0,25 г) два раза в день; цефаклор — по 0,5 г три раза в день. Курс лечения 7–10 дней. При непереносимости антибиотиков приме- няют хлорохин по 0,25 г два раза в сутки в течение 10 дней. В условиях стационара препарат выбора (при переносимости) — бензилпени- циллин в суточной дозе 6 млн ЕД внутримышечно в течение 10 дней. Препараты резерва — цефалоспорины I поколения (цефазолин в суточной дозе 3–6 г и более внутримышечно в течение 10 дней и клиндамицин в суточной дозе 1,2–2,4 г и более внутримышечно). Эти препараты обычно назначают при тяжё- лом, осложнённом течении рожи. При тяжёлом течении заболевания, развитии осложнений (абсцесс, флегмона и др.) возможно сочетание бензилпенициллина (в указанной дозе) и гентамицина (по 240 мг один раз в день внутримышечно), бензилпенициллина (в указанной дозировке) и ципрофлоксацина (800 мг внутривенно капельно), бензилпеницил- лина и клиндамицина (в указанных дозах). Оправдано назначение комбинированной антибактериальной терапии при буллёзно-геморрагической роже с обильным выпотом фибрина. При этих формах болезни из местного воспалительного очага часто выделяют и другие патогенные микроорганизмы (β-гемолитические стреп- тококки групп В, С, D, G; золотистый стафилококк, грамотрицательные бакте- рии). Патогенетические средстваПри выраженной инфильтрации кожи в очаге воспаления показан приём НПВС (диклофенак, индометацин) в течение 10–15 дней. При тяжёлом течении рожи проводят парентеральную дезинтоксикационную терапию (поливидон, декстран, 5% раствор глюкозы♠, полиионные растворы) с добавлением 5–10 мл 5% раствора аскорбиновой кислоты, 60–90 мг преднизолона. Назначают сердечно-сосудистые, мочегонные, жаропонижающие средства. Патогенетическая терапия местного геморрагического синдрома эффективна при рано начатом (в первые 3–4 дня) лечении, когда она предупреждает развитие обширных геморрагий и булл. Выбор препарата проводят с учётом данных коагу- лограммы. При выраженной гиперкоагуляции показано лечение гепарин-натрием (подкожное введение в дозе 10–20 тыс. ЕД или 5–7 процедур электрофореза) и пентоксифиллином по 0,2 г три раза в сутки в течение 2–3 нед. При отсутствии гиперкоагуляции рекомендуют введение непосредственно в очаг воспаления методом электрофореза ингибитора протеаз — апротинина (курс лечения 5–6 дней). Лечение больных с рецидивирующей рожейЛечение этой формы заболевания проводят в условиях стационара. Обязательно назначение резервных антибиотиков, не применявшихся при лечении предыдущих рецидивов. Назначают цефалоспорины I поколения внутримышечно по 0,5–1 г 3–4 раза в сутки. Курс антибактериальной терапии — 10 дней. При часто рецидивирующей роже целесообразно 2-курсовое лечение. Сначала назначают антибиотики, оптимально действующие на бактериальные формы и L-формы стрептококка. Таким образом, для первого курса антибиотикотерапии используют цефалоспорины (10 дней), после 2–3-дневного перерыва проводят второй курс лечения линкомицином — по 0,6 г три раза в день внутримышечно или по 0,5 г внутрь три раза в день (7 дней). При рецидивирующей роже показана иммунокор- ригирующая терапия (метилурацил, нуклеинат натрия, продигиозан, тимуса экс- тракт, азоксимера бромид и др.). Целесообразно исследование иммунного статуса в динамике. Местную терапию проводят при буллёзной форме с локализацией процесса на конечностях. Эритематозная форма не требует применения местных средств (повязки, мази), а многие из них противопоказаны (ихтаммол, мазь Вишневского, мази с антибиотиками). Неповреждённые пузыри осторожно надрезают у одного из краёв и после выхода экссудата накладывают повязки с 0,1% раствором эта- кридина или 0,02% раствором фурацилина, меняя их несколько раз в день. Тугое бинтование недопустимо. При обширных мокнущих эрозиях местное лечение начинают с марганцевых ванн для конечностей и в последующем накладывают перечисленные выше повязки. Для лечения местного геморрагического синдрома при эритематозно-геморрагической роже используют 5–10% линимент бутилги- дрокситолуола (два раза в сутки) или 15% водный раствор димефосфона♠ (пять раз в сутки) в виде аппликаций на протяжении 5–10 дней.
Дополнительные методы леченияВ остром периоде рожи традиционно назначают субэритемные дозы ультрафио- летового облучения на область воспаления и воздействие токами ультравысокой частоты на область регионарных лимфатических узлов (5–10 процедур). В последние годы установлена высокая эффективность низкоинтенсивной лазе- ротерапии в лечении местного воспалительного синдрома при различных клини- ческих формах рожи. В острой стадии болезни (при выраженном воспалительном отёке, геморрагиях, буллёзных элементах) применяют лазерное излучение низкой часто- ты, в стадии реконвалесценции (для усиления репаративных процессов в коже) — лазерное излучение высокой частоты. Длительность воздействия на одно поле излучения составляет 1–2 мин, а длительность одной процедуры — 10–12 мин. Бициллинопрофилактика рецидивов рожи — составная часть комплекс- ного лечения больных, страдающих рецидивирующей формой заболевания. Профилактическое внутримышечное введение бициллина-5♠ (1,5 млн ЕД) или бензатина бензилпенициллина (2,4 млн ЕД) предупреждает рецидивы болезни, связанные с реинфекцией стрептококком. При сохранении очагов эндогенной инфекции эти препараты предупреждают реверсию L-форм стрептококка в исходные бактериальные формы, что способствует предупреждению рецидивов. За 1 ч до введения бициллина-5♠ или бензатина бензилпенициллина рекомендуют назначение антигистаминных препаратов (хлоропирамин и др.). При частых рецидивах (не менее трёх за последний год) целесообразен метод непрерывной (круглогодичной) бициллинопрофилактики на протяжении одного года и более с 3-недельным интервалом введения препарата (в первые месяцы интервал может быть сокращён до 2 нед). При сезонных рецидивах препарат вводят за 1 мес до начала сезона заболеваемости у больного с 3-недельным интер- валом на протяжении 3–4 мес ежегодно. При наличии значительных остаточных явлений после перенесённой рожи препарат вводят с интервалом 3 нед на протяжении 4–6 мес.
Вирусные гепатиты А и Е
ВГА (инфекционный гепатит, эпидемический гепатит, болезнь Боткина) — острое вирусное заболевание человека с фекально- оральным механизмом передачи возбудителя. Характеризуется воспалением печени, циклическим доброкачественным течением, может сопровождаться желтухой.
ЭтиологияВозбудитель ВГА — вирус HAV (hepatitis A virus), относимый к роду Hepatovirus в составе семейства Picornaviridae. Морфологически HAV выглядит как мелкая безоболочечная сферическая частица размером 27–30 нм. Геном представлен одноцепочечной молекулой РНК, состоящей из приблизительно 7500 нуклеотидов. РНК вируса окружена наружной белковой капсулой (капсидом). Известен только один антиген HAV — НААg, на который макроорганизм вырабатывает антитела. При изучении многочисленных штаммов HAV, выделенных от больных в разных регионах мира и от экспериментально заражённых обезьян, установлено наличие 7 генотипов и нескольких подтипов HAV. Выделенные в России штаммы принадлежат к варианту вируса IА. Все известные изоляты HAV относят к одному серотипу, что обеспечивает развитие перекрёстного про- тективного иммунитета. HAV — гепатотропный, обладает слабым цитопатогенным действием на печёночные клетки. HAV относят к числу наиболее устойчивых к факторам внешней среды вирусов человека. Он обладает способностью к сохранению при комнатной температуре в течение нескольких недель, при +4 °С — месяцами, при –20 °С остаётся жизнеспособным несколько лет. Выдерживает нагревание до 60 °С в течение 4–12 ч; устойчив к действию кислот и жирорастворителей, способен к длительному сохранению в воде, пищевых продуктах, сточных водах, на различных объектах внешней среды. При кипячении разрушается в течение 5 мин, при обработке хлорамином — через 15 мин. Вирус чувствителен к формалину, ультрафиолетовому облучению. Инактивируется также автоклавированием, перманганатом калия, йодистыми соединениями, 70% этанолом, дезинфектантами на основе четвертичных аммониевых соединений.
ЭпидемиологияВГA — классический антропоноз, единственный источник (резервуар) возбудителя инфекции — человек. Вирус выделяют больные с различными формами заболевания, в том числе наиболее частыми (особенно у детей): безжелтушной и стёртой, которые обычно не диагностируют, соответственно заболевших этими формами не госпитализируют, они ведут активный образ жизни и могут заражать окружающих. У больных желтушной формой вирус выделяется с фекалиями наиболее интенсивно в конце инкубационного и в течение преджелтушного периодов. С появлением желтухи в большинстве случаев заразность больных значительно уменьшается. Именно эта особенность — наиболее активное выделение вируса из организма больного в инкубационном периоде в сочетании с высокой устойчивостью HAV в окружающей среде обусловливает широкое распространение этого гепатита. HAV обладает высокой инфекционностью, для заражения HAV достаточно всего нескольких вирусных частиц. ВГA — типичная кишечная инфекция с фекально-оральным механизмом передачи возбудителя. Пути передачи: водный, пищевой и бытовой. Факторы передачи — различные пищевые продукты (в том числе морепродукты, замороженные овощи и фрукты), не подвергшиеся термической обработке, а также вода и грязные руки. Очень редко может происходить передача HAV половым путём при орально-анальных контактах, преимущественно у гомосексуалистов. HAV не проходит через плаценту и его нет в грудном молоке, поэтому если женщина во время беременности заболеет ВГA, ребёнку не угрожает развитие врождённого гепатита и она может кормить новорождённого грудью, соблюдая правила личной гигиеныИммунитет после перенесённого ВГА прочный и длительный, практически пожизненный. Характерные эпидемиологические особенности ВГA — осенняя сезонность и периодичность. но водные, отчасти пищевые) могут вносить соответствующие коррективы.
ПатогенезВнедрение HAV в организм происходит через рот и далее в желудок. Будучи кислотоустойчивым, вирус легко преодолевает желудочный барьер, поступает в тонкую кишку, всасывается в кровь и по системе воротной вены достигает печени, в клетках которой происходит его репликация. На мембране гепатоцитов есть соответствующие вирусу рецепторы, к которым HAV прикрепляется и проникает внутрь печёночной клетки; в цитоплазме гепатоцита происходит его репликация. Часть вновь образованных вирусных частиц поступает с жёлчью в фекалии и выделяется из организма, другая инфицирует соседние гепатоциты. Установлено, что длительную репликацию HAV в культуре клеток не сопровождает цитолиз гепатоцитов. Поэтому в настоящее время полагают, что поражение печени при ВГA обусловлено не столько самим HAV, сколько клеточными иммунными реакциями человека. Цитотоксические Т-клетки распознают и лизируют инфицированные вирусом гепатоциты. Кроме того, эти же Т-лимфоциты продуцируют гамма-интерферон, запуская целый ряд иммунных реакций. Освобождение от вируса происходит в значительной степени благодаря иммунологически опосредствованному разрушению печёночных клеток. Вследствие распада подвергшихся некрозу гепатоцитов вирус и его «обломки» поступают в кровь, то есть возникает фаза вторичной вирусемии. HAV обладает высокой иммуногенной активностью. Одновременно с клеточным происходит активизация и гуморального компонента иммунной систе- мы с накоплением вируснейтрализующих антител. Благодаря быстрому и интенсивному иммунному ответу возникает блокада репликации вируса, а его дальнейшее внедрение в неинфицированные гепатоциты ограничивается. В результате сочетанного действия всех звеньев иммунной системы, как пра- вило, уже через несколько недель организм освобождается от HAV, поэтому при ВГA нет ни длительного вирусоносительства, ни хронических формАдекватностью защитной иммунной реакции при ВГA объясняют сравнительно лёгкое его течение, исключительную редкость фульминантных форм с леталь- ным исходом, полное выздоровление в подавляющем большинстве случаев. При ВГA печень — единственный орган-мишень, в котором происходит репликация вируса, поэтому внепечёноч- ные проявления ВГА не свойственны. В лизисе поражённых HAV гепатоцитов принимают участие молекулы HLA, вследствие чего в течение болезни «запускаются» аутоиммунные механизмы с образованием антител к собственным гепатоцитам.
Клиническая картинаПродолжительность инкубационного периода колеблется от 7 до 50 дней, составляя в среднем около месяца. Классификация • По выраженности клинических проявлений. G Клинические варианты: – желтушный; – безжелтушный; – стёртый. G Субклинический (инаппарантный) вариант. • По длительности и цикличности течения. G Острое (до 3 мес). G Затяжное (более 3 мес). G С рецидивами, обострениями (клиническими, ферментативными). • Формы по тяжести. G Лёгкая. G Среднетяжёлая. G Тяжёлая. G Фульминантная (молниеносная). • Осложнения. G Печёночная кома. G Функциональные и воспалительные заболевания жёлчных путей. • Исходы. G Выздоровление. G Затянувшаяся реконвалесценция. Основные симптомы и динамика их развития Классическим, хотя и не самым частым, считают протекающий циклически желтушный вариант ВГA, при котором вслед за инкубационным следует пред- желтушный период. Начало болезни обычно острое, с повышением температуры тела до 38–39 °С, симптомами интоксикации (головная боль, головокружение, необъяснимая слабость, разбитость, ломота в мышцах, костях, суставах и др.) и диспепсическим синдромом (снижение аппетита, тошнота, горечь во рту, отрыж- ка, рвота, тяжесть в эпигастральной области и правом подреберье, задержка или послабление стула). Одновременно, а иногда раньше диспепсических, могут воз- никнуть незначительно выраженные катаральные явления со стороны верхних дыхательных путей (першение в горле, небольшая боль при глотании и др.), что нередко приводит к ошибочной диагностике ОРВИ. У детей возможны интен- сивные боли в животе, имитирующие острый аппендицит, желчную колику; для взрослых это нехарактерно. В конце преджелтушного периода, продолжитель- ность которого чаще всего составляет от 3 до 7 дней (с колебаниями от 2 до 14 дней), моча становится тёмно-жёлтой, а кал — осветлённым. Однако эти очень важные для своевременной диагностики ВГА симптомы могут быть не замечены больными. В отдельных случаях возможен зуд. У детей уже в преджелтушном периоде может быть выявлено увеличение печени. В сыворотке крови заболевших ВГA в преджелтушном периоде значительно (в 10 и более раз) повышена актив- ность аминотрансфераз — АЛТ и АСТ, а в моче увеличено содержание уробилина. Через 3–5 дней от дебюта болезни температура тела обычно нормализуется, но возникает иктеричность — вначале склер, затем кожи, что знаменует начало желтушного периода. У 2–5% больных симптомы преджелтушного периода отсут- ствуют, ВГA сразу начинается с изменения окраски испражнений и желтушного окрашивания склер. Обычно с появлением желтухи самочувствие больных довольно быстро начи- нает улучшаться, нормализуется температура тела, через несколько дней исчезают все симптомы преджелтушного периода. Дольше сохраняются слабость и сни- жение аппетита. Желтуха при ВГA нарастает быстро, достигая обычно максимума за 3–5 дней, в последующие 5–10 дней держится на одном уровне, а затем интенсивность её уменьшается. В среднем продолжительность желтушного периода около 2 нед. При осмотре больного в этом периоде обнаруживают увеличение и уплотнение печени, край её закруглён, чувствителен при пальпации; увеличение селезёнки отмечают в 10–20% случаев, чаще у детей. На высоте желтухи характерна бради- кардия. По мере уменьшения интенсивности желтухи нормализуется окраска кала и мочи, постепенно уменьшается до нормальных размеров печень. В желтушном периоде сохраняется выраженная гиперферментемия (активность аминотранс- фераз в 10–100 раз выше нормы) с преимущественным повышением активности АЛТ по сравнению с АСТ (соответственно коэффициент де Ритиса всегда менее 1). Гипербилирубинемия обычно умеренная и непродолжительная, в основном за счёт прямого билирубина. Характерно значительное повышение показателя тимоловой пробы, который может оставаться изменённым длительное время и в периоде реконвалесценции. В гемограмме отмечают нормоцитоз или лейкопению, отно- сительный лимфоцитоз; СОЭ в норме. В моче присутствуют жёлчные пигменты (билирубин) с первых дней желтушного периода. Период реконвалесценции характеризует обычно быстрое исчезновение кли- нических и биохимических признаков болезни, в частности гипербилирубинемии. Позднее происходит нормализация показателей активности АЛТ и АСТ; повы- шение тимоловой пробы может сохраняться долго, в течение нескольких месяцев. Продолжительность этого периода в большинстве случаев не превышает 3 мес. В некоторых случаях период реконвалесценции может затягиваться до 6–8 и более месяцев, возможны обострения (ферментативные или клинические), а также рецидивы. Тяжёлую форму ВГA встречают не более чем у 1% больных, преимущественно у лиц старше 40 лет, у пациентов с хронической алко- гольной интоксикацией или наркотической зависимостью, при сочетании ВГA с острым или хроническим вирусным гепатитом иной этиологии. Лёгкую форму гепатита характеризуют слабовыраженные явления интокси- кации или их отсутствие. Слабость, утомляемость, снижение работоспособности отсутствуют или выражены нерезко, непостоянно и кратковременно. Аппетит уме- ренно снижен, тошнота непостоянна, рвота в желтушном периоде нехарактерна. Степень увеличения размеров печени обычно не коррелирует с тяжестью болезни и в большей степени обусловлена предшествующими и сопутствующими забо- леваниями, профессиональными вредностями и др. Интенсивность и стойкость желтухи при лёгкой форме меньше, чем при среднетяжёлой форме. При отчётли- вом повышении уровня АЛТ и АСТ в крови показатели протеинограммы, а также коагулограммы при лёгкой форме вирусного гепатита не имеют существенных отклонений от нормы. Среднетяжёлую форму гепатита характеризует количественное нарастание и усиление всех перечисленных ранее клинических признаков болезни без про- явления качественно новых клинических симптомов. Общая слабость умеренно выражена, обычно усиливается во второй половине дня и менее заметна утром. Головная боль непостоянна, больше выражены тяжесть в голове и умеренная адинамия с повышенной утомляемостью. Аппетит плохой, тошнота выраженная, без рвоты. Желтуха яркая и стойкая, уровень билирубина и АЛТ существенно не отличимы от таковых при лёгкой форме. Наиболее информативны некоторые показатели коагулограммы, в частности снижение протромбинового индекса. Тяжёлую форму гепатита характеризуют более чёткие критерии, так как, помимо количественного нарастания признаков интоксикации, возникают новые клинические симптомы: головокружение, мелькание мушек перед глазами и ади- намия, к которым могут присоединиться геморрагический синдром, тахикардия, болезненность в области печени, склонность к задержке жидкости, лихорадка с нейтрофильным лейкоцитозом. Более чёткими оказываются и разграничитель- ные биохимические признаки: билирубинемия, протромбиновый индекс, более высокие показатели АСТ по сравнению с АЛТ, появление при нарастании тяжести билирубино-ферментной диссоциации — снижение уровня активности амино- трансфераз при повышении уровня билирубина крови. ОПЭ связана с дальнейшей интоксикацией. Нарастают перечисленные ранее признаки, и возникают новые симптомы: сонливость с эмоциональными нару- шениями, «хлопающий тремор», стереотипность в ответах, уменьшение размеров печени с появлением боли на фоне усиления желтухи. Такова I степень ОПЭ — начальный период прекомы. Степень II ОПЭ — заключительный период прекомы, который характеризует спутанность сознания в виде нарушения ориентации в месте и времени, стереотипный характер возбуждения, проявляющийся не только в ответах, но и в спонтанной форме (повторные однообразные возгласы, двига- тельное возбуждение). Степень III ОПЭ — начальный период комы, который отли- чает от предыдущей нарушение словесного контакта при сохранении адекватной реакции на боль. При IV степени ОПЭ — глубокая кома; исчезает болевая реакция, возникает арефлексия. Нарушение биохимических показателей крови, особенно коагулограммы, весьма разительны, но они лишь дополняют яркую клиническую симптоматику, которая сама по себе обычно достаточна для проведения градации ОПЭ. Фульминантную (молниеносную) форму ВГA с развитием острой печёноч- ной недостаточности, ОПЭ встречают крайне редко, в 0,1–0,8% всех случаев. Иногда ВГA сопровождает выраженный холестатический компонент, при этом желтушный период удлиняется до нескольких месяцев, интенсивность желтухи велика, болезнь сопровождает мучительный зуд, в сыворотке крови значительно повышена активность ЩФ. Безжелтушныйвариант характеризуют те же клинические и лабораторные признаки, что и желтушный, однако отсутствие одного из самых заметных про- явлений гепатита — желтухи и, соответственно, гипербилирубинемии затрудняет диагностику. Клиническая симптоматика безжелтушного варианта соответствует проявлениям начального периода классического желтушного варианта. Возможны кратковременное повышение температуры тела, диспепсические явления, сла- бость, катаральный синдром и др. в течение 3–5 дней. Увеличивается и стано- вится слегка болезненной при пальпации печень, может быть потемнение мочи. Выявляют гиперферментемию, показатели АЛТ и АСТ повышены почти так же существенно, как и при желтушном варианте, увеличен показатель тимолового теста. Стёртый вариант проявляется минимальными и быстро проходящими клини- ческими симптомами (в том числе желтухой) в сочетании с гиперферментемией и повышенной тимоловой пробой. При субклиническом (инаппарантном) варианте, в отличие от безжелтушного и стёртого, самочувствие заболевших вообще не нарушено, печень не увеличена, желтухи нет, но показатели активности АЛТ и АСТ повышены, в сыворотке крови определяют специфические маркёры HAV.
ДиагностикаДиагноз ВГА устанавливают с учётом клинических, эпидемиологических и лабораторных данных. Основание для предположения о ВГA: G острое начало болезни с высокой температурой тела, диспепсическими и асте- новегетативными явлениями; G короткий преджелтушный период; G увеличение печени; G улучшение самочувствия, нормализация температуры тела при появлении желтухи; G гиперферментемия (АЛТ, АСТ) с коэффициентом де Ритиса менее 1; G гипербилирубинемия (преимущественно за счёт прямого); G высокий показатель тимоловой пробы; G указание на контакт с больным(и) желтухой за 7–50 дней до заболевания или употребление сырой воды из случайных источников, немытых овощей и фруктов и т.д.; случаи ВГA в коллективе, местности, где находился пациент в соответствующие инкубационному периоду сроки. Специфическая и неспецифическая лабораторная диагностика Специфический маркёр ВГA — антитела к HAV класса М (анти-HAV IgM), выявляемые методом ИФА в сыворотке крови с первых дней болезни и далее в течение 3–6 мес. Эти антитела («ранние») вырабатываются у всех больных ВГA независимо от клинического варианта и формы тяжести; их обнаружение — ран- ний и надёжный диагностический метод, позволяющий не только подтвердить клинический диагноз ВГA, но и выявить его безжелтушный, стёртый и субкли- нический варианты. Через 6–8 мес анти-HAV IgM уже не обнаруживают. Синтез специфических «поздних» анти-HAV IgG начинается со 2–3-й нед болезни, титр их нарастает медленно и достигает максимума через 4–6 мес, затем снижается, но в течение нескольких десятилетий (возможно, пожизненно) их можно обнаружить методом ИФА. Анти-HAV IgG обнаруживают у значительной части взрослых людей, что считают доказательством перенесённого ранее ВГA и наличия иммуни- тета к этой инфекции. Анти-HAV IgG вырабатываются также у вакцинированных против ВГA. Стандарт диагностики Стандарт лабораторной диагностики ВГА (обязательный). • Клинический анализ крови. • Клинический анализ мочи и жёлчные пигменты (билирубин). • Биохимический анализ крови: билирубин, АЛТ, АСТ, протромбиновый индекс, тимоловая проба. • Иммунологическое исследование: G анти-HAV IgM; G HBsAg; G анти-HBс IgM; G анти-HCV. Дополнительная лабораторно-инструментальная диагностика ВГA. • Холестерин, ЩФ, ГГТ, глюкоза, амилаза, общий белок и белковые фракции, ЦИК, криоглобулины, LE-клетки, РНК HAV, анти-HEV IgM, анти-ВИЧ. • УЗИ брюшной полости. • Рентгенография органов грудной клетки. Представленный стандарт обеспечивает диагностику ВГА, протекающего как в виде моноинфекции, так и в сочетании с гепатитами иной этиологии.
Гепатит Е
Вирусный гепатит Е (ВГЕ) — острое вирусное заболевание с фекально-оральным механизмом передачи возбудителя, для которого характерны циклическое течение и частое развитие ОПЭ у беременных.
ЭтиологияВирус гепатита Е (HEV) имеет сферическую форму, диаметр около 32 нм и по своим свойствам близок калицивирусам (семейство Caliciviridae). Геном вируса представлен однонитчатой РНК. Вирус быстро разрушается под действием хлор- содержащих дезинфицирующих средств. Он менее устойчив в окружающей среде, чем HAV. ЭпидемиологияИсточник инфекции — больные с острой формой ВГЕ. Хронического носительства вируса не зарегистрировано. Основной путь передачи инфекции — водный. Чаще всего болеют мужчины 15–40 лет. У детей заболевание возникает редко. ВГЕ распространён главным образом в развивающихся странах Азии и Африки, где вызывает значительные эпидемические вспышки преимущественно водного про- исхождения или спорадические случаи болезни. Характерна сезонность инфекции: подъём заболеваемости связан с началом или окончанием сезона дождей в Юго- Восточной Азии, а в странах Центральной Азии пик заболеваемости приходится на осень. Следует отме- тить, что у больных хроническими гепатитами (вирусными, аутоиммунными), у доноров, больных гемофилией и лиц, перенёсших трансплантацию почек, высока частота обнаружения анти-HEV IgG.
ПатогенезПатогенез изучен недостаточно. По-видимому, HEV обладает прямым цитопа- тическим действием. Для ВГЕ характерно тяжёлое течение болезни в III триместре беременности, однако причины этого феномена неизвестны. В основе тяжёлого течения болезни лежит массивный некроз гепатоцитов, развитие тромбогеморра- гического синдрома вследствие резкого дефицита плазменных факторов гемоста- за, а также гемолиз, приводящий к ОПН. В этих случаях отёк мозга и ДВС-синдром могут приводить к смерти.
Клиническая картинаИнкубационный период болезни составляет 15–40 дней, в среднем около 1 мес. Выделяют желтушные и безжелтушные формы болезни (соотношение 1:9). Для желтушных форм характерно острое циклическое, преимущественно лёгкое течение болезни (60% всех случаев). Различают острое и постепенное начало забо- левания. Преджелтушный период чаще короткий и составляет 2–5 дней, преобла- дают проявления диспепсического синдрома. Кратковременная лихорадка (чаще субфебрильная) возникает у 10–20% больных. Примерно у 20% больных болезнь начинается с изменения цвета мочи и развития желтухи. Продолжительность желтушного периода составляет от нескольких дней до одного месяца (в среднем 2 нед), возможно развитие холестатической формы с длительной желтухой, кож- ным зудом. У 1% больных желтушными формами ВГЕ развивается фульминантный гепатит. Тяжёлое течение ВГЕ наблюдают у беременных (особенно в III триместре), а также у рожениц в течение первой недели после родов. Предвестниками такого течения ещё в преджелтушном периоде заболевания могут быть выраженные симптомы интоксикации, лихорадка, диспепсический синдром, боль в правом подреберье. После появления желтухи быстро нарастают симптомы печёночной энцефалопа- тии вплоть до развития комы. При этом отмечают выраженный гемолиз, гемогло- бинурию, олигоанурию, а также резко выраженный геморрагический синдром, обусловленный снижением активности (до 2–7% нормальных показателей) фак- торов гемостаза, входящих в протромбиновый комплекс (II, VII, X). При развитии геморрагического синдрома возникают массивные желудочно-кишечные, маточ- ные и другие кровотечения, которые нередко приводят к смерти. Беременность в большинстве случаев заканчивается внутриутробной смертью плода, выкидышем, преждевременными родами. Из родившихся живыми каждый второй погибает в течение месяца. В эндемичных регионах ВГЕ у беременных в 70% случаев проте- кает фульминантно. Летальность составляет более 50%, особенно в III триместре беременности.
ДиагностикаНа наличие ВГЕ могут указывать: G предположение о водном пути передачи заболевания; G посещение эндемичной по ВГЕ страны; G клинические проявления, сходные с таковыми при ВГА; G выявление тяжёлых форм с симптомами печёночной энцефалопатии, осо- бенно у беременных во второй половине беременности, раннем послеродовом периоде или у кормящих матерей. Подтверждает диагноз выявление анти-HEV IgM в сыворотке крови, которые появляются в крови через 3–4 недели после инфицирования и исчезают через несколько месяцев.
Гепатиты В,С и Д Гепатит B
Вирусный гепатит В (ВГВ), или гепатит В, — вирусная антропонозная инфекци- онная болезнь с контактным и вертикальным механизмами передачи возбудителя. Характеризуется циклически протекающим паренхиматозным гепатитом с нали- чием в части случаев желтухи и возможной хронизацией.
ЭтиологияВирус гепатита В (HBV) относится к семейству гепаднавирусов (hepar —печень, DNA — ДНК, т.е. ДНК-содержащие вирусы, поражающие печень), роду Orthohepadnavirus. HBV, или частица Дейна, имеет сферическую форму, диаметр 40–48 нм (в среднем 42 нм). Оболочка состоит из фосфолипидного бислоя толщи- ной 7 нм, в который погружены частицы поверхностного антигена, состоящие из нескольких сотен молекул белка, гликопротеидов и липопротеидов. Внутри HBV находится нуклеокапсид, или ядро (core), имеющее форму икосаэдра диаметром 28 нм, содержащее геном HBV, концевой белок и фермент ДНК-полимеразу. Геном HBV представлен частично двухцепочечной молекулой ДНК, имеющей незамкну- тую кольцевую форму и содержащей около 3200 пар нуклеотидных оснований (3020–3200). ДНК HBV включает четыре гена: S-ген, кодирующий поверхност- ный антиген оболочки — HBSAg; С-ген, кодирующий HBCAg; P-ген, кодирующий информацию о ферменте ДНК-полимеразе, обладающей функцией обратной транскриптазы; X-ген, несущий информацию о X-белке. HBSAg синтезируется в цитоплазме гепатоцита. Установлено, что существует 4 основных субтипа HBSAg: adw, adr, ayw, ayr. В России регистрируют в основном субтипы ayw и adw. На основе анализа нуклеотидных последовательностей S и Pre-S гена изоляты вируса, выделенные в различных регионах мира, объединены в 8 основных генотипов, которые обозначены буквами латинского алфавита: A, B, C, D, E, F, G и H. В России превалирует генотип D, реже регистрируют генотип А. Полного соответствия между генотипами HBV и серотипами HBSAg не установлено. S-ген HBV отвечает за синтез HBSAg, который вызывает продукцию нейтрали- зующих антител, поэтому S-ген используют для производства генноинженерных вакцин. Ген C (core-ген) кодирует белок нуклеокапсида (HBCAg), обладающий способ- ностью к самосборке в core-частицы, в которые после завершения цикла репли- кации упаковывается ДНК HBV. В core-гене выделяют pre-core-зону, кодирующую pre-core-полипептид, модифицирующийся в растворимую форму и секретируемый в эндоплазматический ретикулум и затем в кровь белок — HBEAg (e-антиген HBV). HBEAg — один из основных эпитопов, вызывающих формирование пула специфи- ческих цитотоксических Т-лимфоцитов, которые мигрируют в печень и отвечают за элиминацию вируса. Ген P кодирует белок, обладающий ферментативной активностью, — ДНК- полимеразу HBV. Этот фермент также выполняет функцию обратной транскрип- тазы. Клиническое значение мутаций в P-гене ДНК HBV прежде всего связано с резистентностью к лечению аналогами нуклеозидов ХГВ. Ген X кодирует белок, который играет важную роль в развитии первичного рака печени у вирусоносителей HBV. Кроме того, Х-белок способен активировать репликацию других вирусов, в частности ВИЧ, что определяет ухудшение клини- ческого течения у лиц, инфицированных вирусом HBV и ВИЧ. Против каждого антигена HBV в организме человека вырабатываются анти- тела. HBV высоко устойчив к физическим и химическим факторам, сохраняет жиз- неспособность в сыворотке крови при комнатной температуре в течение 3 мес, при 20 °C — 15 лет, в высушенной плазме — до 25 лет, не погибает при действии многих дезинфицирующих средств и консервантов крови. Он инактивируется при автоклавировании (45 мин) и стерилизации сухим жаром (+160 °С), чувствителен к эфиру и неионным детергентам. Для химической дезинфекции используют в основном альдегиды и соединения хлора.
ЭпидемиологияОсновным резервуаром и источником HBV служат больные ОГВ, больные хро- нической HBV-инфекцией (вирусоносители и больные ХГВ), число которых на земном шаре превышает 300 млн человек, а в РФ их более 5 млн. У больных HBV-инфекцией HBSAg и ДНК HBV обнаруживают в крови, моче, слюне, жёлчи, слёзах, фекалиях, грудном молоке, вагинальном секрете, сперме, цереброспинальной жидкости, крови пуповины. Однако только кровь, сперма и, возможно, слюна представляют реальную эпидемиологическую опасность, так как в других жидкостях концентрация вируса очень мала. Основной фактор передачи — кровь. Инфицирующая доза вируса может содержаться в 0,0005 мл крови. ВГВ характеризуется множественностью путей передачи (естественных и искусствен- ных): возможен контактный, вертикальный и артифициальный (парентеральные манипуляции, трансплантация органов) пути передачи. Чрезвычайно эффективен половой путь передачи HBV. Заражение ВГВ возможно и при бытовом общении с больным или вирусоносителем при нарушении целостности слизистых оболочек и кожного покрова. В этих случаях HBV внедряется через повреждённую кожу (микротравмы), при прямом контакте с источником инфекции либо при совместном пользовании различными предмета- ми обихода и личной гигиены (загрязнённое кровью белье, ножницы, пилочки для ногтей, зубные щётки, бритвы, мочалки и т.д.). Особое значение имеет передача HBV вертикальным путём от беременной (больная ОГВ или хронической HBV- инфекцией) плоду иди новорождённому. Заражение ВГВ возможно при различных парентеральных медицинских и немедицинских вмешательствах, сопровождающихся нарушением целостности кожного покрова или слизистых оболочек (инъекции, стоматологические, эндоскопические, гинекологические обследования, косметические процедуры, пирсинг, татуаж и т.д.), если нарушаются правила стерилизации инструментов. Иммунитет после перенесённого ВГВ длительный, возможно, пожизненный.
ПатогенезHBV попадает в кровь и затем в гепатоциты, где преимущественно происходит его репликация. После адсорбции вируса на поверхности гепатоцита происходит разрушение его наруж- ной оболочки и сore-частица (нуклеокапсид) проникает внутрь клетки, а затем в её ядро. В ядре гепатоцита синтезируется прегеномная РНК с помощью клеточной РНК-полимеразы. Прегеномная РНК переносится в цитоплазму и упаковывается вместе с белком P (HBV ДНК-полимераза) во вновь сформированные капсиды. Антигены вируса экспрессируются на клеточной оболочке, связываются с HLA 1-го и 2-го классов и распознаются цитотоксическими Т-клетками иммунной системы. Последние пролиферируют и образуют клоны антиген-специфических киллерных клеток, лизирующих поражённые клетки. Количество и функциональная активность антиген-специфических киллеров определяет адекватность (или неадекватность) иммунной реакции и исход болезни. Гуморальный ответ организма заключается в продукции специфических антител к антигенам HBV, их связывании с образованием иммунных комплексов и дальнейшей элиминацией из организма. Взаимодействие HBV с клеткой также может приводить к интеграции сегментов ДНК HBV в геном гепатоцита. В результате проникновения HBV в гепатоциты и его размножения запуска- ется механизм комплексного патологического процесса в печени: усиливаются процессы перекисного окисления липидов, вследствие чего повышается прони- цаемость мембран печёночных клеток и лизосом, что приводит к высвобожде- нию гидролитических ферментов лизосом и разрушению основных компонентов клетки. При этом высвобождаются белковые компоненты, которые могут выступать в роли аутоантигенов и наряду с перечисленными ранее причинами стиму- лировать выработку специфических противопечёночных антител, разрушающих гепатоциты, что ещё более усугубляет патологические изменения в печени. Гидролитический аутолиз гепатоцитов ведёт к повреждению капилляров ткани печени и инфильтрации её плазменными элементами с развитием фагоцитарно- лимфоцитарной активности. Таким образом, развивается паренхиматозное воспаление органа с появлением у больного определённых клинических и лабораторных признаков (желтуха, увеличение печени, гипербилирубинемия, повышение активности аспарагиновой и аланиновой трансаминаз, ферментов холестаза). Цитолиз на фоне воспалительного некроза гепатоцитов и апоптоти- ческой гибели части вирусинфицированных гепатоцитов приводит к снижению синтеза белков, гормонов, витаминов и реализации детоксикации организма. Поступающие через воротную вену из кишечника в печень продукты расщепле- ния белков, жиров и углеводов и их метаболиты не подвергаются в полной мере реакциям обменного синтеза вследствие частичного функционального блока органа. Вследствие нарушения нормальных обменных процессов и нарастающе- го количества продуктов аутолиза клеток печени развивается системная интоксикация организма и гипоксия тканей. Патологический процесс приобретает прогрессирующее течение, а обширный некроз печёночных клеток в короткие сроки может привести к печёночно-клеточной недостаточности, печёночной энцефалопатии и гибели больного (фульминантная форма гепатита). Морфологическими маркёрами ХГВ служат так называемые «матово-стекловидные» гепатоциты (содержат HBSAg) и «песочные» ядра в гепатоцитах (содержат НВСAg). При ХГВ в биоптатах печени помимо дистрофии и некроза гепатоцитов, клеточной инфильтрации обнаруживают фиброзные изменения в дольках и портальном тракте, перипортальный фиброз. Мостовидные некрозы (порто-центральные и порто-портальные) ведут к формированию порто-центральных и порто-портальных фиброзных септ, нарушающих цитоархитектонику печёночной ткани, что в дальнейшем может привести к развитию цирроза.
Клиническая картинаДля ВГВ характерно циклическое течение. Инкубационный период длится от 45 до 180 дней (обычно 2–4 мес). Клиническая классификация гепатита B • Клинические формы: желтушный, безжелтушный, субклинический (инаппа- рантный) варианты. • По длительности и цикличности течения. G Острый (до 3 мес). G Затяжной (более 3 мес). 622 Клинические рекомендации по заболеваниям Раздел IV G С рецидивами, обострениями (клиническими, ферментативными). • Формы по тяжести. G Лёгкая. G Среднетяжёлая. G Тяжёлая. G Фульминантная (молниеносная). • Осложнения: острая и подострая дистрофия печени с развитием печёночной энцефалопатии и печёночной комы. • Исходы. G ОГВ: выздоровление, ХГВ, летальный исход при развитии дистрофии пече- ни. G ХГВ: выздоровление (спонтанная сероконверсия HBSAg/anti-HBS), неактив- ное носительство, цирроз печени, гепатоцеллюлярная карцинома. В течении ОГВ выделяют преджелтушный, желтушный периоды и период реконвалесценции. Болезнь начинается мгновенно. Преджелтушный период длит- ся 1–5 нед. Характерны астеновегетативный (слабость, утомляемость, разбитость) и диспепсический (ухудшение аппетита, снижение вкусовых ощущений, тошнота, иногда рвота, горечь во рту, тяжесть и тупые боли в правом подреберье) синдромы. Часты головная боль, нарушения сна. Примерно у 20–30% больных наблюдают боли в крупных суставах, уртикарную сыпь, повышение температуры тела, реже кожный зуд. Ещё до появления желтухи увеличивается печень (иногда и селезён- ка), моча становится тёмной, в сыворотке крови повышается в 20–30 раз актив- ность АЛТ и АСТ; в крови обнаруживают специфические маркёры HBV-инфекции (HBSAg, HВE-антиген, анти-НВС IgM). С появлением желтухи самочувствие больных ухудшается: нарастает слабость, аппетит снижается вплоть до анорексии, отмечают постоянную тошноту, сухость и горечь во рту, нередко головную боль и головокружение и т.д., однако прекраща- ется артралгия и нормализуется температура тела. Клинические варианты ВГВ могут быть самыми разнообразными: желтушный, безжелтушный, стёртый, инаппарантный (субклинический). При лёгкой форме ВГВ интоксикацию не наблюдают или она незначительно выражена, интенсивность желтухи невелика, биохимические пробы выявляют лишь повышение билирубина в крови и гиперферментемию (при этом коэффи- циент де Ритиса менее 1). При среднетяжёлой форме ВГВ интоксикация проявля- ется умеренной слабостью, непостоянной головной болью, снижением аппетита, тошнотой; желтуха яркая и стойкая. Биохимически, кроме изменений, присущих лёгкой форме, может выявляться незначительное снижение протромбиновой активности. Тяжёлая форма ВГВ характеризуется нарастанием выраженности признаков интоксикации (слабость, аппетит отсутствует, постоянная тошнота, частая рвота). Появляются новые клинические признаки: адинамия, головокружение, мелькание мушек перед глазами, тахикардия, болезненность в области печени, сокращение размеров печени, геморрагический синдром (кровотечения из носа, кровоподтёки в местах инъекций и т.д.), лихорадка, желтуха обычно нарастает. Одновременно отмечают значительное снижение протромбиновой активности и показателя сулемовой пробы, возможно снижение активности трансфераз при нарастающей гипербилирубинемии.
Начальным проявлением ОПЭ становятся жалобы на головные боли. По мере нарастания тяжести заболевания могут появиться симптомы ОПЭ — инверсия сна, вялость и сонливость, заторможенность или возбуждение, негативизм, апатия или агрессия (I степень), «хлопающий» тремор, мелькание мушек перед глазами, чувство «провалов» (I–II степень), эхолалия, отсутствие продуктивного контакта с больным, сопор (III степень), полное отсутствие сознания, арефлексия (IV степень).
ДиагностикаОГВ диагностируют на основании эпидемиологического анамнеза (перелива- ние крови, операция, внутривенное введение наркотиков, другие парентеральные вмешательства, случайные половые связи в течение последних 6 мес, тесный контакт с носителями HBSAg) и клинико-лабораторных данных (постепенное начало, длительный преджелтушный период с диспепсическими расстройствами, артралгиями и экзантемой, выраженной слабостью; ухудшение самочувствия на фоне появления желтухи; гиперферментемия), однако эти данные не позволяют дифференцировать ВГВ от других вирусных гепатитов, поэтому необходима его верификация путём выявления специфических маркёров острой HBV-инфекции: HBSAg, анти-НВС IgM, HBEAg. Самым достоверным специфическим маркёром ОГВ являются анти-НВС IgM, которые появляются в конце инкубационного периода и сохраняются в течение всего периода клинических проявлений. В стадии реконвалесценции ОГВ (4–6-й месяц от начала заболевания) анти-НВС IgM исчезают и появляются анти-НВС IgG (они сохраняются пожизненно). У вирусоносителей HBV анти-НВС IgM в крови отсутствуют. НВС-антиген в сыворотке крови не выявляют, его можно обнаружить лишь в ядрах гепатоцитов при исследовании биоптатов печени. У 10–20% боль- ных ОГВ анти-НВС IgM становится единственным маркёром ВГВ, это относится и к ВГВ фульминантного течения. В инкубационном периоде ВГВ одновременно с HBSAg в сыворотке крови циркулирует HBE-антиген. Через несколько дней (3–8) после появления желтухи HBEAg исчезает из крови и появляются анти-НВЕ; такая сероконверсия всегда свидетельствует об ОГВ. Антигены и антитела к HBV определяются обычно методом ИФА. В последнее десятилетие разработаны и внедрены в клиническую практику молекулярно-биологические методы, в частности, ПЦР, позволяющая выявить ДНК HBV в сыворотке крови, лимфоцитах, клетках печени, что указывает на репликацию HBV, являясь иногда единственным её маркёром, особенно в случае скрытой HBV-инфекции. острую инфекцию (HBSAg в сочетании с анти-НВС IgM) от хронической (HBSAg в сочетании с анти-НВС IgG), судить о выздоровлении и сформировавшемся протективном иммунитете (анти-HBS более 10 ME), регистрировать сероконвер- сию — HBEAg/анти-НВЕ), выявить репликативную активность HBV (ДНК HBV+), определить форму хронического ВГВ (НВЕ-негативный или НВЕ-позитивный), прогнозировать течение болезни, судить об эффективности проводимой терапии
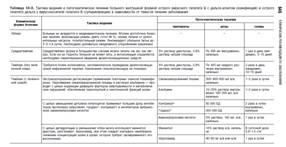
Гепатит D
Гепатит D (гепатит дельта, гепатит B с дельта-агентом) — вирусный гепатит с контактным механизмом передачи возбудителя, вызываемый дефектным вирусом, репликация которого возможна только при наличии в организме HBSAg. Заболевание характеризуется тяжёлым течением и неблагоприятным прогнозом.
ЭтиологияВ 1977 г. группой итальянских исследователей в гепатоцитах больных ВГB был обнаружен ранее неизвестный антиген. По предложению ВОЗ возбудитель ВГD получил название hepatitis delta virus — HDV. Большинство исследователей не относят его ни к одной из известных таксономических категорий, считая его един- ственным представителем нового рода — Deltavirus. Особенности HDV связаны с тем, что в геноме дельта-частицы отсутствуют участки, кодирующие оболочечные белки вируса. HDV — сферическая частица диаметром около 36 нм (от 28 до 39 нм), это наи- меньший из известных вирусов животных. Он состоит из нуклеокапсида (18 нм), построенного приблизительно из 70 субъединиц дельта-антигена (HDAg) и РНК HDV. Внешняя оболочка образована поверхностным антигеном HBV. Наружная оболочка HDV представлена HBSAg. Существует две разновидности HDAg с молекулярной массой 24 кДа (HDAg-S) и 27 кДа (HDAg-L) с выраженными функциональными различиями в жизнедеятель- ности вируса. В настоящее время считают, что малая форма — HDAg-S необходима для репликации HDV и увеличивает скорость репликации РНК HDV (трансакти- ватор вирусной репликации), а большая (HDAg-L) участвует в сборке вирусной частицы и уменьшает скорость репликации HDV. Кроме того, HDAg-L участвует во внутриклеточном перемещении вирусных белков. Дельта-антиген локализуется в ядрах инфицированных гепатоцитов, в ядрышках и/или нуклеоплазме. HDAg имеет выраженную РНК-связывающую активность. Специфичность этого связы- вания определяет отсутствие взаимодействия с другими вирусными и клеточными РНК. Геном HDV представлен однонитевой циклической молекулой РНК негатив- ной полярности протяжённостью около 1700 нуклеотидов. Взаимодействие HBV и HDV определяет не только формирование внешней оболочки HDV с помощью HBSAg, но и, возможно, другие механизмы, которые пока не до конца ясны. В настоящее время не вызывает сомнения способность HDV ингибировать репликацию HBV, приводя к уменьшению экспрессии HBEAg и HBSAg и угнетению ДНК-полимеразной активности в течение острой инфекции — коинфекции. Известно три генотипа и несколько субтипов HDV. Генотип I распространён во всех регионах мира и в основном циркулирует в Европе, России, Северной Америке, Южнотихоокеанском регионе и на Ближнем Востоке. Генотип II рас- пространён на о. Тайвань и Японских островах. Генотип III встречают в основном в Южной Америке и в Центральноафриканской Республике. Все генотипы HDV относят к одному серотипу. HDV устойчив к высоким температурам, на него не действуют кисло- ты и УФ-излучение. Вирус можно инактивировать щёлочами и протеазами. Многократное замораживание и оттаивание не влияют на его активность.
ЭпидемиологияОсновной источник возбудителя HDV-инфекции — лица с хроническими фор- мами HBV-инфекции, заражённые HDV. Механизм передачи HDV-инфекции имеет большое сходство с передачей HBV- инфекции. Передача дельта-вируса осуществляется парентеральным путём, преимущественно с кровью. Риск заражения дельта-инфекцией особенно велик для постоянных реципиентов донорской крови или её препаратов (то есть больных гемофилией); для лиц, подвергающихся частым парентеральным вмешательствам, а также для наркоманов, вводящих наркотики внутривенно; для лиц, имеющих контакт с кровью. Заражение часто происходит в хирургических отделениях, центрах гемодиализа. Возможна трансплацентарная передача HDV от беременной плоду, в основном у HBE-позитивных матерей, инфицированных HDV. Перинатальный путь передачи также довольно редок, но развитие ко-HBV-HDV-инфекции у новорождённых возможно. Перенесённая HDV-инфекция оставляет стойкий иммунитет. Для репликации HDV необходимы структурные компоненты HBV (HBSAg), поэтому дельта-инфекция никогда не бывает самостоятельной и развивается только на фоне HBV-инфекции. Особенно тщательно от возможного присоединения дельта-вирусной инфекции следует оберегать носителей HBS-антигена и больных ХГB. Проводят разъяснительную работу, родственники больного и сам больной ВГB должны знать о путях зараже- ния дельта-инфекцией и необходимости соблюдения мер безопасности.
ПатогенезПопав в организм носителя HBV, дельта-вирус находит благоприятные условия для своей репликации, так как сразу окружает себя оболочкой из HBS-антигена и затем проникает в гепатоциты благодаря наличию на их поверхности полимеризованного альбумина, имеющего сродство к HBSAg, образующему внешнюю оболочку HDV. Внепечёночная репродукция HDV не установлена. Дельта-вирус оказывает как прямое цитопатическое действие, так и иммуно- опосредованное по аналогии с HBV. При инфицировании дельта-вирусом возможны два варианта дельта-инфекции: коинфекция и суперинфекция. Первая возникает в том случае, если HDV попадает в организм здорового человека одновременно с HBV. Суперинфекция развивается у ранее инфицированных вирусом B (у больных ВГB или носителей HBSAg) при дополнительном заражении их дельта-вирусом. Гепатит, который возникает в результате коинфекции, принято называть острым гепатитом смешанной этиологии HBV/HDV или ОГB с дельта-агентом, подчеркивая этим участие обоих вирусов в патогенезе болезни. Продукция HDV происходит одновременно с HBV, но, вероятно, активная репликация дельта-вируса следует после наработки структурных компонентов HBV (HBSAg), и продолжительность её лимитируется продолжительностью HBS-антигенемии. Гепатит смешанной этиологии заканчивается после элиминации из организма обоих вирусов. При суперинфекции развивается острый вирусный гепатит дельта, который принято называть острая дельта(супер)-инфекция вирусоносителя ВГB. В этом случае участие HBV в развитии повреждения печени минимально, а все возникающие патологические изменения и клинические проявления обусловлены именно действием дельта-вируса. В отличие от коинфекции, имеющей обычно острое самолимитирующее течение, суперинфекцию характеризует тяжёлое прогрессирующее течение вплоть до возникновения массивного некроза печени или быстро прогрессирующего развития цирроза. Связано это с тем, что при хрони- ческой HBV-инфекции (у носителей HBSAg, больных ВГB) в печени постоянно образуется в больших количествах HBSAg, и HDV находит очень благоприятные условия для репликации и осуществления своего повреждающего действия.
Клиническая картинаОстрый гепатит B с дельта-агентом (коинфекция) с печёночной комой и без неё Клинические проявления гепатита, развивающегося в результате коинфекции, чрезвычайно сходны с таковыми при ОГB. Инкубационный период составляет от 6 до 10 нед, характерно циклическое течение. Преджелтушный период начинается более остро, чем при ВГB, с ухудшения самочувствия, недомогания, слабости, утомляемости, головной боли. Одновременно отмечают диспепсические явления: снижение аппетита вплоть до анорексии, тош- ноту, рвоту. Чаще, чем при ВГB, возникают мигрирующие боли в крупных суставах. Почти у половины больных появляются боли в правом подреберье, что не харак- терно для ВГB. Другое отличие от ВГB — лихорадка, причём у 30% больных темпе- ратура тела поднимается выше 38 °С. Продолжительность преджелтушного периода короче, чем при ВГB, и составляет в среднем около 5 дней. Желтушный период. С появлением желтухи симптомы интоксикации нараста- ют. На фоне желтухи сохраняются артралгии (у 30%) и субфебрилитет. Усиливаются слабость, утомляемость; чаще выявляют кожный зуд; сохраняются боли в правом подреберье, не связанные с приёмом пищи. Нередко отмечают уртикарные высыпа- ния на коже. Наиболее продолжительные симптомы желтушного периода: слабость, снижение аппетита, боли в правом подреберье. У всех больных увеличивается печень на 1–3 см, край её эластичный, гладкий, чувствительный при пальпации. Чаще, чем при ВГB, увеличивается селезёнка. В сыворотке крови повышено содержание били- рубина за счёт связанной фракции, активность трансфераз намного выше, чем при ОГB. Значительно повышается показатель тимоловой пробы, что несвойственно для ВГB; сулемовая проба остаётся нормальной. Гипербилирубинемия длится в среднем до 1,5 мес, гиперферментемия — до 2–3 мес. Заболевание нередко имеет двухволновое течение с клинико-ферментативным обострением, что можно объяснить присутствием в организме двух вирусов с различными биологическими свойствами. Предполагают, что первая волна — проявление HBV-инфекции, а вторая обусловлена дельта-инфекцией, так как к этому времени в организме уже достаточно молекул HBS-антигена, необходимого для репродукции HDV. Однако некоторые исследователи объясняют наличие второго пика АЛТ активизацией репликации HBV после периода подавления его репликации дельта-вирусом. У 60% больных на 18–32-й день от начала желтухи на фоне начинающегося улучшения нарастают слабость, головокружение, боли в области печени; вновь увеличивается печень, повышается показатель тимоловой пробы и активность трансфераз. Часто активность АСТ выше активности АЛТ, коэффициент де Ритиса более 1. Острая дельта(супер)-инфекция вирусоносителя гепатита B Данный вариант заболевания может протекать как манифестно, так и клинически латентно, однако у 60–70% больных всё-таки регистрируют или эпизод желтухи, или классическую картину желтушного варианта острого гепатита. Инкубационныйпериод длится 3–4 нед. Преджелтушныйпериод характеризует острое, иногда бурное начало. Продолжительность его не превышает 3–4 дней. В отличие от острого ВГB более чем у половины больных температура тела выше 38 °С, появляются артралгии и боли в правом подреберье, у отдельных больных отмечают уртикарную сыпь на коже. Через 2–3 дня моча становится тёмной, кал обесцвечивается, увели- чиваются печень и селезёнка, появляется желтушность склер и кожи. В желтушном периоде самочувствие больных ухудшается, нарастают симптомы интоксикации, температура тела остаётся повышенной ещё 3–4 дня, не прекра- щаются боли в суставах, а боли в правом подреберье регистрируют чаще, чем до появления желтухи, и они носят постоянный характер. При осмотре больных обращает на себя внимание значительное увеличение и плотность как печени, так и селезёнки. Более чем у 40% больных появляется отёчно-асцитический синдром. В сыворотке крови — гипербилирубинемия (сохра- няется обычно более 2 мес), гиперферментемия (нередко с извращением коэф- фициента де Ритиса). Активность АЛТ и АСТ остаётся высокой дольше, чем при ВГB и гепатите смешанной этиологии, причём практически ни у одного пациента уровень активности ферментов не достигает нормы. В отличие от других вирусных гепатитов при остром гепатите дельта у носи- телей HBSAg существенно нарушается белково-синтетическая функция печени, что проявляется снижением показателя сулемовой пробы уже в первые 10 дней желтушного периода и повышением тимоловой пробы. Выраженность клинических симптомов у отдель- ных больных уменьшается при каждой новой волне, а у других заболевание при- нимает прогредиентный характер: развиваются подострая дистрофия печени, печёночная энцефалопатия, и наступает летальный исход. Выздоровление наступает крайне редко, исходы почти всегда неблагоприят- ны: либо летальный исход (при фульминантной форме или при тяжёлой форме с развитием подострой дистрофии печени), либо формирование хронического ВГD (примерно у 80%) с высокой активностью процесса и быстрым переходом в цирроз печени. Ещё один возможный вариант суперинфекции — заражение дельта-вирусом больных ХГB. Клинически это проявляется обострением до того благоприятно протекающего гепатита, появлением интоксикации, желтухи, гиперферментемии, а также прогрессией в цирроз печени.
ДиагностикаВирусный гепатит смешанной этиологии можно предположить при соответствующем эпидемиологическом анамнезе (переливание крови, внутривенное введение наркотиков и др., многократные парентеральные вмешательства и т.д.), более остром, чем при ВГB, начале заболевания, лихорадке, непродолжительном преджелтушном периоде с болями в правом подреберье и суставах, двухволновом и более тяжёлом течении гепатита, выраженной гиперферментемии, повышении (нерезком) показателей тимоловой пробы. Специфическая диагностика основана на выявлении маркёров активной репликации обоих вирусов: HBV, HDV (табл. 18-5). С первых дней появления желтухи в сыворотке крови обнаруживают HBSAg, анти-HBV IgM в высоком титре, HBE- антиген, HDAg и/или анти-дельта (анти-дельта IgM). Анти-дельта IgM вырабатываются уже в остром периоде и служат основным маркёром дельта-инфекции. Их можно определить в течение 1–3 нед в высоком титре, затем они перестают выявляться, анти-дельта IgG выявляют уже через 1–3 нед от начала желтушного периода болезни. Однако приблизительно у 20% больных не удаётся выявить анти-дельта IgM, а выявление анти-HD IgG может задерживаться на 30–60 дней, и в этом случае дельта-инфекция не будет диагностирована, если не проверять анти- HD IgG в сыворотке крови повторно. Методом ПЦР РНК HDV в сыворотке крови определяют в течение 1–3 нед от начала желтушного периода. В сыворотке крови пациентов с суперинфекцией в продромальном периоде и с первых дней желтушного периода выявляют HBSAg, HBCAg или анти-HBE, но анти-НВС IgM отсутствуют. Также выявляют анти-дельта IgM и немного позднее (через 1–2 нед) — анти-дельта IgG. РНК HDV обнаруживают в крови больных как в продромальном периоде, так и с первого дня желтушного периода, и затем постоянно тестируют кровь при развитии хронической инфекции изолированно или наряду с ДНК HBV. При развитии тяжёлого течения гепатита дельта нередко из крови исчезает HBSAg и ДНК HBV, но определяется РНК HDV. Этот феномен большинство исследователей трактуют как следствие подавления репликативной активности HBV дельта вирусом. Предположение об остром ВГD должно возникнуть при очень коротком пред- желтушном периоде, сочетании выраженной гепатоспленомегалии с болями в правом подреберье, отёчно-асцитическим синдромом, лихорадкой, гипербилиру- бинемией, гиперферментемией, низких значениях сулемовой пробы, повышении показателя тимоловой пробы и уровня γ-глобулиновой фракции в сыворотке крови. Острый гепатит дельта следует предположить также при появлении желтухи у «здоровых» носителей HBSAg или при обострении ХГB.
ЛечениеВсе больные острой дельта-вирусной инфекцией подлежат госпитализации. Патогенетическую терапию проводят, как и при ВГB. Вследствие прямого цитопатического действия HDV кортикостероиды противопоказаны.
Гепатит C
Гепатит C (вирусный гепатит C, ВГС, Hepatitis С) — антропонозная инфекцион- ная болезнь с контактным механизмом передачи возбудителя, характеризуемая лёгким или субклиническим течением острого периода болезни, частым формиро- ванием хронического гепатита C, возможным развитием цирроза печени и гепато- целлюлярной карциномы. ЭтиологияВозбудитель — вирус гепатита C (HCV). Относят к семейству Flaviviridae, имеет липидную оболочку, сферическую форму, средний диаметр составляет 50 нм, нуклеокапсид содержит однонитевую линейную РНК. Геном содержит около 9600 нуклеотидов. В геноме HCV выделяют две области, одна из которых (локус соre, Е1 и Е2/NS1) кодирует структурные белки, входящие в состав вириона (нуклеокапсид, белки оболочки), другая (локус NS2, NS3, NS4А, NS4В, NS5А и NS5В) — неструктурные (функциональные) белки, не входящие в состав вириона, но обладающие ферментативной активностью и жизненно необходимые для репли- кации вируса (протеазу, хеликазу, РНК-зависимую РНК-полимеразу). Изучение функциональной роли белков, кодируемых в неструктурной области генома HCV и участвующих в репликации вируса, имеет исключительную важность для создания новых ЛС, которые могли бы блокировать репликацию вируса. в России распространены преимуще- ственно генотипы 1в и 3а. Генотип не влияет на исход инфекции, но позволяет предсказать эффективность лечения и во многих случаях определяет его длитель- ность. Пациенты, инфицированные генотипами 1 и 4, хуже отвечают на противо- вирусную терапию. В качестве экспериментальной модели для изучения ВГC могут выступать только шимпанзе.
ЭпидемиологияВГC — антропоноз; единственный источник (резервуар) возбудителя инфек- ции — человек, больной острым или хроническим гепатитом. ВГC относят к инфекциям с контактным (кровоконтактным) механизмом передачи возбудите- ля, реализация которого происходит естественным (вертикальным — при пере- даче вируса от матери к ребёнку, контактным — при использовании предметов быта и при половых контактах) и искусственным (артифициальным) путями. Искусственный путь заражения может быть реализован посредством гемотранс- фузий инфицированной крови или её препаратов и любых парентеральных мани- пуляций (медицинского и не медицинского характера), сопровождаемых нару- шением целостности кожного покрова и слизистых оболочек, если манипуляции проводились инструментами, контаминированными кровью, содержащей HCV. Естественные пути заражения ВГС реализуются реже, чем при ВГВ, что связано, вероятно, с более низкой концентрацией HCV в биологических субстратах. Риск заражения ребёнка серопозитивной матерью в среднем составляет 2%, возрастает до 7% при выявлении РНК HCV в крови беременной, до 10%, если женщина прак- тикует внутривенное введение наркотиков, и до 20%, если у беременной регистри- руют коинфекцию HCV и ВИЧ. Нет необходимости ограничивать и бытовые контакты, за исключением тех, которые могут повлечь за собой контакт с инфицированной кровью (пользование общей зубной щеткой, бритвой, маникюрными принадлежностями и др.). Заражение постоянных половых партнёров-носителей HCV редко происходит половым путём. Поэтому, рекомендуя носителям HCV ставить в известность об инфекции своих половых партнёров, следует подчеркнуть, что риск передачи при половом контакте настолько мал, что некоторые специалисты считают исполь- зование презервативов необязательным. При большом числе половых партнёров вероятность заражения возрастает. Особая опасность в распространении HCV — внутривенное введение нарко- тических средств без соблюдения правил безопасной инъекционной практики. Возможно также заражение HCV при переливании препаратов инфицированной крови, хотя в последние годы в связи с обязательным определением анти-HCV у доноров число заражённых после гемотрансфузий лиц резко сократилось и составляет 1–2% всех случаев заражения. Однако даже использование высокочувствитель- ного метода ИФА для тестирования донорской крови не позволяет полностью исключить вероятность передачи этой инфекции, поэтому в трансфузиологи- ческую службу в последние годы внедрён метод карантинизации препаратов крови. В некоторых странах мира проводят тестирование донорской крови на присутствие РНК HCV методом ПЦР. Возбудитель может передаваться не только при проведении парентеральных медицинских манипуляций (инъекции, стома- тологические и гинекологические манипуляции, гастро-, колоноскопия и др.), но и при нанесении татуировок, ритуальных надрезов, при проведении пирсинга, маникюра, педикюра и т.д. в случае использования загрязнённых инфицирован- ной кровью инструментов. Хроническая HCV-инфекция — одна из основных причин цирроза печени и наиболее частое показание для ортотопической трансплантации
ПатогенезВГC изучен недостаточно. После инфицирования HCV гематогенно попадает в гепатоциты, где преимущественно и происходит его репликация. Поражение клеток печени обусловлено прямым цитопатическим действием компонентов вируса или вирусспецифических продуктов на клеточные мембраны и структуры гепатоцита и иммунологически опосредованным (в том числе аутоиммунным) повреждением, направленным на внутриклеточные антигены HCV. Течение и исход инфекции HCV (элиминация вируса или его персистенция), определяет прежде всего эффективность иммунного ответа макроорганизма. Морфологические изменения в печени при ВГC неспецифичны. Наблюдают преимущественно лимфоидную инфильтрацию портальных трактов с образова- нием лимфоидных фолликулов, лимфоидную инфильтрацию долек, ступенчатые некрозы, стеатоз, повреждение мелких жёлчных протоков, фиброз печени, кото- рые встречают в различной комбинации и которые определяют степень гисто- логической активности и стадию гепатита
Клиническая картинаИнфицирование HCV приводит к развитию ОГC, в 80% случаев протекающего в безжелтушной форме без клинических проявлений, в результате чего острую фазу заболевания диагностируют редко. Инкубационный период при ОГC колеблется от 2 до 26 нед (в среднем 6–8 нед). Классификация• По наличию желтухи в острой фазе болезни: G Желтушный. G Безжелтушный. • По длительности течения. G Острое (до 3 мес). G Затяжное (более 3 мес). G Хроническое (более 6 мес). • По тяжести. G Лёгкая. G Среднетяжёлая. G Тяжёлая. G Фульминантная. • Осложнения. G Печёночная кома. • Исходы. G Выздоровление. G ХГC. G Цирроз печени. G Гепатоцеллюлярная карцинома. Основные симптомы и динамика их развитияКлинические симптомы ОГC не имеют nпринципиальных отличий от таковых при других парентеральных гепатитах. Длительность преджелтушного периода составляет от нескольких дней до 2 нед, может отсутствовать у 20% больных. В преджелтушном периоде чаще всего преобладает астеновегетативный синдром, выражающийся слабостью, быстрой утомляемостью. Часто возникают диспеп- сические расстройства: снижение аппетита, дискомфорт в правом подреберье, тошнота и рвота. Существенно реже бывает артралгический синдром, возможен кожный зуд. Желтушный период протекает значительно легче, чем при других парентеральных гепатитах. Ведущие симптомы острого периода — слабость, сни- жение аппетита и чувство дискомфорта в животе. Тошноту и зуд встречают у трети больных, головокружение и головную боль — у каждого пятого, рвоту — у каждого десятого больного. Практически у всех больных увеличена печень, у 20% — селе- зёнка. Для ОГC характерны такие же изменения биохимических показателей, как при других парентеральных гепатитах: повышение уровня билирубина (при безжелтушной форме количество билирубина соответствует нормальным показа- телям), значительное повышение активности АЛТ (более чем в 10 раз). Нередко отмечают волнообразный характер гиперферментемии, что не сопровождается ухудшением самочувствия. В большинстве случаев уровень билирубина норма- лизуется к тридцатому дню после появления желтухи. Другие биохимические показатели (осадочные пробы, уровень общего белка и белковых фракций, про- тромбина, холестерина, ЩФ) — обычно в пределах нормальных значений. Иногда регистрируют увеличение содержания ГГТ. В гемограмме тенденция к лейкопении, в моче обнаруживают жёлчные пигменты. ОГC протекает преимущественно в среднетяжёлой форме, у 30% больных — в лёгкой. Возможно тяжёлое течение болезни (редко), а фульминантный ОГC, приводящий к летальному исходу, встречают очень редко. У 70–80% лиц, перенёсших острую форму болезни, происходит формиро- вание хронического гепатита, который выступает наиболее распространённой патологией среди хронических вирусных поражений печени. Формирование ХГC может сопровождать нормализация клинико-биохимических показателей вслед за острым периодом, однако, в последующем вновь появляется гиперферментемия и РНК HCV в сыворотке крови. Особенность ХГC — латентное или малосимптомное течение в продолжение многих лет, обычно без желтухи. Повышение активности АЛТ и АСТ, выявление анти-HCV и РНК HCV в сыворотке крови в течение не менее 6 мес — основные признаки ХГC.
ДиагностикаКлинические симптомы при ОГC у значительной части больных слабо выра- жены, поэтому диагностика ОГC основана на комплексной оценке данных эпи- демиологического анамнеза в сроки, соответствующие инкубационному периоду, желтухи, увеличения показателей билирубина, повышения уровня АЛТ более чем в 10 раз, наличия впервые выявленных маркёров ВГC (анти-HCV, РНК HCV) при исключении гепатитов другой природы. Учитывая, что у большинства больных ОГC отсутствуют клинические признаки острого гепатита, а имеющие- ся серологические и биохимические проявления не всегда позволяют отличить острый гепатит от обострения хронического, диагноз ОГC устанавливают в тех случаях, когда наряду с характерными клинико-эпидемиологическими и биохи- мическими данными при первичном исследовании сыворотки крови отсутствуют антитела к HCV, которые появляются спустя 4–6 и более недель от начала болез- ни. Для диагностики ОГC можно прибегнуть к выявлению вирусной РНК мето- дом ПЦР, так как её можно обнаружить уже в первые 1–2 нед заболевания, в то время как антитела появляются только через несколько недель. Использование тест-систем третьего поколения, значительно более чувствительных и специфич- ных, позволяет выявить анти-HCV в сыворотке крови уже через 7–10 дней от начала желтухи. Анти-HCV можно обнаружить как при ОГC, так и при ХГC. Современные тест-системы позволяют повысить выявляемость анти-HCV у 98–100% иммунокомпетентных инфицированных лиц, в то время как у иммунокомпроментированных пациентов частота выявления анти-HCV значительно ниже. Однако золотой стандарт диагностики ХГС — пункционная биопсия печени, которая показана пациентам, имеющим диагности- ческие критерии хронического гепатита. Цели проведения пункционной биопсии печени — установление степени активности некротических и воспалительных изменений в ткани печени (определение ИГА), уточнение степени выраженности и распространённости фиброза — стадии болезни (определение индекса фиброза), а также оценка эффективности лечения.
ЛечениеГоспитализация показана при остром вирусном гепатите и подозрении на вирус- ный гепатит. Режим. Диета Режим полупостельный при лёгком и среднетяжёлом ОГC. При тяжёлом тече- нии ОГC строгий постельный режим. При ХГC — соблюдение режима труда и отдыха, не рекомендованы работа в ночную смену и на производствах, связанных с токсическими продуктами, командировки, поднятие тяжестей и др. Диета щадящая (по кулинарной обработке и исключению раздражающих веществ), стол № 5. Медикаментозная терапия Стандарт лечения ХГC — стандартный интерферон альфа-2, ком- бинация стандартного интерферона альфа-2 и рибавирина, а также комбинация пегилированного интерферона альфа-2 и рибавирина. Стандартный интерферон альфа-2 назначают в дозе 3 млн МЕ 3 раза в неделю подкожно или внутримы- шечно, пегилированный интерферон альфа-2a назначают в дозе 180 мкг, пеги- лированный интерферон альфа-2b — из расчёта 1,5 мкг/кг — 1 раз в неделю под кожу в течение 48 нед при генотипе 1 и 4, в течение 24 нед при других генотипах. пегасус 180 мкг в неделю подкожно + рибавирин 800-1200 мг в сут, в зависимости от массы. генотип 1ь - 1 год лечения, остальные 6 мес. 3D-терапия; омбитасвир, дасабувир, перитапревир
Фульминантный гепатит.
Такое течение отражает острый массивный лизис инфицированных клеток с ускоренной элиминацией вируса на фоне чрезмерной активации иммунной системы. Сроки развития — 2–8 нед от начала ОВГ.
Клиническая картина характеризуется быстрым нарастанием признаков печеночной недостаточности (желтуха, печеночная энцефалопатия, коагулопатия, асцит, анасарка), развитием полиорганной недостаточности (респираторный дистресс-синдром взрослых, гипотензия, нарушения сердечного ритма, гепато-ренальный синдром). При динамическом осмотре отмечается уменьшение размеров печени.
При лабораторном исследовании выявляют тяжелую коагулопатию, лейкоцитоз, гипонатриемию, гипокалиемию, гипогликемию. Уровни билирубина и трансаминаз значительно повышены. При повторных исследованиях уровни трансаминаз могут снижаться до нормы, несмотря на прогрессирование заболевания.
Биопсию печени при фульминантном гепатите проводят редко из-за наличия противопоказания — тяжелой коагулопатии. Гистологическая картина изучена на аутопсийном материале; в подобных случаях выявляют массивные участки некроза паренхимы (с тотальным вовлечением ацинуса) и коллапс ретикулярной стромы.
Летальность при этой форме течения ОВГ составляет около 60%. Основными причинами смерти являются отек мозга и легких, массивное желудочно-кишечное кровотечение.
При появлении признаков развития фульминантного гепатита необходима срочная госпитализация больного, по возможности в гепатологические центры, где возможно проведение трансплантации печени. В клинике устанавливают наблюдение за состоянием пациента, проводят контроль рН, содержания электролитов и глюкозы в крови, мониторинг центрального венозного и внутричерепного давления, осуществляют мероприятия по поддержанию жизненно важных функций и лечение осложнений. В частности, назначают маннитол при прогрессировании отека мозга, антибиотики для подавления кишечной микрофлоры и лечения инфекционных осложнений. При отсутствии положительной динамики больного готовят к трансплантации печени.
Дата добавления: 2018-08-06; просмотров: 251; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
