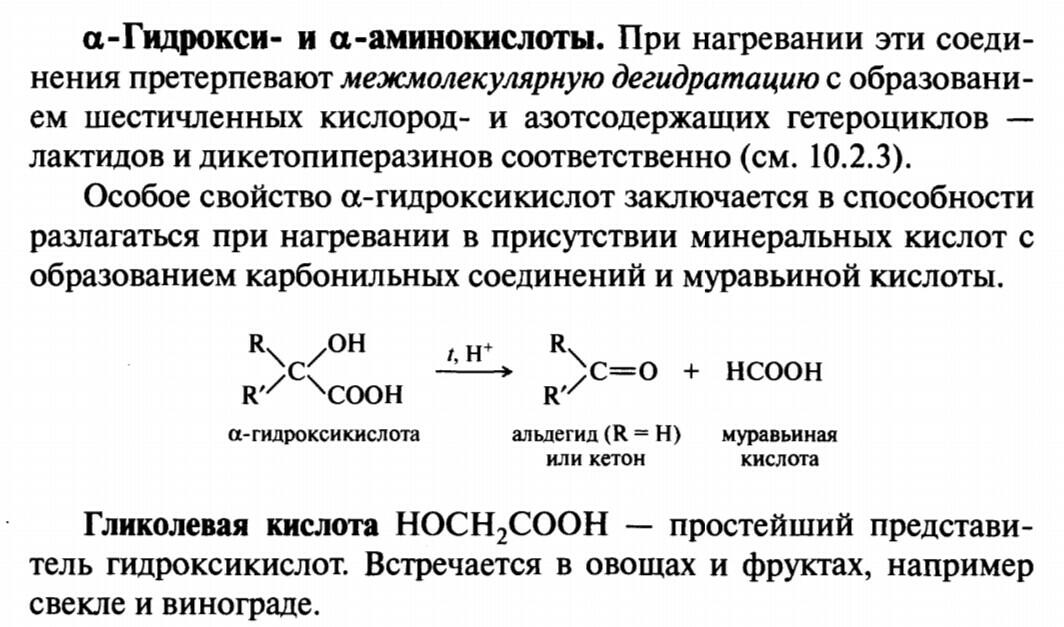
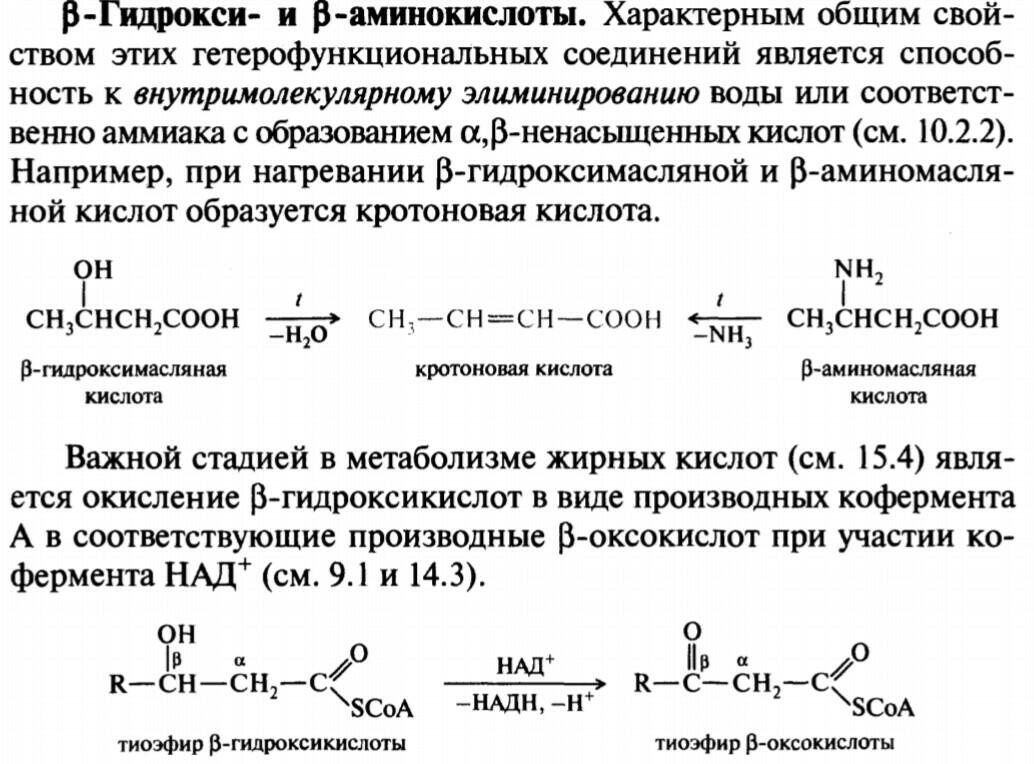
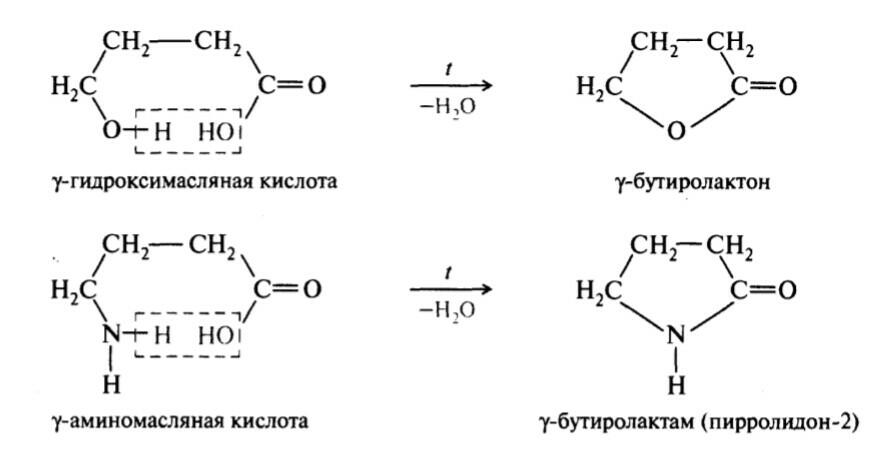
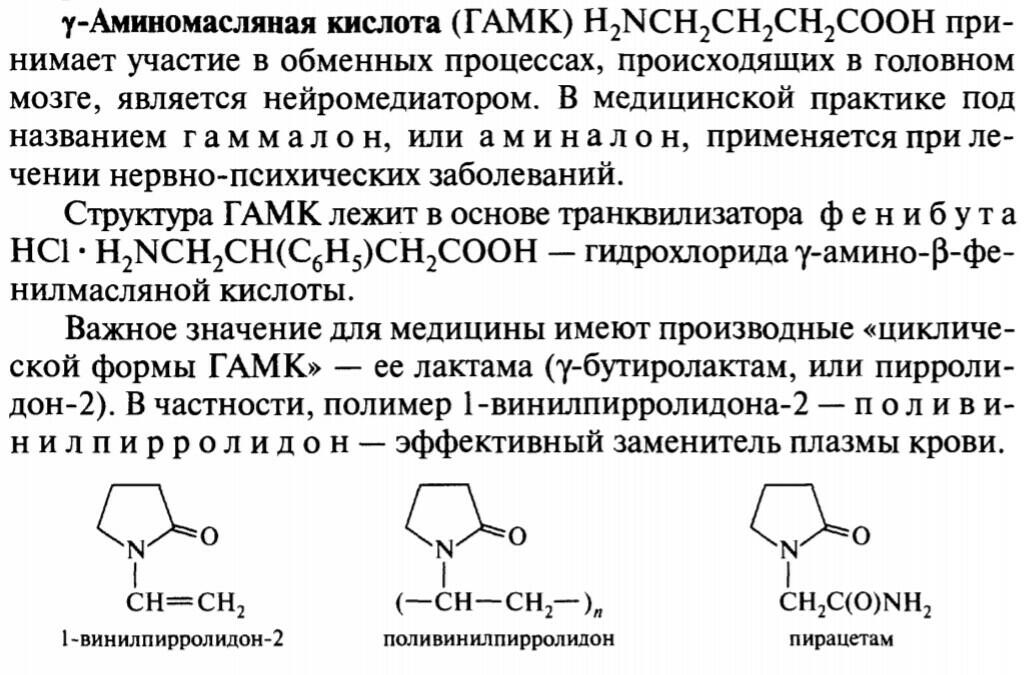
Гидроксикислоты и Аминокислоты









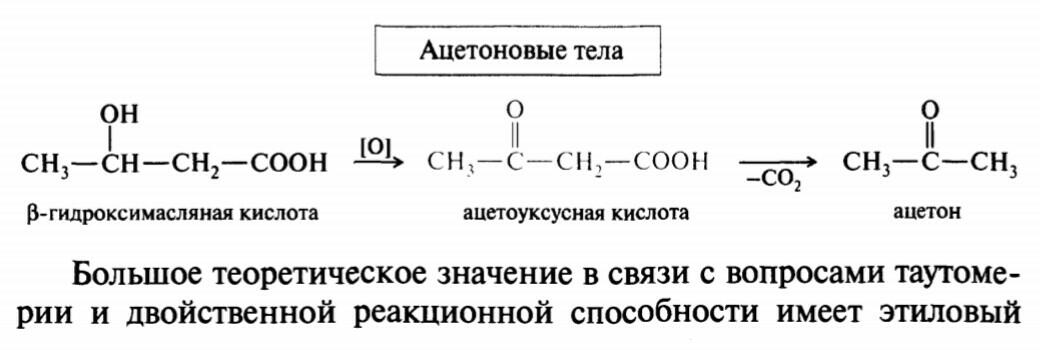
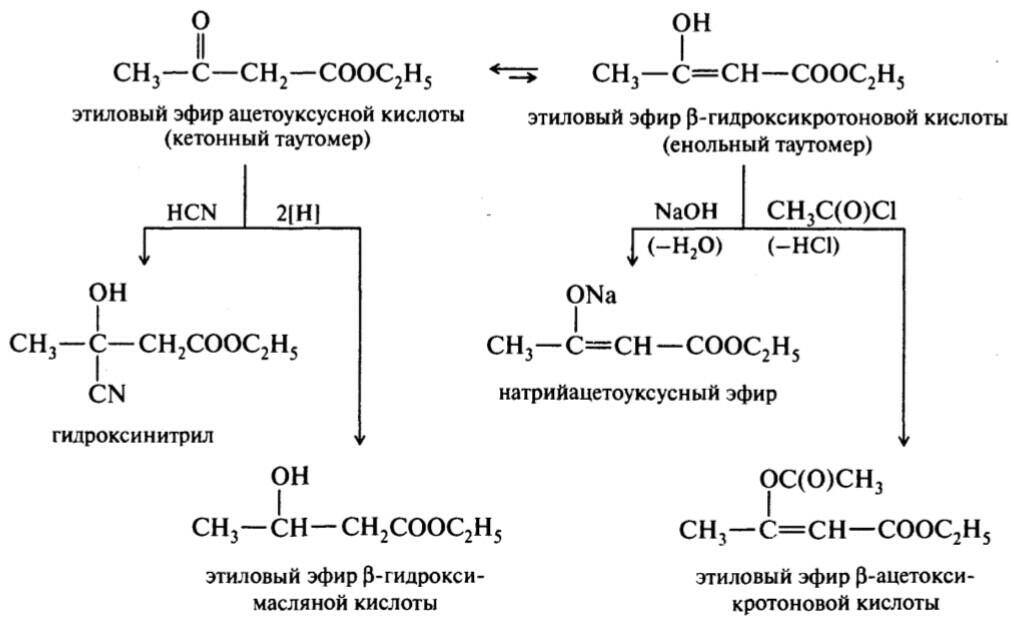
43. Альдегидо- и кетонокислоты
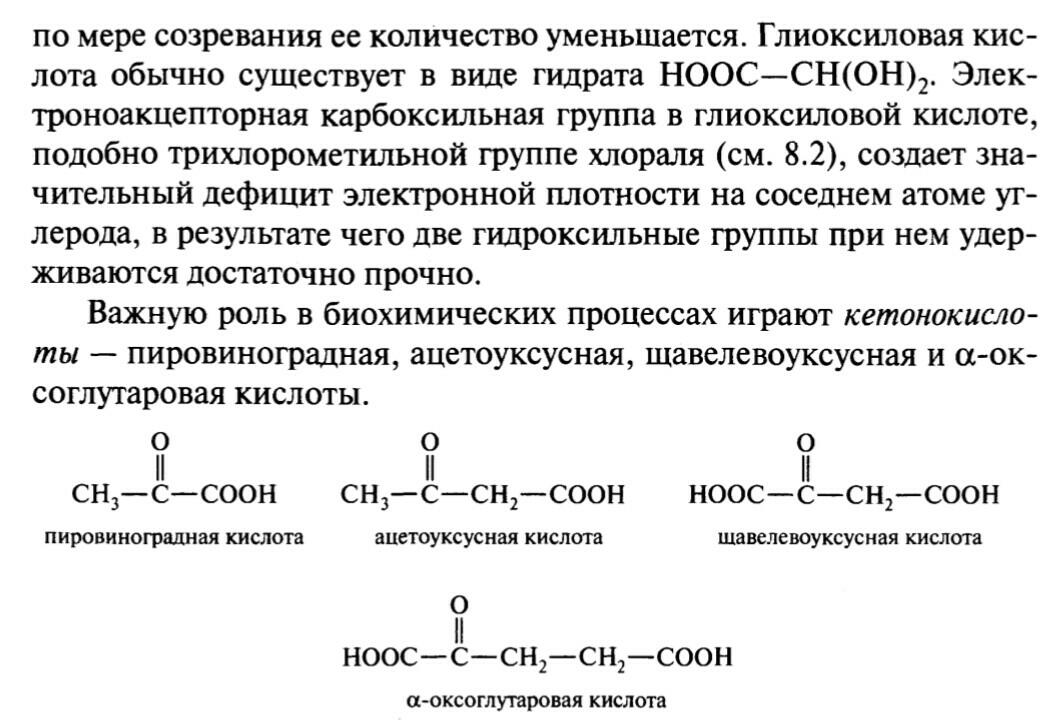
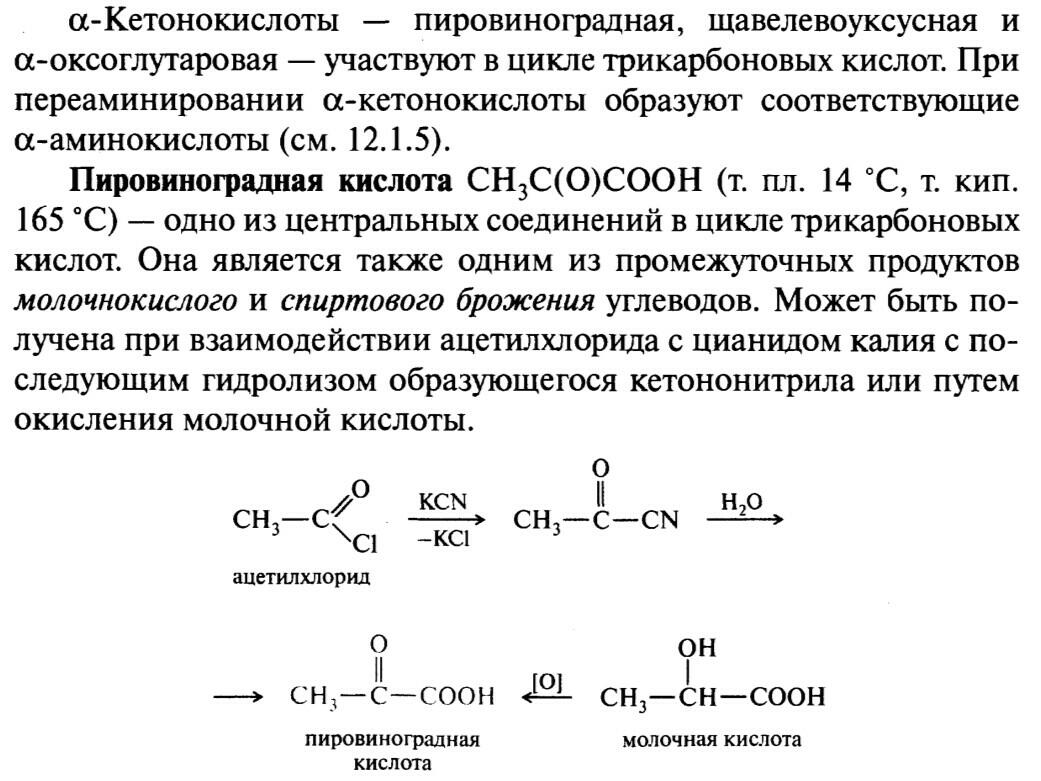
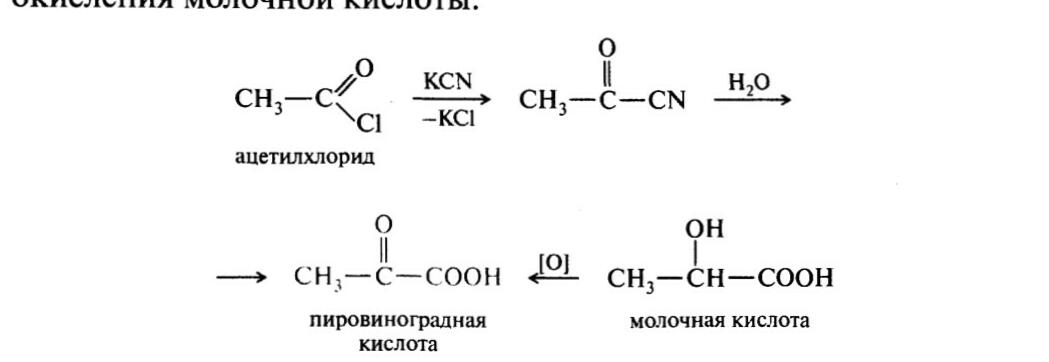

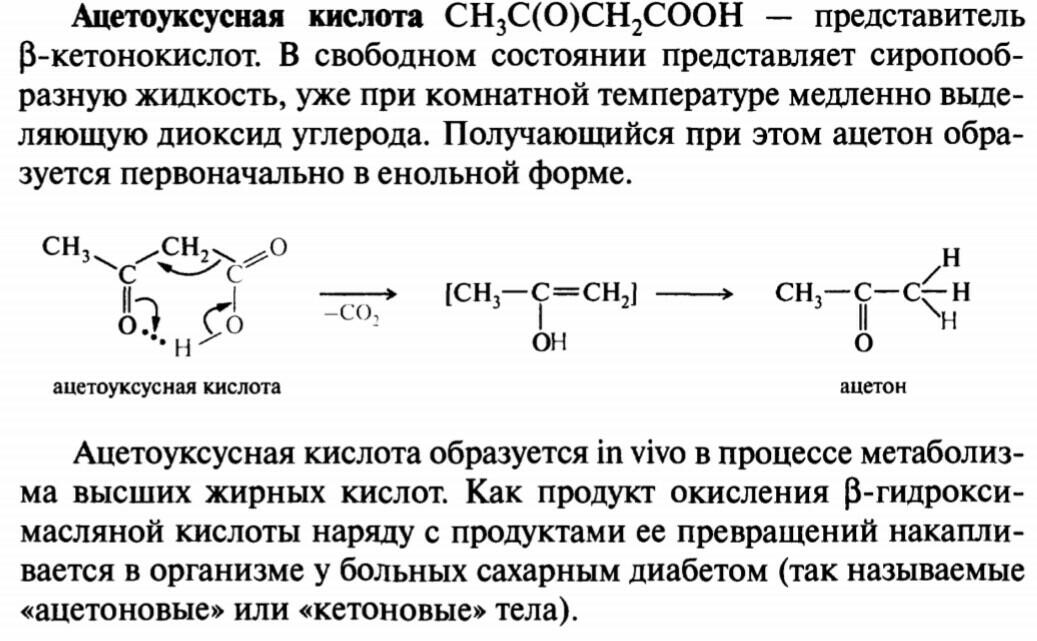


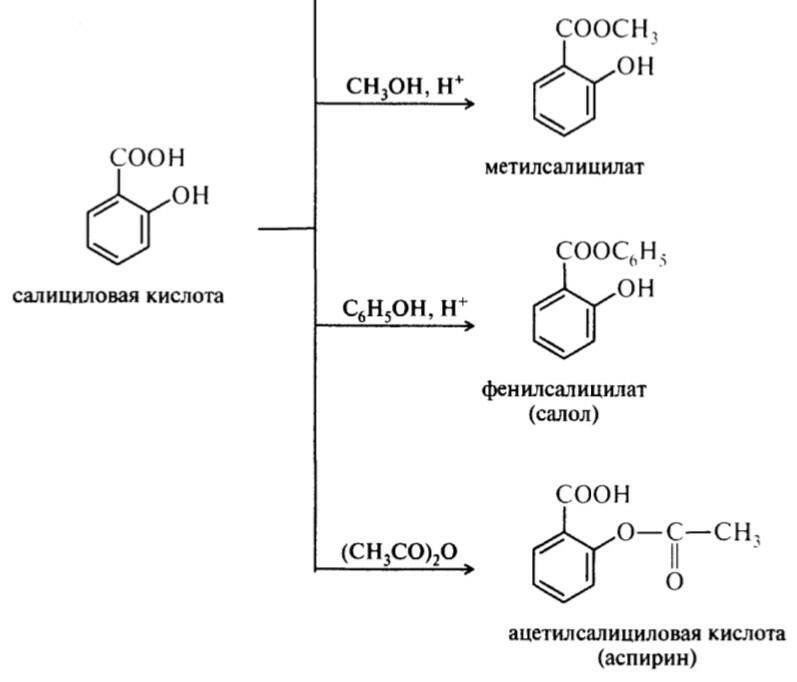
44. Салициловая кислота



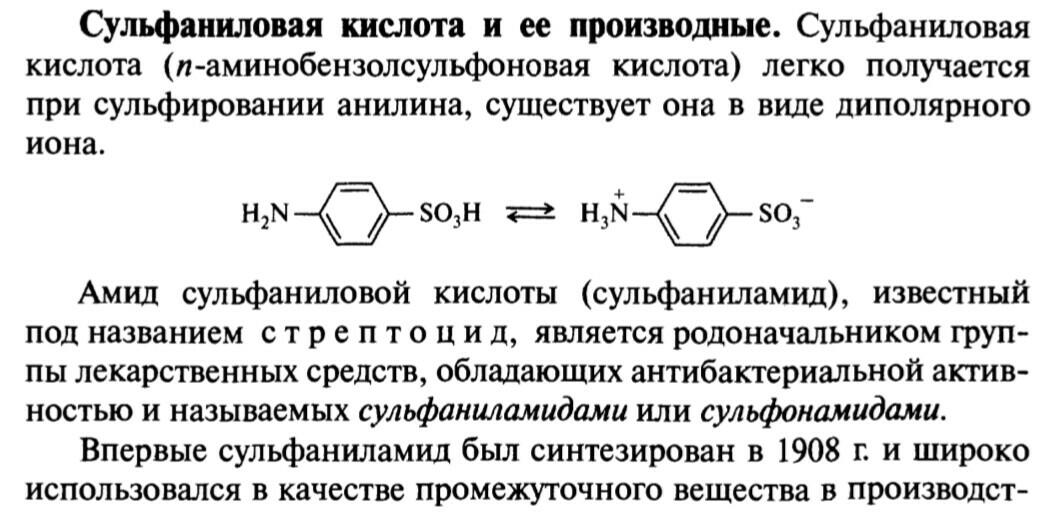
45. Сульфаниловая кислота
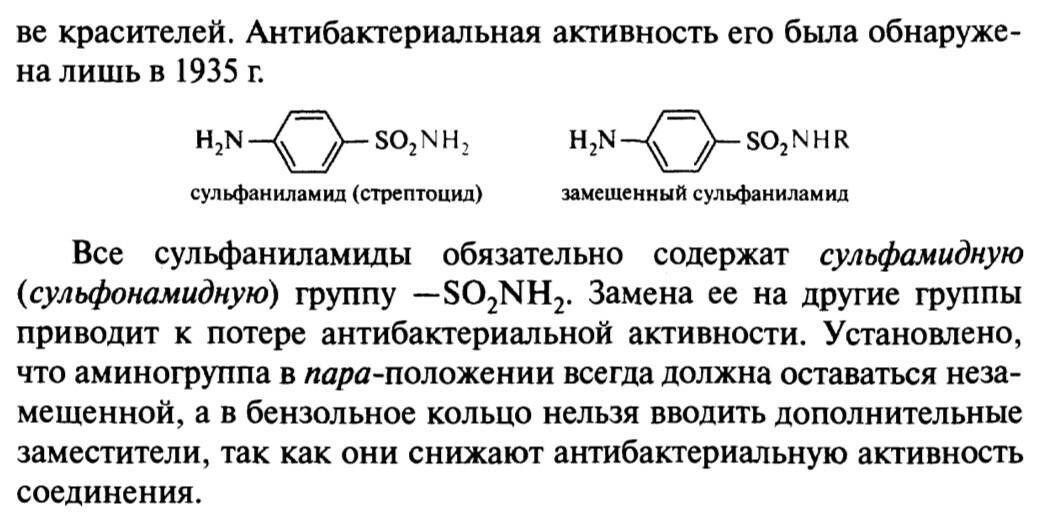
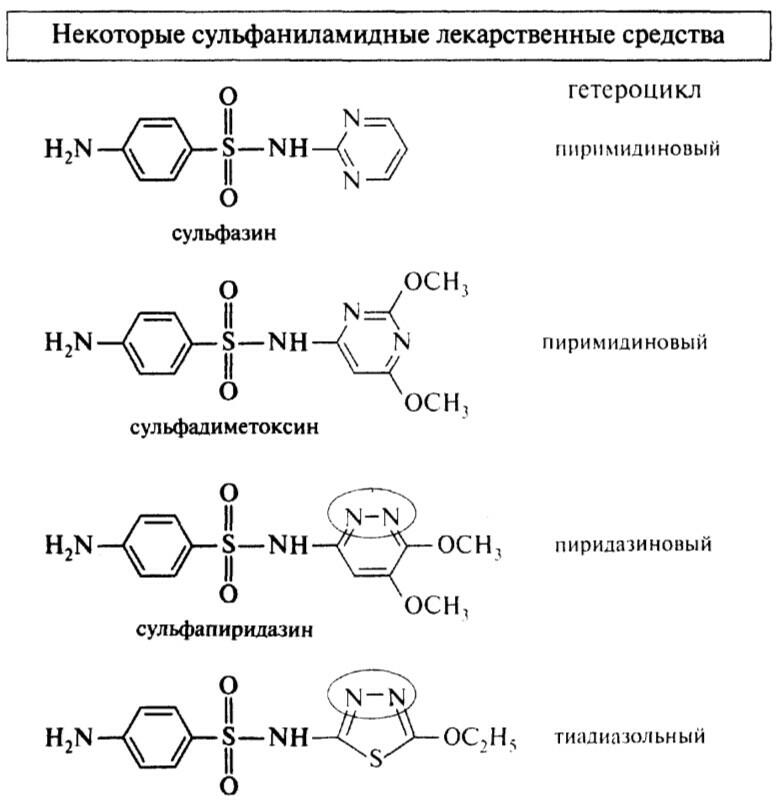

этазол

46. п-аминобензойная
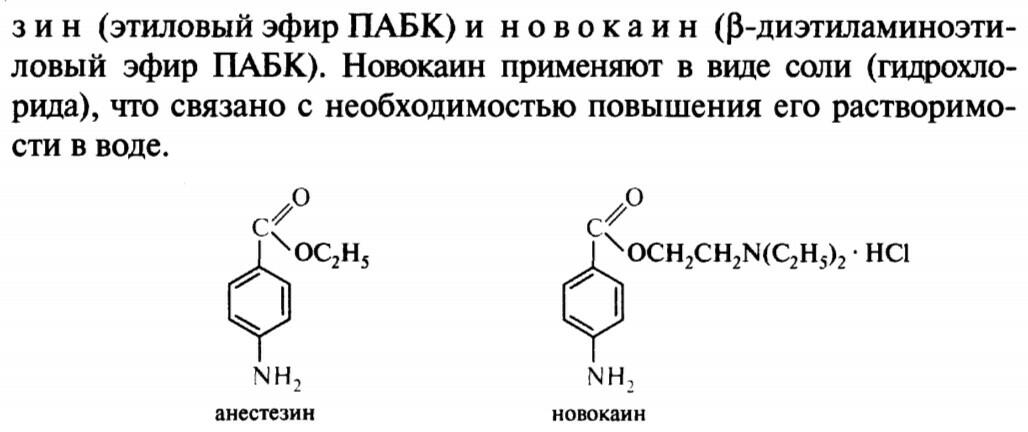

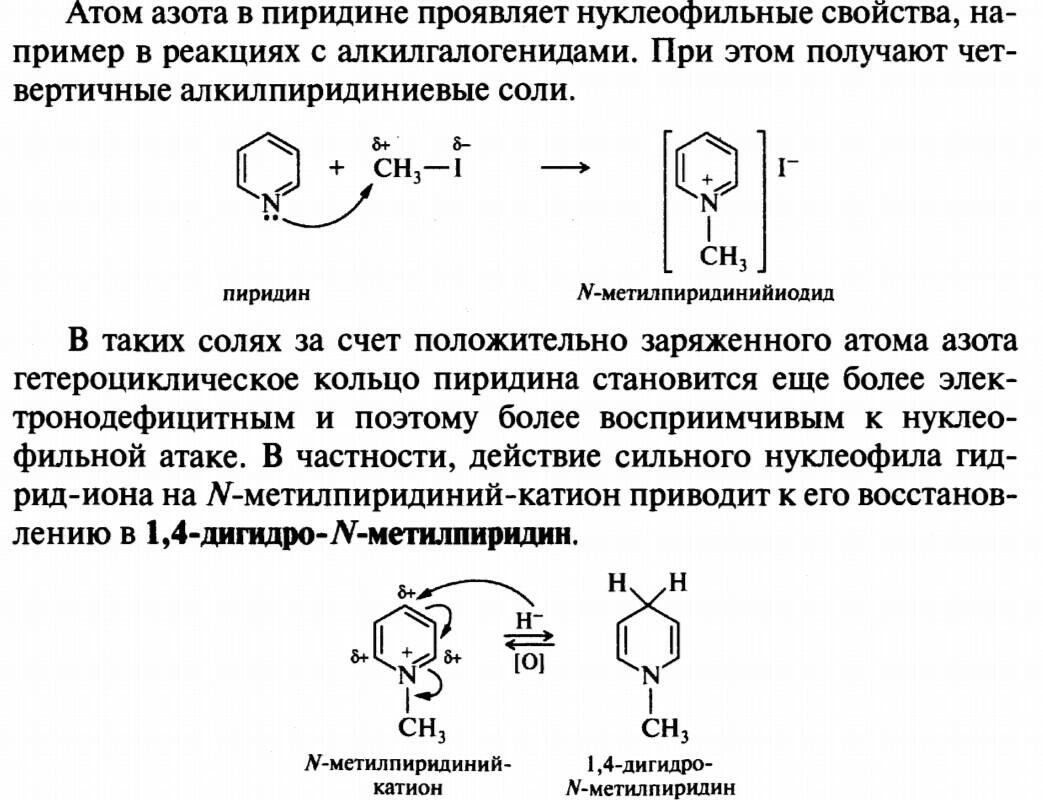
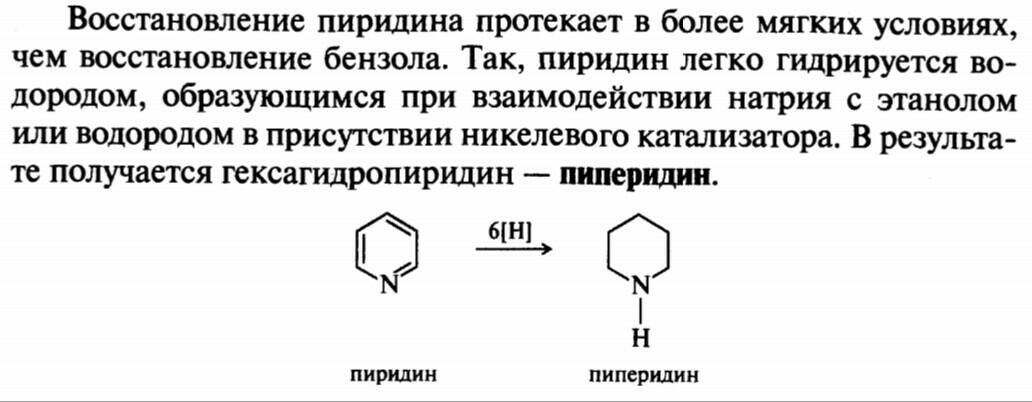
47.пиридин

47.48


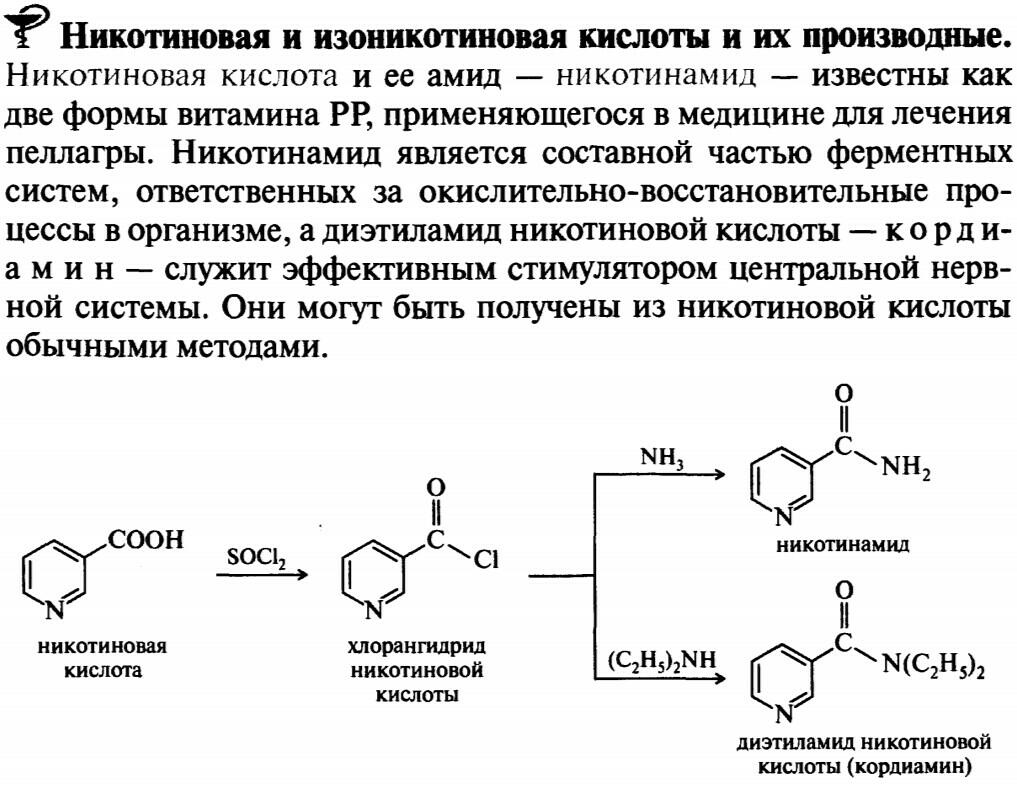
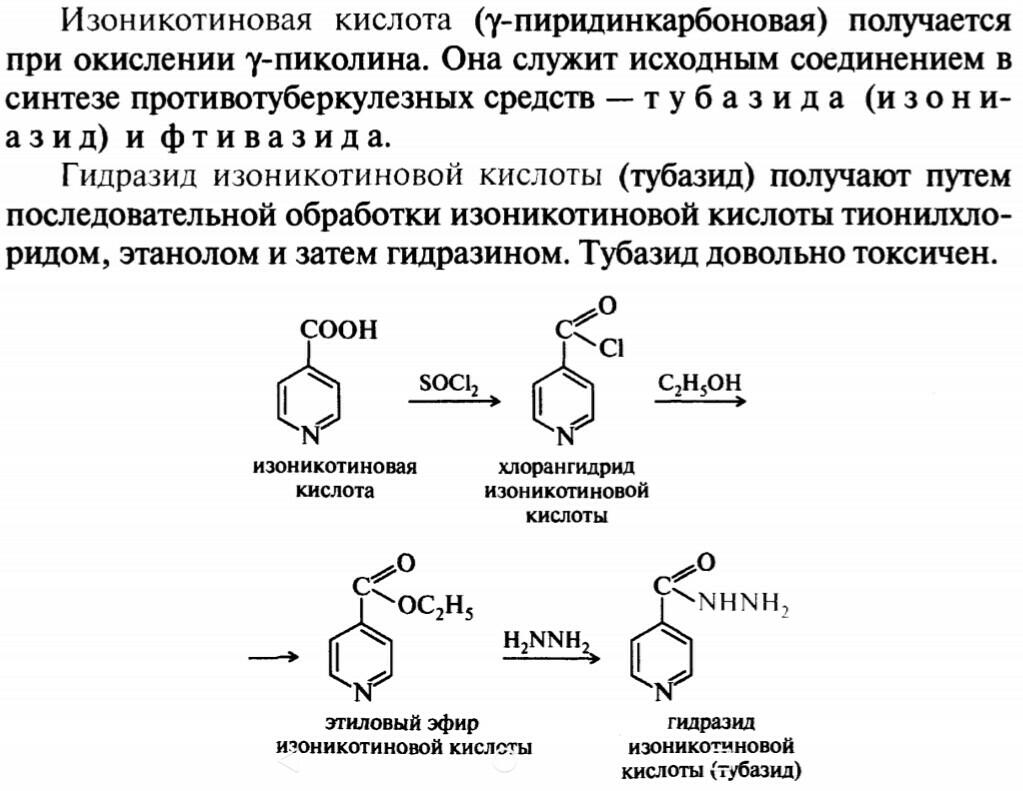
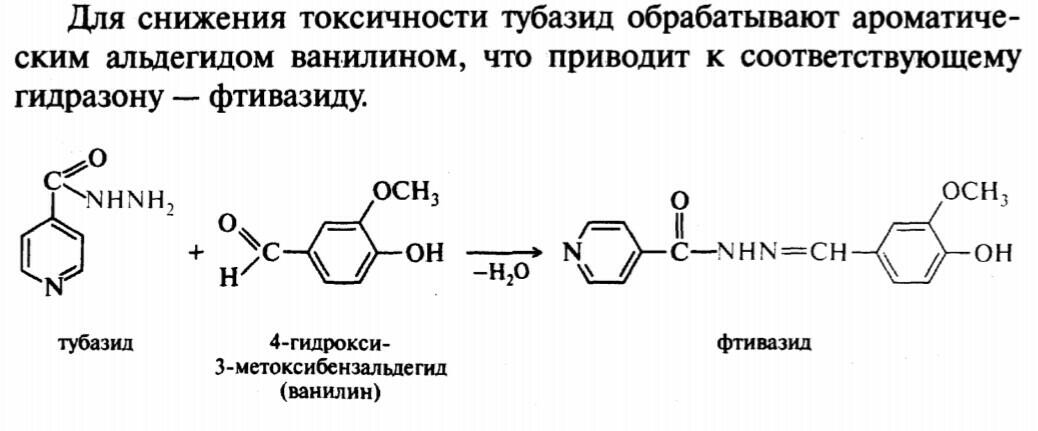
49.
50.
51.
52.
53.
54.
55.
56.
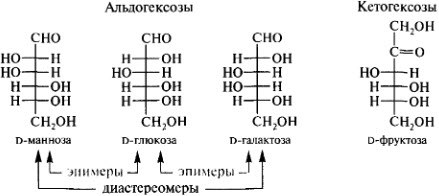
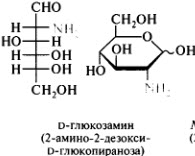
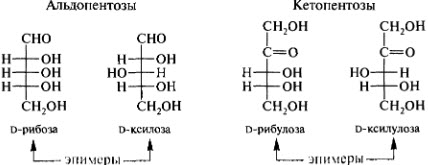
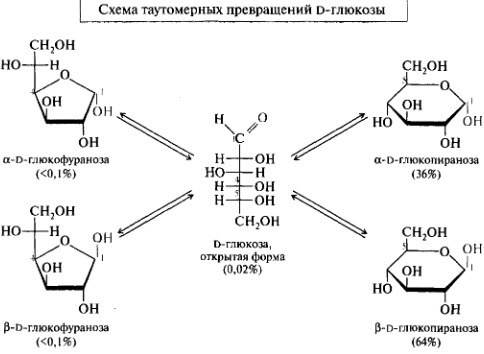
57.Гексозы: глюкоза, манноза, галактоза, фруктоза, глюкозамин. Стереоизомерия

Циклические формы моносахаридов. Цикло-оксо-таутомерия на примере глюкозы. Формулы Хеуорса.
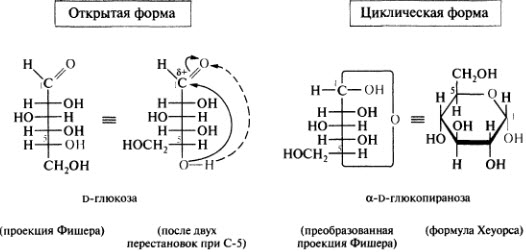
Формулы Хеуорса изображаются в виде плоских многоугольников . Атом кислорода в пиранозном цикле – в дальнем правом углу, в фуранозном –за плоскостью цикла.
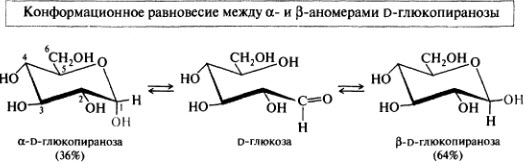
59. а- и b-Аномеры моносахаридов. Муторотация. Конформация моносахаридов.
. 


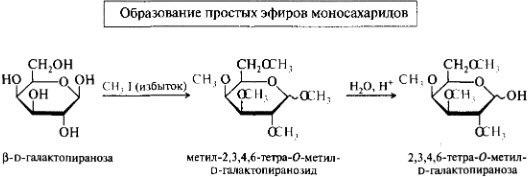
Химические свойства моносахаридов. Реакции карбонильной и гидроксильной групп: образование простых и сложных эфиров, окисление, восстановление.
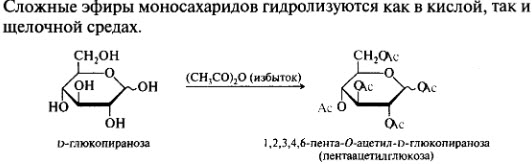
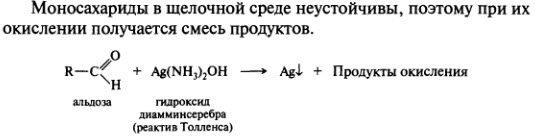
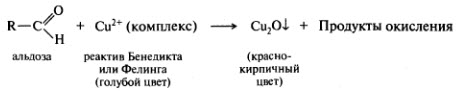
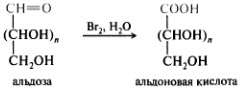
Окисление в кислой среде
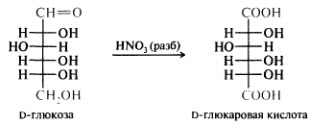
Окисление в нейтральной среде
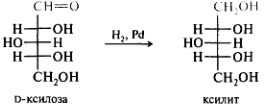
Восстановление
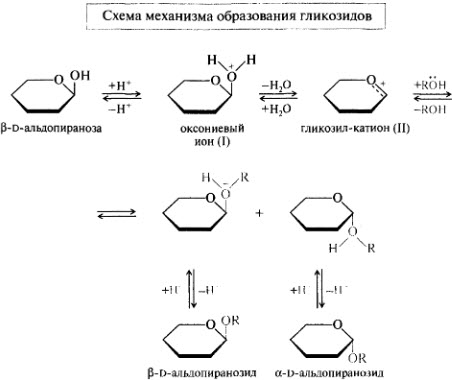
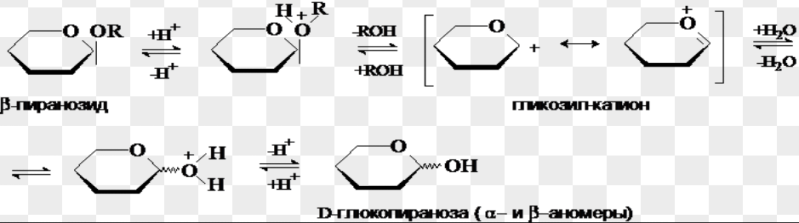
Гликозидный гидроксил моносахаридов. O- иN-гликозиды. Реакции получения и гидролиза.
. 

Фосфаты моносахаридов (глюкозо-6-фосфат). Ацилирование моносахаридов(N-ацетилглюкозамин)
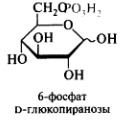

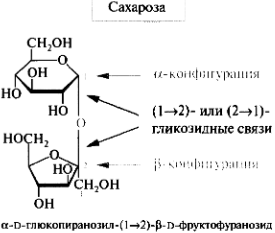
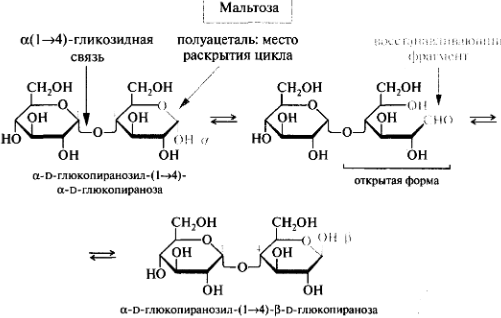
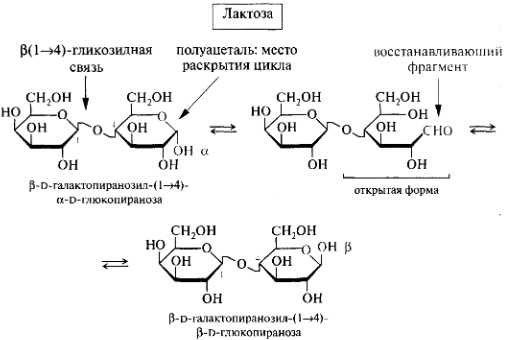
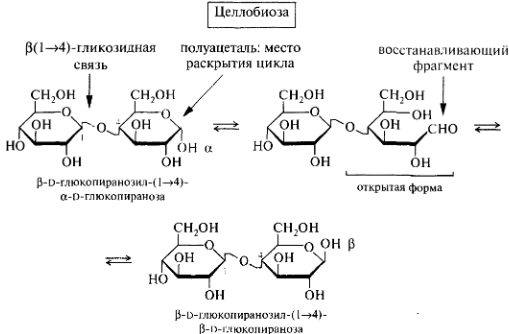
Олигосахариды. Дисахариды. Классификация. Мальтоза, лактоза, сахароза, целлобиоза. Строение и свойства. Цикло-оксо-таутомерия дисахаридов.

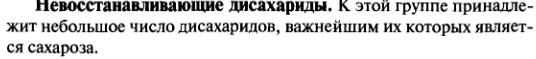
Мальтоза (солодовый сахар) , лактоза(в молоке)
|
|
|
Сахароза(в сахтроснике,) целлобиоза(неполный гидролиз целлюлозы)
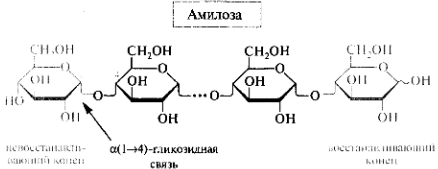
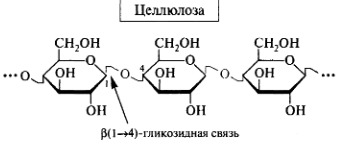
Гомополисахариды: крахмал, гликоген, целлюлоза, декстран. Строение, биологическая роль.
Крахмал состоит из остатков амилозы(10%), амилопектина (90%). Запасной полисахарид растений, декстрин используется для клея.
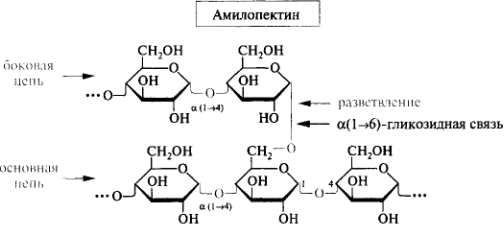
Гликоген то же самое , что и амилопектин , запасной полисахарид животных и человека.
Функции: чувство насыщения, перильстатикажкт , витамин В, выведение токсичных веществ из кишечника.
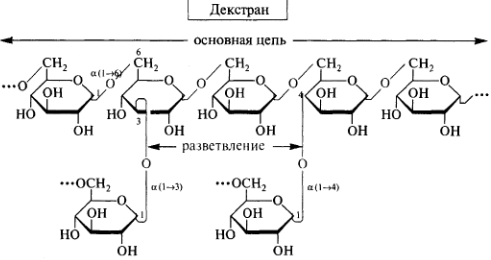
Функции: молекулярные сита, плазмозамещающие растворы .
65. Гетерополисахариды
73) Пептиды и белки представляют собой соединения, построенные из остатков α-амино- кислот, соединенных пептидной (амидной связью). Условно считают, что пептиды содержат в молекуле до 100, а белки — более 100 аминокислотных остатков. В группе пептидов принято различать олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды в состав которых входит до 100 аминокислотных остатков.
Пептидную или белковую молекулу можно представить как продукт поликонденсации α-аминокислот, протекающей с образованием пептидной связи.
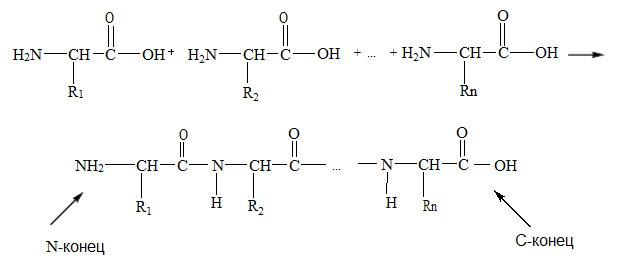
Названия пептидов строятся путем последовательного перечисления аминокислотных остатков, начиная с N-конца. При этом суффикс -ин заменяется на суффикс -ил для всех аминокислот, кроме С-концевой, для которой сохраняется ее полное название.
|
|
|
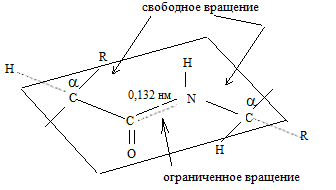
ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ ГРУППЫ
Пептидная связь имеет плоскостную структуру: атомы С, О и N находятся в sp2-гибридизации; у атома N имеется р-орбиталь с неподеленной парой электронов; образуется р-p-сопряженная система, приводящая к укорочению связи С–N (0,132 нм). Наличие плоской сопряженной системы является причиной затруднения вращения вокруг связи C–N (барьер вращения составляет ~63 кДж/моль). Таким образом, электронное строение предопределяет достаточно жесткую плоскую структуру пептидной группы. α-Углеродные атомы аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С–N, т. е. в более выгодном транс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет однотипное строение и может быть представлена в виде ряда расположенных под углом друг к другу плоскостей пептидных групп, соединенных между собой через α-углеродные атомы связями Сa–N и Сa–Сsp2. Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.
|
|
|
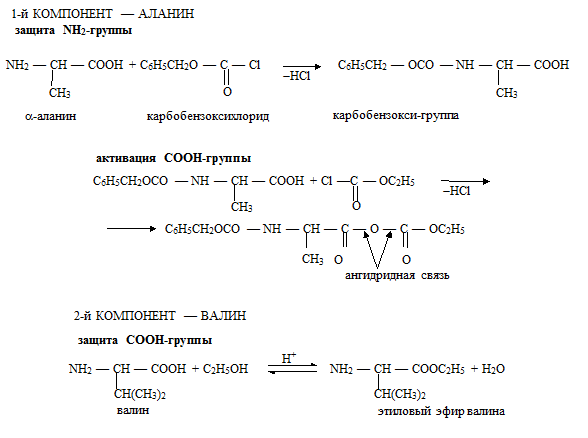
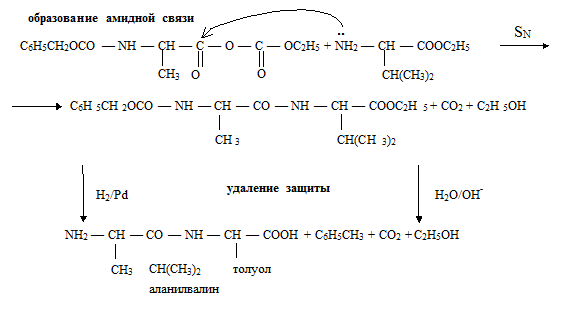
75) ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
Классический синтез пептидов осуществляется в растворе. В настоящее время раз- работана стратегия синтеза пептидов, заключающаяся в использовании на соответствую- щих этапах защиты (блокирования) одних и активации других функциональных групп.
Активными должны быть функциональные группы, образующие амидную связь, т. е. кар- боксильная группа одной аминокислоты и аминогруппа другой аминокислоты.
Схема синтеза дипептида аланилвалина
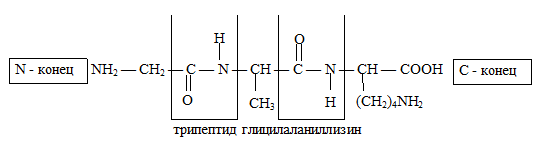
76) Первичная структура пептидов и белков — это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами.
ДЕНАТУРАЦИЯ
Пространственная структура белков способна нарушаться под влиянием ряда факторов — повышенной температуры, изменения рН среды, облучения ультрафиолетовым светом или рентгеновскими лучами, механическом воздействии (например, сильном перемешивании растворов), действии химических агентов (мочевины, хлорида гуанидиния, меркаптоэтанола, додецилсульфата натрия, солей). Разрушение природной, нативной макроструктуры белков называется денатурацией.
|
|
|
При денатурации разрушаются, как правило, нековалентные взаимодействия, стабилизирующие структуру белка. Первичная структура при денатурации сохраняется.
У денатурированных белков снижается растворимость, а главное — исчезает биологическая активность. Денатурация может быть обратимой или необратимой. При обратимой денатурации, удалив диализом денатурирующие агенты, можно вновь получить активный (ренатурированный) белок.
77)Нуклеиновые кислоты обеспечивают хранение и передачу наследственной информации, непосредственно участвуют в механизмах реализации этой информации путем про- граммированного синтеза всех клеточных белков. Нуклеиновые кислоты представляют со- бой высокомолекулярные соединения, молекулярная масса которых колеблется в пределах от 25 тыс до 1 млн дальтон и более. Полимерные цепи нуклеиновых кислот построены из мономерныхединицкленоутидов , в связи с чем нуклеиновые кислоты называют полинук- леотидами. Существуют два типа нуклеиновых кислот — ДНК и РНК, различающиеся по молекулярной массе, составу азотистых оснований, сахаров, устойчивости и функциям.
Нуклеиновые кислоты (НК) обладают выраженными кислотными свойствами (обу-
словленными наличием остатков ортофосфорной кислоты в их составе) и при физиологических значениях трН несу отрицательный заряд. Этим объясняется одно из важных свойств нуклеиновых кислот взаимодействовать по типу ионной связи с основными белками (гисто- нами и др.). Так, ДНК содержится в ядре клетки в виде комплексов с белками — нуклеопротеинов. НК также образуют ионные связи с катионами металлов, преимущественно с Мg2+.
При полном гидролизе нуклеиновых кислот (нагревании в присутствии хлорной кислоты) в гидролизате обнаруживаются пуриновые и пиримидиновые основания, углеводы (ри- боза и дезоксирибоза) и фосфорная кислота:

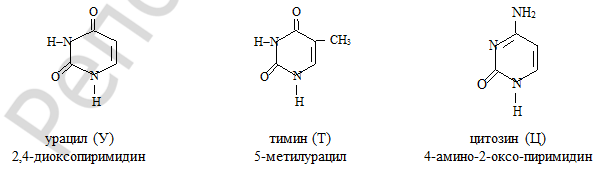
78-79)Пиримидиновые основания.
Пуриновые основания.
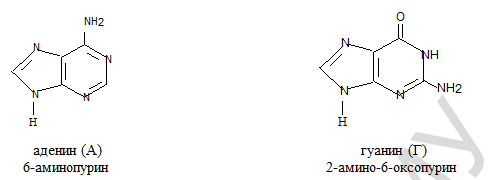
Пиримидиновые и пуриновые основания проявляют ароматический характер: имеют плоскостную структуру, так как входящие в их состав атомы С и N находятся в sp2-гибри- дизации, замкнутую сопряженную систему, охватывающую все атомы цикла и содержащую (4n+2) p-электронов. Ароматичность гетероциклов лежит в основе их относительно высокой термодинамической стабильности.
Нуклеиновые основания растворимы в воде, их растворы имеют слабощелочную реак- цию среды (рН 8–9).
Известно, что гидрокси- и аминопроизводные гетероциклического ряда способны к лактим-лактамной и амино-аминнойттоамуерии. Таутомерные формы образуются в ре- зультате перехода протона (Н+) от кислотного центра (ОН- или NH2 группа) к основному центру (:N). При физиологических условиях нуклеиновые основания существуют только в лактамной и аминной формах. В лактамных формах гетероциклы сохраняют ароматич- ность и имеют плоскостное строение.
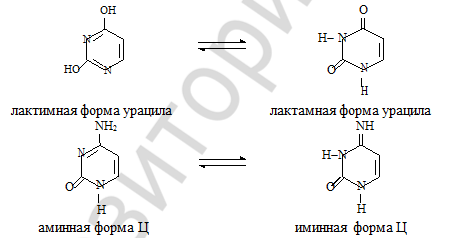
80) Водородные связи между комплементарными основаниями — это один из видов взаимодействия, стабилизирующих двойную спираль. Данный вид взаимодействия называют «поперечным» в отличие от «вертикального» (стэкинг-взаимодействия). Две цепи ДНК, образующие двойную спираль, не идентичны, но комплементарны друг другу. Это означает, что первичная структура, т. е. нуклеотидная последовательность, одной цепи предопределяет первичную структуру второй цепи.
Пуриновые и пиримидиновые основания нуклеотидных звеньев направлены внутрь двойной спирали. Между пуриновым основанием со стороны одной цепи и пиримидиновым основанием со стороны другой цепи образуются водородные связи. Эти основания, связанные водородными связями составляют комплементарные пары.
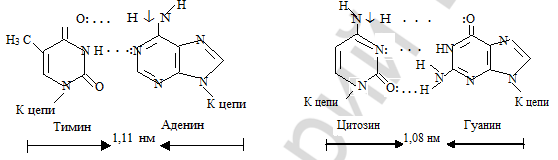
Водородные связи возникают между аминогруппой (кислотный центр) одного основа- ния и кетогруппой (основной центр) другого NН ... О = С. Например, адениновому основа- нию в одной цепи будет соответствовать тиминовое в другой цепи. Таким образом, А и Т, а также Г и Ц являются парами комплементарных оснований. В основе комплементарности лежит принцип максимума водородных связей и, соответственно, прочность взаимодействия. Между Г и Ц образуются три водородные связи (ГºЦ), а между А и Т — две (А=Т). По этой причине пара ГЦ связана несколько прочнее и более компактна: ее геометрический размер 1,08 нм, сравнительно с 1,11 нм у пары АТ.
Дата добавления: 2018-08-06; просмотров: 2259; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
