Слияние (фузия) вирусной оболочки и плазматической мембраны
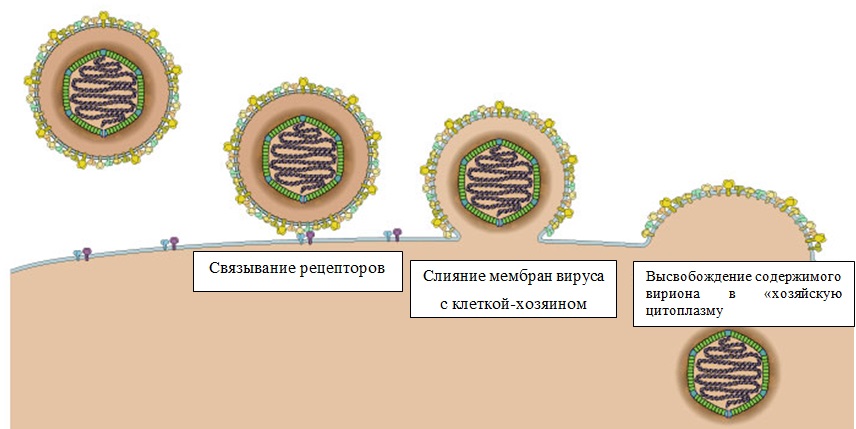
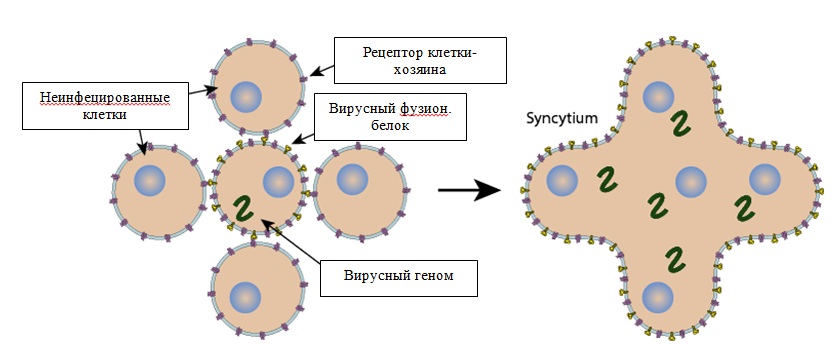
Некоторые вирусы способны непосредственно сливать их мембраны с плазматическими мембранами клетки без использования механизма эндоцитоза или макропиноцитоза. Это способность дает им возможность, так называемой, клеточной синцитии.
Синцития образуется путем слияния зараженных клеток с соседними клетками, ведущие к образованию расширенных мультиядерных клеток. Она происходит только у вирусов, способных непосредственно сливаться с плазматической мембраной с помощью фузии (характерно для Herpesviridae, Paramixoviridea, Poxviridea, Reoviridea, Retroviridea).
Процесс фузии
ü Слияние обеспечивают фузионные белки вируса, претерпевающие при этом конформационные изменения.
ü Триггером фузии служит связывание фузионных белков вируса с клеточными рецепторами.
ü Все фузионные белки активны в тримерной конформации. Большинство тримерно изначально; некоторые являются димерами и трансформируются в триммеры только при активации.
ü Внутри клетки вирусные фузионные белки синтезируются в неактивной форме. Активация происходит в транс-Гольджи сети либо на клеточной мембране путем протеолитического расщепления.
Характерен для: Coronaviridae, Betacoronavirus, Herpesviridae, Paramyxoviridae, Morbilivirus, Plasmaviridae(?), Poxviridae, Retroviridae, Tectiviridae, Tectivirus.
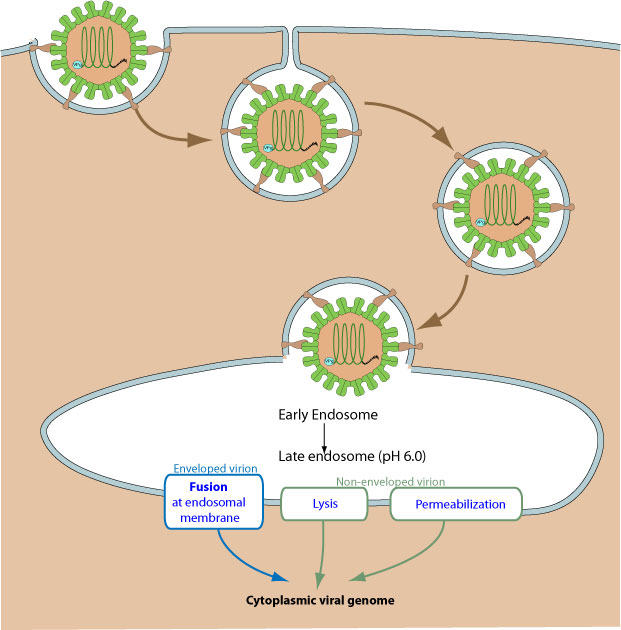
Слияние вирусной оболочки и эндосомальной мембраны
ü Asfaviridae (вирус африканской лихорадки свиней)
ü Flaviviridae (HCV)
ü Coronaviridae (SARS human coronavirus)
|
|
|
ü Arenaviridae (вирус лимфоцитарного хориоменингита, вирус лихорадки Ласса)
ü Ofthomyxoviridae (вирус гриппа А)
ü Retroviridae (HIV-1)
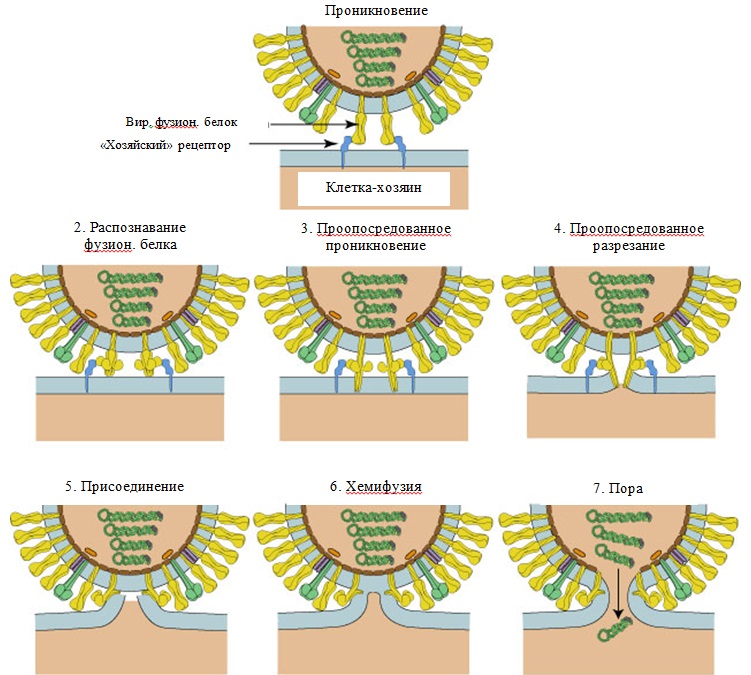
Проникновение с образованием поры
Пороопосредованное проникновение вирусного генома в клетку хозяина

Некоторые безоболочечные вирусы вводят свой геном в цитоплазму клетки-хозяина посредством создания поры в «хозяйской» мембране. Это обеспечивается с помощью вирусного порообразующего пептида, связанного с капсидом.
Икосаэдрический капсид пикорнавирусов способен создавть пору либо с плазматической, либо эндосаомльной мембраной, чтобы передать их геномную РНК.
Папиллома- и полиомавирусы кажется, осуществляют вход в эндоплазматический ретикулум, где происходит «раздевание» капсида, при этом выпускаются порообразущие белки, которые вызывают впрыск геномной ДНК в цитоплазму клетки.
Прокариотические вирусы, такие как caudovirales, выпускают свой геном в «хозяйскую» цитоплазму через сложный «аппарат выброса» Этот механизм часто включает в себя образование поры в плазматической мембране.
Характернодля: Picornaviridea, Poliovirus, Polyomaviridea, Papillomaviridea, Nodaviridea (?), Podoviridea, Humanrhinovirus 2.
Фузионный механизм «слияния вируса с помощью поры», модель Ли К
Эндоцитоз
|
|
|
Эндоцитоз (англ. endocytosis) — процесс захвата (интернализации) внешнего материала клеткой, осуществляемый путём образования мембранных везикул.
В результате эндоцитоза клетка получает для своей жизнедеятельности гидрофильный материал, который иначе не проникает через липидный бислой клеточной мембраны. Различают фагоцитоз, пиноцитоз и рецептор-опосредованный эндоцитоз.
Рецептор-опосредованный эндоцитоз — активный специфический процесс, при котором клеточная мембрана выпучивается внутрь клетки, формируя окаймлённые ямки.
Внутриклеточная сторона окаймлённой ямки содержит набор адаптивных белков (адаптин, клатрин, обуславливающий необходимую кривизну выпучивания, и др. белки). Макромолекулы, связывающиеся со специфическими рецепторами на поверхности клетки, проходят внутрь со значительно большей скоростью, чем вещества, поступающие в клетки за счет пиноцитоза. Внешняя сторона мембраны при этом включает специфические рецепторы (например, ЛПНП-рецептор). При связывании лиганда из окружающей клетку среды окаймлённые ямки формируют внутриклеточные везикулы (окаймлённые пузырьки).
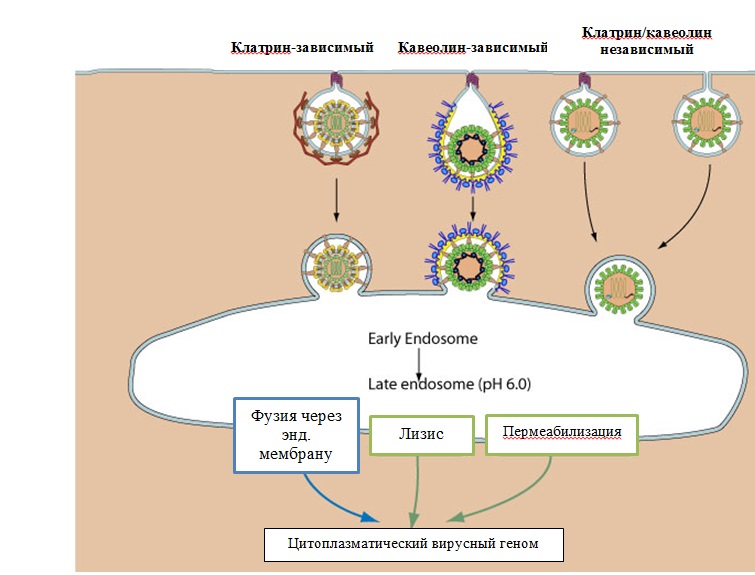
Эндоцитоз:
Ø Рецепторный эндоцитоз
- Клатрин-зависимый;
- Кавеолин-зависимый;
|
|
|
- Клатрин/кавеолин независимый.
Ø Макропиноцитоз.
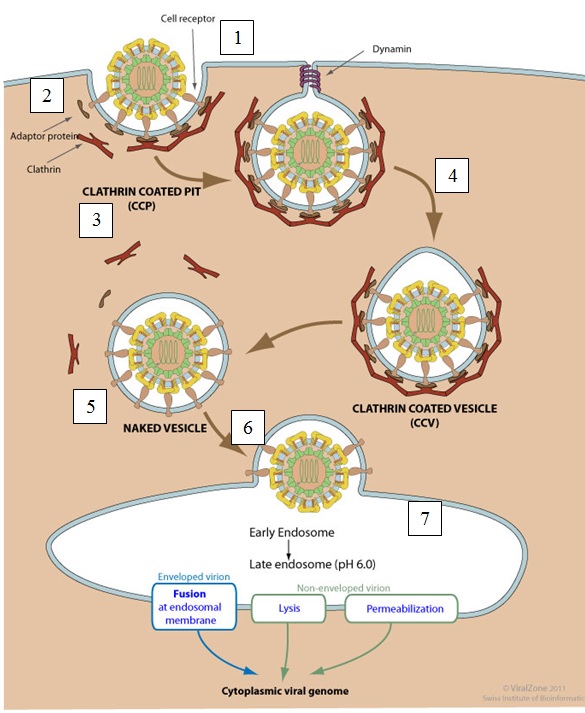 Клатрин-зависимый эндоцитоз
Клатрин-зависимый эндоцитоз
Наиболее хорошо изучен и понят. Ранее его называли «Рецептивный» (рецепторно-зависимый) эндоцитоз (Receptor-mediated endocytosis).
1)Клатрин-зависимый эндоцитоз ициируется после связывания вириона с рецептором клетки-хозяина;
2)Прикрепление вирионов к рецептору клетки-хозяина связывает адаптер белка с концом цитоплазматического рецептора;
3)Адаптер белка связывается с клатрином, и локальная концентрация адаптерных белков на внутренней поверхности плазматической мембраны позволяет клатрину мультимеризоваться, и образовать «опушенную» ямку (coated pit);
4)Белки DNM1/Dynamin-1 или DNM2/Dynamin-2 отрезают мембрану и отщипывают «опушенную» ямку, так, чтобы образуется «опушенный» пузырек (coated vesicle);
5)«Клатриновая корзинка» впоследствии освобождается от пузырька;
6)Везикула затем доставляет вирусное содержимое в раннюю эндосому;
7)Кислый эндосомальный pH и/или связывание с рецептором вызывает структурные изменения поверхностных белков вируса, что приводит к проникновению генома в цитоплазму через механизм слияния, лизиса или пермеабилизации.
Клатрин-зависимый эндоцитоз
ü Adenoviridae (Ad2, Ad5, Ad8, Ad37)
|
|
|
ü Papillomaviridae (HPV16)
ü Parvoviridae (AVV-2, AVV-5)
ü Reoviridae (BTV)
ü Flaviviridae (HCV, вирусклещевогоэнцефалита)
ü Picornaviridae (вирус ящура, риновирус человека 2-типа)
ü Togavindae (вирус краснухи)
ü Filoviridae (Ebola virus)
ü Orthomixoviridae (вирус гриппа A)
ü Retroviridae (HIV-1)
 Кавеолин-зависимый эндоцитоз
Кавеолин-зависимый эндоцитоз
1) Интернализация вируса в клетки-хозяина осществляется через специальные «липидные кавеолиновые плоты», которые могут образовывать колбовидные инвагинации плазматические мембраны;
2) Кавеолины формируют структурную основу кавеол* (CAV1/caveolin-1 and CAV2/caveolin-2; CAV3/caveolin-3 мышечных клетках). Интернализация через кавеолы не конструктивный процесс, но происходит только после стимуляции клетки. Интернализированные вирусы связываются с рецепторами клетки-хозяина;
3) Белки DNM1/Dynamin-1 или DNM2/Dynamin-2 отрезают мембрану и отщипывают кавеолу;
4) Кавеолы доставляют вирус в раннюю эндосому (проникают путем фузии)**;
5) Кислый эндосомальный pH и/или связывание с рецептором вызывает структурные изменения поверхностных белков вируса, что приводит к проникновению генома в цитоплазму через механизм слияния, лизиса или пермеабилизации.
*Формирование кавеол обеспечивается белками кавеолинами, которые деформируют фосфолипидный бислой, взаимодействуя с холестеролом. Кавеолин-1 – интегральный белок плазмалеммы с центральным гидрофобным доменом, формирующим петлю. Оба конца, и N, и C выходят в цитоплазму, т.е., кавеолин-1 имеет топологию шпильки (hairpin). Кавеолин-1 – основной формообразующий белок кавеол, он формирует «скелет» кавеолы вместе с другими формами кавеолина. «Скелет» определяет форму кавеол, размеры и многие их свойства. Недавно открытые белки кавины формируют наружный периферический слой, имеют форму крупных гетероолигомерных комплексов, покрывающих изогнутую мембрану кавеолы. Полагают, что кавины стабилизируют «скелет» кавеолы, обеспечивают изгиб мембраны, участвуют в почковании кавеолы.
**В отличие от «клатриновых» пузырьков, кавеолы не сбрасывают свое кавеолиновое «покрытие» при отшнуровке и попадании в цитоплазму.
Кавеолин-зависимый эндоцитоз
ü Papillomaviridae (HPV-31)
ü Picornaviridae (Poliovirus, Echovirus 1)
ü Polyomaviridae (SV40, BK polyomavirus)
ü Retroviridae (Amhotropic murine leukemia virus)
ü Hepadnaviridae (HBV)
Клатрин/кавеолин независимый
(включила на всякий случай, мало ли спросит)
Эндоцитоз этого типа также обеспечивает интернализацию микродоменов, и протекает в клетках при блокировании клатрин-зависимого и кавеолин-1 зависимого эндоцитоза. Этот вариант эндоцитоза зависит от наличия холестерола, т.е., представляет собой разновидность эндоцитоза, зависящую от определенной композиции липидов в мембране (рафт-зависимый эндоцитоз). Показано, что данная разновидность эндоцитоза, в частности, обеспечивает интернализацию внеклеточной жидкости, вируса SV40, холерного токсина, некоторых сфинголипидов, рецепторов интерлейкина-2, гормона роста, эндотелина и многих других белков. Все эти белки связываются с плазматической мембраной посредством трансмембранных белков, имеющих гликозилфосфатидилинозитоловый якорь (glycosylphosphatidylinositol anchor) - GPI-linked proteins. Эти заякоренные связывающие белки локализуются в детергент-устойчивых областях плазмалеммы и не содержатся в области клатриновых пузырьков и кавеол. Лиганды, интернализуемые путем данного эндоцитоза, также попадают в эндосому, однако динамика этого процесса отличается от таковой при других типах эндоцитоза.
Дата добавления: 2018-06-01; просмотров: 2007; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
